Одной из наиболее острых проблем, с которыми сталкиваются пациенты в программах вспомогательных репродуктивных технологий (ВРТ), являются повторные неудачи имплантации (ПНИ) [1]. Единого формального определения ПНИ не существует. Bashiri A. et al. предполагают, что о ПНИ можно говорить после 3 неудачных попыток имплантации подряд при условии переноса эмбрионов хорошего качества [2]; другие авторы заявляют, что достаточно как минимум 2 эмбрионов хорошего качества [3]; третьи предлагают учитывать состояние не только эмбриона, но и эндометрия [4]. Coughlan С. et al. определяют ПНИ как неудачу имплантации после переноса 4 эмбрионов хорошего качества как минимум в 3 циклах ЭКО (нативных или размороженных) у женщин в возрасте до 40 лет [5]. Рекомендации Европейской ассоциации репродукции и эмбриологии (ESHRE) в 2023 г. описывают ПНИ у отдельно взятой супружеской пары в программе ВРТ с расчетом вероятности биохимической беременности по формуле: [вероятность имплантации]n=1-[(1-PR)]n, где PR – частота наступления беременности (или коэффициент рождаемости ×1,16). По мнению консенсуса, целесообразно всегда учитывать анамнез супружеской пары, возраст и другие клинические характеристики, которые могут быть причиной отсутствия имплантации эмбриона в полости матки у конкретной пары.
Существует целый комплекс возможных причин и факторов риска ПНИ. Одним из главных факторов является материнский возраст [5, 6], поскольку он влияет как на качество эмбриона, так и на рецептивность эндометрия. С увеличением возраста повышается частота биохимической беременности и асинхронии эмбриона и эндометрия [7]. Именно поэтому целесообразно при разработке новых подходов к оптимизации программ лечения бесплодия методами ВРТ уделить внимание возрасту женщины.
Одним из подходов к терапии ПНИ является совершенствование условий культивирования эмбрионов in vitro, в частности — использование методов сокультивирования. В качестве «подложки» для эмбрионов и зигот были предложены разные клетки репродуктивных тканей (кумулюс, эндометрий, эпителий маточных труб и др.). Выбор клеток кумулюса в этом отношении обусловлен доступностью и простотой выделения для последующего использования в программах лечения бесплодия методами ВРТ.
Как известно, способность ооцита усваивать глюкозу, холестерин и некоторые аминокислоты ограничена из-за недостаточной экспрессии транспортеров для их поглощения [8]. Более того, основным источником образования АТФ в ооците является окислительное фосфорилирование; однако способность яйцеклетки поглощать и метаболизировать глюкозу в значительной степени слаба. Ооцит зависит от клеток кумулюса, которые поглощают глюкозу и метаболизируют ее посредством гликолиза в пируват, который затем и поступает в ооцит для метаболизма посредством окислительного фосфорилирования. Пируват, продуцируемый в результате гликолиза в клетках кумулюса, необходим для поддержания мейотического созревания ооцитов до стадии метафазы II [8]. При этом механизм взаимодействия клеток кумулюса и ооцита является двунаправленным: ооцит регулирует метаболизм клеток кумулюса, секретируя растворимые факторы роста, нацеленные на клетки кумулюса [9].
Аутологичное сокультивирование эмбрионов с клетками кумулюса в программах ВРТ стало использоваться как один из методов терапии ПНИ, поскольку ранее на животных моделях была показана разница в скорости роста и развития эмбрионов, а также морфологии эмбрионов между группами классического культивирования и сокультивирования с клетками кумулюса [10]. В литературе в настоящее время встречаются противоречивые данные о влиянии сокультивирования эмбрионов с клетками кумулюса на вероятность имплантации и наступления беременности в программах лечения бесплодия методами ВРТ [11]. В нашем предыдущем исследовании аутологичного сокультивирования клеток кумулюса с эмбрионами показано достоверное увеличение числа эмбрионов морфологически лучшего качества в общей когорте женщин с ПНИ [12]. Было показано, что аутологичное сокультивирование эмбрионов с клетками кумулюса в 2,5 раза повышает вероятность имплантации у женщин 23–30 лет, в остальных возрастных группах аутологичное сокультивирование нецелесообразно.
Целью настоящего исследования послужила оценка клинической эффективности программ переноса размороженного эмбриона, полученного при аутологичном сокультивировании с клетками кумулюса в программах экстракорпорального оплодотворения.
Материалы и методы
Настоящее исследование было выполнено на базе отделения вспомогательных технологий в лечении бесплодия им. профессора Б.В. Леонова (руководитель отделения – д.м.н., профессор Калинина Е.А.) Института репродуктивной медицины (директор – д.м.н., профессор Назаренко Т.А.) ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Министерства здравоохранения Российской Федерации (директор – академик РАН Сухих Г.Т.). Набор пациентов с бесплодием в программах ВРТ проводили в соответствии с поставленной целью в период с марта 2017 г. по январь 2019 г. Была проведена оценка 198 программ криопереноса, из них 114 – бластоцисты с сокультивированием с клетками кумулюса, 84 – без сокультивирования. Критерии включения пациенток: отсутствие противопоказаний к лечению бесплодия методами ВРТ согласно Приказу Минздрава России № 107н от 30 августа 2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению»; возраст пациентки от 18 до 40 лет; регулярный менструальный цикл; нормальное анатомическое строение матки; подготовка эндометрия на фоне циклической гормональной терапии; не менее 2 неудачных переносов морфологически нормальной бластоцисты в полость матки (как нативных, так и криоконсервированных). Критерии невключения в исследование: противопоказания к лечению бесплодия методами ВРТ согласно Приказу Минздрава России № 107н от 30 августа 2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению»; менее 2 неудачных попыток ВРТ в анамнезе супружеской пары; врожденные пороки развития внутренних половых органов (включая состояния после хирургической коррекции) или приобретенные деформации полости матки, при которых невозможна имплантация эмбрионов или вынашивание беременности; выраженные формы нарушений сперматогенеза, в том числе оплодотворение сперматозоидами, выделенными из ткани яичка при хирургическом вмешательстве. Все супружеские пары подписали добровольное информированное согласие на участие в исследовании.
Эмбрионы сокультивировали в программе овариальной стимуляции по схеме, описанной ранее [12]. Кратко: в день трансвагинальной пункции клетки кумулюса отрезали стерильным микроинструментом и помещали в отдельную лунку чашки Петри в культуральную среду (G-IVF, Vitrolife, Швеция) до момента использования через 24 ч. Нормально оплодотворенные зиготы помещали в лунку с клетками кумулюса и культивировали до 5 суток. Оценку качества эмбрионов выполняли согласно рекомендациям Российской ассоциации репродукции человека (РАРЧ) (2020). Витрификацию проводили по инструкции производителя на средах Kitazato (Япония). Хранили эмбрионы в условиях жидкого азота до момента криопереноса.
Подготовку эндометрия в криоциклах осуществляли препаратами эстрадиола и прогестерона. На 2–3-й день менструального цикла осуществляли ультразвуковое исследование (УЗИ) органов малого таза и назначали препараты эстрадиола валерата в дозировке 2 мг ежедневно, в дальнейшем отслеживали толщину и структуру эндометрия на 6–8-й и 10–12-й дни менструального цикла. При достижении толщины эндометрия по данным УЗИ более 7–8 мм назначали микронизированный прогестерон по 200 мг 3 раза в сутки согласно инструкции производителя. Размораживание эмбрионов проводили на культуральных средах Kitazato (Япония). Перенос осуществляли одноразовыми атравматичными катетерами СООК (Ирландия) под ультразвуковым контролем. Диагностику наступления беременности проводили по результату исследования β-хорионического гонадотропина (β-ХГЧ) в крови через 14 дней после переноса. При получении данных о положительном результате β-ХГЧ на 21-й день выполняли УЗИ органов малого таза для визуализации плодного яйца в полости матки. Результаты программы криопереноса оценивали через 9 месяцев после регистрации беременности.
Статистический анализ
Для статистического анализа данных на клиническом этапе исследования использовали возможности программы SPSS. Для проверки статистической значимости использовали критерии Фишера и Хи-квадрат. Для оценки связи между определенным исходом и фактором риска рассчитывали отношение шансов (ОШ) с 95% доверительным интервалом (ДИ) и делали вывод о статистической значимости выявленной связи между фактором и исходом. Величину порогового уровня значимости (p) в исследовании принимали равной 0,05.
Результаты
На первом этапе исследования были проанализированы исходы программ переноса размороженного эмбриона при различных методах его культивирования. В полость матки было перенесено 114 эмбрионов, полученных после аутологичного сокультивирования с клетками кумулюса, и 84 – без сокультивирования. Всем пациенткам переносили строго один эмбрион. Клинические исходы показаны в таблице 1.
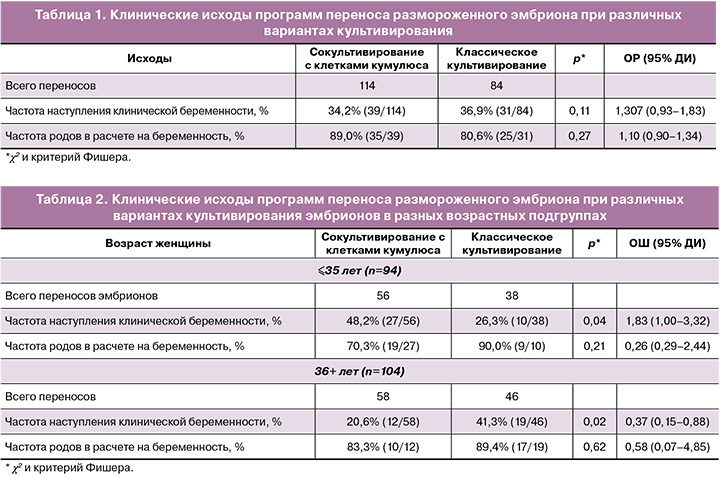
Как видно из представленных данных, частота наступления беременности в криоциклах значимо не различалась между группами и составляла 34,2% для группы сокультивирования и 36,9% – для классического культивирования. Сравнение частоты родов также не показало значимой разницы (89,0 и 80,6%, р=0,27). На следующем этапе была выполнена стратификация пациентов по возрасту, выделены группы женщин ≤35 лет и >36 лет и проведен расчет тех же параметров исходов программ лечения бесплодия. Результаты указаны в таблице 2.
В группе молодых женщин до 35 лет было выполнено 56 переносов в группе сокультивирования с аутологичными клетками кумулюса и 38 – без сокультивирования. Имплантация эмбриона в полости матки произошла в 39,3% случаев (37/94), из них при аутологичном сокультивировании с клетками кумулюса – у 48,2% женщин данной подгруппы (27/56), и у 26,3% (10/38) – в группе без сокультивирования. Данные являются статистически значимыми, р=0,04 (ОШ=1,83; 95% ДИ 1,00–3,32). Можно говорить о том, что аутологичное сокультивирование эмбрионов с клетками кумулюса у пациенток молодого возраста (≤35 лет) с ПНИ способствует наступлению беременности и может быть использовано как технология повышения эффективности программ лечения бесплодия методами ВРТ. При этом частота родов значимо не изменилась у таких пациенток и составила 70,3% в группе аутологичного сокультивирования и 90,0% – без такового (р=0,21).
Анализ данных исходов программ криопереносов в позднем репродуктивном возрасте женщин показал обратную динамику. Всего у женщин старше 35 лет было проведено 104 криопереноса, из них 58 – после аутологичного сокультивирования и 46 – без такового. Частота наступления беременности при переносе эмбриона после сокультивирования составила 20,6%, без сокультивирования – 41,3% (р=0,02; ОШ 0,37; 95% ДИ 0,15–0,88). Как видно из представленных данных, частота имплантации в группе возрастных женщин с ПНИ зависит от метода культивирования эмбриона, а аутологичное сокультивирование эмбрионов с клетками кумулюса значительно ухудшает результативность лечения. Частота родов в расчете на беременность при этом статистически значимо не изменилась (табл. 2).
Полученные данные показывают, что статистически значимо увеличивается частота наступления беременности при сокультивировании аутологичных клеток кумулюса с эмбрионами у молодых пациенток; при этом значимо снижается у женщин старшего репродуктивного возраста в программах криопереноса.
Обсуждение
Аутологичное сокультивирование эмбрионов с клетками кумулюса было предложено как один из методов преодоления ПНИ в программах лечения бесплодия. Однако научные данные оставались противоречивыми, и не был указан контингент пациентов, которым можно рекомендовать данную технологию для повышения результативности. В текущем исследовании нами проведена оценка клинической эффективности переноса размороженных эмбрионов, полученных при различных системах культивирования. Как показал анализ данных, технология аутологичного сокультивирования с клетками кумулюса в группе женщин моложе 35 лет с ПНИ может значительным образом повысить эффективность лечения. Частота наступления беременности у таких пациенток увеличивается с 26,3 до 48,2%. Клетки кумулюса способствуют увеличению имплантационных возможностей эмбриона и позволяют преодолеть нарушения имплантации.
Обратный эффект от действия клеток кумулюса получен у женщин позднего репродуктивного возраста. При аутологичном сокультивировании частота наступления беременности снижается в 2 раза – с 41,3 до 20,6%. То есть можно говорить о «токсическом» эффекте клеток кумулюса «возрастных» пациентов при их добавлении в культуру с эмбрионами. Полученный результат можно объяснить общими механизмами старения яичников, которые наблюдаются с увеличением репродуктивного возраста женщин. Как показывают научные данные, нарушения происходят во всех клетках яичника, особенно в растущих ооцит-кумулюсных комплексах [13]. При этом выделяют период так называемого постовуляторного старения ооцит-кумулюсных комплексов [14]. Авторы данного исследования с помощью омиксных технологий установили механизм, посредством которого клетки кумулюса ускоряют постовуляторное старение через IL1-IL1R1 при взаимодействии цитокин-цитокиновый рецептор. После длительного культивирования ооцитов мышей с клетками кумулюса in vitro было обнаружено множество аномалий, в том числе аномальное распределение агрегированных митохондрий, аномальное повышение уровня АФК, раннее возникновение апоптоза и нарушение развития преимплантационного эмбриона. То есть клетки кумулюса при старении нарушают как морфологию эмбриона, так и его генетический статус [14].
Другими авторами было показано, что клетки кумулюса ускоряют старение ооцитов мыши, секретируя растворимые и термочувствительные паракринные факторы при сверхдлительном культивировании [15]. Даже если клетки кумулюса через щелевые контакты не связаны с ооцитами, происходит их дистантное взаимодействие в капле культуральной среды, куда помещаются зигота и аутологичные клетки кумулюса.
При старении в клетках кумулюса происходят необратимые изменения в виде нарушений функции митохондрий, апоптоза и аномального накопления АТФ [14]. Помещение таких «стареющих» клеток в культуру с эмбрионами может нарушать развитие эмбриона или, по крайней мере, не способствует его имплантации при переносе в полость матки. Именно поэтому полученные результаты указывают на нецелесообразность аутологичного сокультивирования клеток кумулюса с эмбрионами у женщин старше 35 лет.
Наши данные согласуются с результатами Virant-Klun А. et al., которые сравнивали группы ооцитов, культивировавшихся in vitro классическим методом и in vitro с применением сокультивирования у молодых женщин, и обнаружили, что профиль экспрессии генов ооцитов при сокультивировании наиболее схож с таковым при естественном созревании ооцита in vivo. Кроме того, эти две группы образцов имели наибольшее пересечение экспрессированных генов [16]. У молодых пациенток клетки кумулюса действительно могут способствовать «дозреванию» внутриклеточных структур и процессу дробления эмбриона, формируя бластоцисту более хорошего качества.
Частота родов в обеих возрастных группах достоверно не изменялась, что может указывать на присутствие других важных параметров, влияющих на прогрессирование беременности до родов при ПНИ.
Заключение
Персонификация подхода к лечению бесплодия играет важную роль в повышении результативности программ ВРТ; особенно это касается группы пациентов с ПНИ. Данный контингент супружеских пар в клинической практике является одним из наиболее сложных с позиций применения технологий с доказанной эффективностью. В большинстве случаев специалисты ВРТ используют эмпирические подходы, предлагая модификации эмбриологического этапа лечения бесплодия. Одним из методов может служить аутологичное сокультивирование эмбрионов с клетками кумулюса, но, как показали результаты настоящего исследования, данная технология эффективна только у молодых женщин моложе 35 лет. Только у молодых пациенток аутологичное сокультивирование в 1,83 раза увеличивает частоту наступления беременности при ПНИ и может быть им рекомендовано.



