Термин «аденомиоз» в настоящее время используется для обозначения заболевания, морфологическим проявлением которого является инвазия (внедрение) железистого и стромального компонентов базального слоя эндометрия в подлежащий миометрий [1]. В Международной классификации болезней 10-го пересмотра (МКБ-10) в разделе «эндометриоз» (код N.80) отдельным пунктом представлен «эндометриоз матки» (код N.80.0), который можно рассматривать как полный аналог понятия «аденомиоз». В некоторых отечественных классификациях эндометриоза для обозначения его локализации в теле матки используют также словосочетание «внутренний эндометриоз» [2]. Включение аденомиоза, как и других (по локализации гетеротопий) форм эндометриоза в одну нозологическую группу МКБ-10, подчеркивает общность их гистологических особенностей – наличие эндометриоидоподобных желез и цитогенной основы в патологических очагах. Аденомиоз в настоящее время многие исследователи рассматривают как самостоятельное заболевание, отделяя его от других форм эндометриоза [3].
Аденомиоз является не только одной из основных причин альгодисменореи, но и часто ассоциируется с необъяснимым бесплодием и привычным невынашиванием [4]. Уменьшение вероятности успешного зачатия при аденомиозе объясняется отставанием созревания эндометрия в фолликулярной фазе и снижением его рецептивности, что, по мнению многих исследователей [5, 6], связано с дефектами эндометриальных рецепторов к эстрогенам. Привычное невынашивание при аденомиозе объясняют повышением ригидности стенок матки и сосудистыми нарушениями, препятствующими обеспечению адекватной трофики эндометрия в гестационном периоде и провоцирующими развитие плацентарной недостаточности [7].
Нельзя не отметить тот факт, что до настоящего времени диагностические критерии аденомиоза как таковогои стадий патологического процесса не вполне определены, а некоторые специалисты считают, что точная диагностика процесса возможна лишь при гистологическом исследовании удаленной матки [8, 9]. Вместе с тем, по мнению других авторов [10–13], специализирующихся в области ультразвуковой диагностики, использование современных ультразвуковых приборов экспертного класса позволяет вполне успешно выделять среди всей популяции женщин с аденомиозом пациенток с различными стадиями распространения (в том числе и с I) этого заболевания.
Попытки преодоления бесплодия при аденомиозе путем использования антиэстрогенной терапии с последующим естественным зачатием, в сочетании со стимуляцией яичников или без таковой, часто не приводят к желаемому результату [14–16]. По этой причине инфертильные пациентки с аденомиозом нуждаются в лечении бесплодия с применением ЭКО. Однако приходится признать, что встречающиеся в литературе сообщения о степени негативного влияния аденомиоза на эффективность ЭКО оказываются достаточно противоречивыми и не учитывают зависимость результатов лечения от выраженности заболевания [17–20]. Не определены методы подготовки пациенток с различными формами аденомиоза к программам ЭКО, нет четких рекомендаций, определяющих характер подготовки, ее длительность, не оценена эффективность медикаментозного лечения [21, 22].
Таким образом, анализ данных литературы свидетельствует о том, что, несмотря на наличие множества теорий возникновения и развития аденомиоза, не до конца выяснены вопросы патогенеза заболевания и его влияния на репродуктивную функцию. Не решен вопрос и о роли различных методов лечения и реабилитации в восстановлении генеративной функции и эффективности программ ЭКО.
Целью настоящего исследования явилась оценка эффективности программ ЭКО у пациенток с различными стадиями аденомиоза.
Материалы и методы
128 женщинам, обратившимся для проведения программы ЭКО, был установлен диагноз «аденомиоз», являющийся возможной причиной нарушения имплантации в предыдущих попытках ЭКО. Возраст женщин колебался от 22 до 38 лет, медиана составила 34,5 (28; 35) года. Все пациентки имели попытки ЭКО в анамнезе – от одной до трех; при этом беременность не наступила у 94% женщин, у 6% она оказалась не развивающейся на малых сроках.
Обоснованием указанного предположения явились следующие факты: получение у всех пациенток от 5 до 18 ооцитов и от 2 до 13 эмбрионов хорошего и отличного качества на стадии бластоцисты; отсутствие аутоиммунных, инфекционных и эндокринных заболеваний у супругов, способных отрицательно сказаться на результатах лечения; результаты ультразвукового исследования (УЗИ), выполненного дважды, указывающие на признаки аденомиоза: толщина матки от 4,7 до 7,2 см; различия в толщине стенок матки – от 0,3 до 2,2 см; повышенная гиперэхогенность миометрия различной толщины; наличие анэхогенных включений в миометрии.
Указанные признаки разной стадии выраженности присутствовали у всех пациенток.
Критерии включения в исследование: репродуктивный возраст (22–38 лет); сохраненные параметры овариального резерва; признаки аденомиоза по результатам УЗИ; неэффективность попыток ЭКО в анамнезе; возможность проведения оплодотворения методом ЭКО или ИКСИ по результатам исследования спермограмм супругов.
Критерии исключения: регламентируемые приказом №107н Минздрава России от 2012 г.; поздний репродуктивный возраст и резко сниженные показатели овариального резерва; тяжелые формы патозооспермии у супруга.
По способу проведения стимуляции яичников в программе ЭКО пациентки были произвольно разделены на две группы: 1-я группа – 68 женщин, которым проведена стимуляция яичников в протоколе с антагонистом гонадотропин-рилизинг-гормона (антГнРГ); 2-я группа – 60 пациенток, получивших лечение в программе ЭКО с использованием «длинного» протокола с агонистом ГнРГ(аГнРГ).
В каждой из групп примерно в одинаковом количестве были женщины с различной стадией аденомиоза: I стадия (легкая форма) – 44 и 42 пациентки (64,7% и 70% соответственно); II стадия (среднетяжелая форма диффузного эндометриоза) – 20 и 16 пациенток (29,4% и 26,6% соответственно); III стадия – тяжелая стадия диффузно-узлового аденомиоза – 4 и 2 пациентки (5,9% и 3,4% соответственно).
Для диагностики стадии аденомиоза использовали ультразвуковые признаки, представленные в работе В.Н. Демидова, А.И. Гуса, Л.В. Адамян, А.К. Хачатрян (1997), и классификацию аденомиоза тех же авторов [23].
Стадия I диффузного аденомиза:
- наличие в толще эндометрия тонких поперечных анэхогенных полосок, идущих от базального слоя к середине М-эхо, а также анэхогенных включений (кист) в миометрии и на границе эндометрия и миометрия;
- повышенная гиперэхогенность миометрия различной толщины; наличие анэхогенных включений в миометрии;
- неравномерность толщины базального слоя эндометрия и «изъеденность» контуров эндометрия по базальной пластинке, что выглядит как гипоэхогенный дефект эндометрия; миометрий за базальной пластинкой не изменен;
- матка обычно имеет нормальные размеры, но может обнаруживаться разная толщина передней и задней стенок матки;
- появление зон пониженной эхогенности в эндометрии и небольших гиперэхогенных образований в толще миометрия рядом с эндометрием.
Стадия II диффузного аденомиоза:
- увеличение толщины матки, превышающее верхнюю границу нормы;
- утолщение одной из стенок матки по сравнению с другой на 4 мм и более;
- появление в миометрии, расположенном ближе к полости матки, зон с участками неоднородной (повышенной и пониженной) эхогенности различной величины;
- наличие внутри зоны повышенной эхогенности небольшого округлого анэхогенного образования диаметром 2–5 мм;
- появление анэхогенных полостей различной формы и размера, содержащих мелкодисперсную взвесь (кровь), а иногда и плотные включения небольшой эхогенности (сгустки крови);
- толщина эндометрия обычно снижена и не соответствует дню менструального цикла (за счет сдавления эндометрия измененным миометрием);
- появление в месте расположения патологического образования частой поперечной исчерченности со средней и низкой эхогенностью;
- эффект ослабления ультразвуковой волны за патологическим образованием.
Стадия III диффузного аденомиоза:
- значительное увеличение матки, в основном переднезаднего размера;
- утолщение одной из стенок матки по сравнению с другой на 10 мм и более;
- наличие в миометрии зоны повышенной неоднородной эхогенности, занимающей более половины толщины стенки матки;
- выявление в области переднего фронта сканирования зоны повышенной эхогенности и анэхогенной – в области дальнего фронта.
Оценивали состояние овариального резерва пациенток, исследуя уровни фолликулостимулирующего (ФСГ) и антимюллерова (АМГ) гормонов в плазме крови и проводя УЗИ с подсчетом количества антральных фолликулов в каждом яичнике. Перед вступлением в программу ЭКО все пациенты обследованы согласно приказу Минздрава России №107н от 2012 г. В исследовании использовали клинические, лабораторные и инструментальные методы обследования. Программы ЭКО в «длинном» протоколе с аГнРГ и в протоколе с антГнРГ проводили по общим правилам, определяя дозу гонадотропинов в зависимости от показателей овариального резерва. В качестве триггера финального созревания ооцитов использовали хорионический гонадотропин человека в дозе 10 000 ЕД. Оценивали количество зрелых ооцитов, оплодотворение, количество полученных бластоцист.
Статистический анализ
Для автоматизации статистической обработки использовали статистический пакет Statistica 10 (StatSoft Inc., США). Для описания количественных переменных использовали медиану и квартильный размах Me (Q1;Q3) (т.к. провести проверку на нормальность не представлялось возможным из-за малого объема выборок), качественных – абсолютные значения и проценты. В работе были применены следующие методы обработки данных: критерий χ2 для таблиц сопряженности признаков 2×2 и 2×4 (для сравнения частот встречаемости признаков в анализируемых группах). Сравнительный анализ переменных проводили с помощью непараметрического критерия по Краскелу–Уоллису и критерия Манна–Уитни для несвязанных совокупностей. Статистически значимыми считали различия при р<0,05.
Результаты и обсуждение
Первой задачей, поставленной в настоящем исследовании, явилось оценить состояние овариального резерва у пациенток выделенных групп. Эти данные представлены в таблицах 1 и 2.
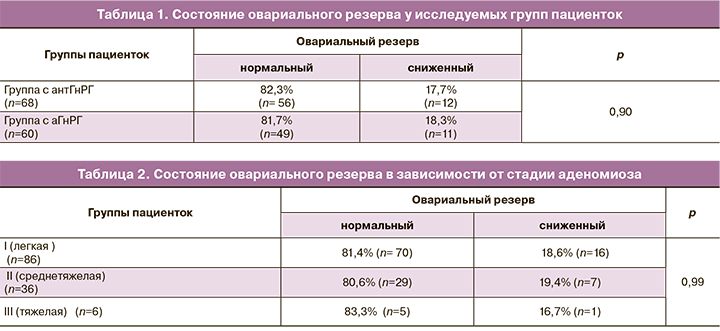
Представленные данные (табл. 1) демонстрируют отсутствие различий в состоянии овариального резерва у исследуемых групп пациенток. Большинство из них имели параметры овариального резерва, соответствующие нормативным показателям возраста пациенток, – 31 (26; 35) год. Женщины, имеющие сниженные показатели овариального резерва, были старше – 37 (37; 38) лет, что является вполне объяснимой и закономерной ситуацией. Вместе с тем ряд исследователей отмечают негативное влияние эндометриоза, не только эндометриоидных кист, занимающих определенный объем яичников, но и малых форм наружного генитального эндометриоза, на овариальный резерв, способствуя его снижению [24–27].
Для оценки влияния выраженности патологического процесса на функцию яичников мы провели анализ параметров овариального резерва при различной стадии заболевания. Эти данные представлены в таблице 2.
Полученные данные подтвердили отсутствие влияния стадии аденомиоза на состояние овариального резерва и позволили прийти к выводу, что при аденомиозе, в отличие от других форм эндометриоза, функция яичников не страдает. Возможно, этот факт можно расценивать как аргумент в пользу другого патогенеза формирования аденомиоза, отличного от такового при наружном генитальном эндометриозе. Более того, можно предположить, что при выраженных формах аденомиоза, в отсутствие других факторов бесплодия, бесплодие и неудачи программ ЭКО могут быть связаны с отсутствием имплантации, что, в свою очередь, позволяет классифицировать тяжелые стадии аденомиоза как маточные формы бесплодия.
В клинической практике существует мнение о приоритете применения «длинного» протокола с аГнРГ при проведении стимуляции яичников в программах ЭКО. Мы попытались проверить эту точку зрения, сравнив протоколы с аГнРГ и антГнРГ. Следует напомнить, что по состоянию овариального резерва пациентки исследуемых групп не отличались. В таблице 3 представлены характеристики протоколов стимуляции.
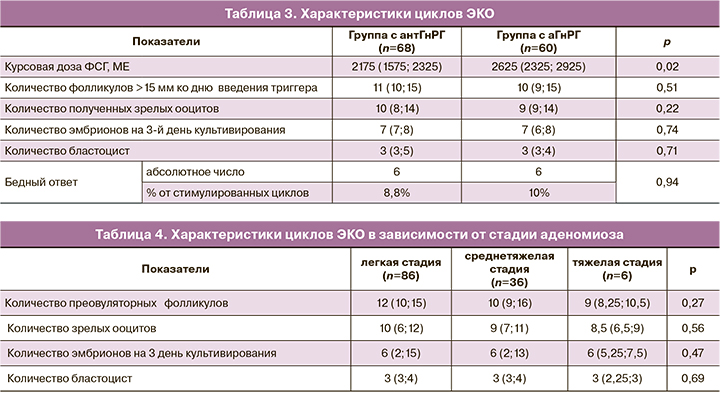
Как видно из представленных данных, различались дозы ФСГ на курс лечения, все остальные показатели не различались. Однако большая доза расходуемых гонадотропинов является типичной при использовании «длинного» протокола с аГнРГ. Следовательно, результаты проведенного исследования опровергают мнение о необходимости использовать «длинный» протокол при наличии эндометриоза. И в этом случае протокол стимуляции следует выбирать исходя из индивидуальных характеристик пациентки и решения врача.
Интересным представлялся анализ показателей стимуляции яичников в зависимости от стадии аденомиоза. Эти данные представлены в таблице 4.
Полученные данные не выявили различий в параметрах индуцированного цикла у пациенток с разными стадиями аденомиоза, что еще раз подчеркивает отсутствие влияния аденомиоза на функциональную активность яичников.
Частота наступления беременности и репродуктивных потерь в группах не зависела от протокола стимуляции яичников, составив 33,5% при использовании протокола с антГнРГ и 34,2% – при стимуляции в протоколе с аГнРГ. Частота биохимических и неразвивающихся на ранних сроках (до 7 недель) беременностей в 1-й группе составила 13,6%, во 2-й – 12,9%, что не различалось между группами и соответствовало среднестатистическим данным, представленном в регистре РАРЧ за 2018 г. [28].
Вместе с тем анализ данных по частоте прогрессирующих беременностей различался в зависимости от стадии эндометриоидного процесса. Так, при I стадии (легкая форма) беременность наступила у 35 из 86 женщин, что составило 40,7%, не развивались всего две. При среднетяжелой стадии беременность наступила у 11 пациенток, что составило 30,6%, при этом доля неразвивающихся беременностей возросла до 14,5% забеременевших женщин. При тяжелой форме аденомиоза беременность не наступила ни в одном случае.
Представленные данные отчетливо демонстрируют роль стадии аденомиоза в частоте имплантации и прогрессирующей беременности. При одинаковом числе полученных эмбрионов резко различалась частота имплантации и репродуктивных потерь. Общая, достаточно высокая частота наступивших и прогрессирующих беременностей в исследуемых группах объясняется тем, что основную часть пациенток составили женщины с I, легкой стадией аденомиоза, которая не влияет на частоту наступления и вынашивания беременности.
Заключение
Совокупность полученных данных позволяет сделать следующие выводы.
1. Аденомиоз и стадия его выраженности не влияют на функциональную активность яичников и показатели овариального резерва, что позволяет предположить разный генез формирования патологического процесса при различной локализации эндометриоза
2. Протоколы стимуляции яичников в программах ЭКО – «длинный» с аГнРГ и протокол с антГнРГ – одинаковы по своей эффективности, числу полученных зрелых ооцитов и бластоцист хорошего качества.
3. Стадия аденомиоза не влияет на параметры фолликулогенеза и эмбриогенеза, которые определяются состоянием овариального резерва и возрастом женщины.
4. Частота наступления беременности и репродуктивные потери определяются стадией аденомиоза, что позволяет расценивать среднетяжелые и тяжелые формы заболевания как маточный фактор бесплодия; тогда как аденомиоз первой стадии не влияет на результативность программ ЭКО.



