Преэклампсия – это осложнение беременности, в понимании патофизиологии которого многое изучено, однако до сих пор нет единого мнения относительно его истинной этиологии. Международный консенсус экспертов поддерживает гипотезу о том, что преэклампсия является первичным плацентарным нарушением. Однако выявлены доказательства того, что соматические заболевания матери (в первую очередь сердечно-сосудистые), приводящие к гипоперфузии матки и плаценты, с большой вероятностью являются причиной вторичной плацентарной дисфункции при преэклампсии [1].
Перинатальная терапия этого осложнения беременности (сульфат магния, индивидуально ориентированная антигипертензивная терапия, инфузионная и т.д.) разрабатывалась в основном на основании эмпирических наблюдений и клинико-физиологических аналогий в лечении похожих симптомов в других областях клинической медицины. И в настоящее время отсутствуют веские основания рассчитывать на серьезный прорыв в лечении преэклампсии, поскольку отсутствуют четкие представления о ее истинной природе.
На иммунологических аспектах развития и прогрессирования преэклампсии вот уже в течение многих лет акцентировано внимание ученых. Поскольку плод и плацента с иммунологических позиций являются полуаллогенными по отношению к матери, то развитие иммунопатологических реакций вполне ожидаемо. Формирование механизмов иммунной толерантности во время беременности имеет решающее значение для предотвращения отторжения плода и плаценты, которое может проявляться в виде потери беременности на ранних сроках, преждевременных родов, задержки роста плода или преэклампсии [2].
Иммунологическая концепция преэклампсии предполагает развитие чрезмерной системной провоспалительной реакции в организме женщины в ответ на полуаллогенную/аллогенную беременность [3, 4], ключевым звеном которой является генерализованное повреждение эндотелия сосудов, что и определяет мультисистемный характер поражения органов и систем. Роль провоцирующего фактора и источника провоспалительных индукторов принадлежит плоду и плаценте.
Известно, что успешность процессов инвазии трофобласта, ремоделирования спиральных и радиальных артерий матки с формированием высокоэффективного кровоснабжения плаценты во время нормальной беременности во многом зависит от материнской иммунной системы. Правильная реакция макрофагов, естественных киллеров (NK), дендритных клеток (DC), Т-лимфоцитов, в том числе Т-регуляторных клеток (Treg) в децидуальной оболочке необходима для нормальной инвазии клеток цитотрофобласта. Важную роль в этих процессах играет и система комплемента [5, 6], которая является частью врожденной иммунной системы, состоит более чем из 50 белков, циркулирующих в плазме крови и связанных с мембранами клеток. Активация комплемента возможна классическим, альтернативным или лектиновым путем, что запускает протеолитический каскад с образованием ключевого звена – конвертазы С3 и конечного компонента – мембран-атакующего комплекса (МАК). Итогом воздействия МАК являются прямое повреждение не только патогенов, но и собственных клеток, активация опсонизации и фагоцитоза, активация клеток иммунной системы и нередко выраженная воспалительная реакция [7].
В настоящее время установлено, что, помимо лизиса поврежденных клеток и патогенов, комплемент также играет важную роль в развитии анафилактических реакций, воспалительных процессов, тканевого повреждения и свертывания крови.
Показано, что при физиологическом течении беременности имеет место умеренная активация системы комплемента, что, по-видимому, направлено на защиту фетоплацентарной системы от патогенов и поддержку процесса плацентации [8]. Чрезмерная активация комплемента либо дисбаланс между ее активацией и регуляцией могут быть связаны с неблагоприятными исходами беременности, в том числе с развитием преэклампсии.
Однако результаты опубликованных исследований довольно вариабельны и порой прямо противоположны. Так, Jia et al. (2019) при тяжелой преэклампсии отметили увеличение сывороточных концентраций фактора Bb на фоне значительного снижения факторов C1q, H, C3 и C4 по сравнению со здоровыми беременными [9]. Другими авторами как при ранней, так и при поздней преэклампсии выявлено значимое повышение факторов Bb, C3a, C5a и MAК [10].
Для практического акушерства важна возможность клинической оценки нарушений; следовательно, необходимо исследование нормального диапазона компонентов комплемента во время физиологической беременности и их пороговых патологических значений при тех или иных осложнениях.
В этой связи более глубокое изучение особенностей функционирования системы комплемента при физиологической беременности и преэклампсии является, несомненно, перспективным, поскольку коррекция выявленных нарушений может быть потенциальной терапевтической мишенью и возможностью пролонгировать беременность.
Цель исследования: оценка клинической значимости сравнительного исследования факторов системы комплемента при преэклампсии и у здоровых беременных в диагностике и определение истинной степени тяжести преэклампсии.
Материалы и методы
В данной статье представлены предварительные результаты оценки состояния системы комплемента у беременных с преэклампсией, однако исследование будет продолжено.
Исследование одобрено локальным Этическим комитетом ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ (Сеченовский университет) (выписка из протокола заседания ЛЭК № 28-20 от 07.10.2020). Все пациентки подписали информированное согласие на участие в исследовании.
Проведено исследование, в которое были включены 47 пациенток. В основную группу (n=25) вошли все женщины с установленным диагнозом «преэклампсия», которые были родоразрешены в родильном доме ГБУЗ г. Москвы «ГКБ им. В.В. Вересаева Департамента здравоохранения г. Москвы» в период с мая 2020 по сентябрь 2021 г. Пациентки с умеренной преэклампсией составили I подгруппу (n=13), с тяжелой – II подгруппу (n=12). В группу сравнения первоначально вошли 25 относительно здоровых беременных без признаков преэклампсии, родоразрешенных в том же родильном доме в те же сроки, однако 3 пациентки были исключены из исследования в связи с диагностированными у них в последующем инфекциями дыхательных и мочевыводящих путей (n=22). Все пациентки наблюдались с момента госпитализации в родильный дом до момента выписки – в среднем 7,4 (5;9) дня.
Критерии включения пациенток в основную группу: наличие письменного информированного согласия пациента на участие в исследовании; репродуктивный возраст женщины; наличие беременности; наличие признаков преэклампсии различной степени тяжести.
Критерии включения пациенток в группу сравнения: наличие письменного информированного согласия пациента на участие в исследовании; репродуктивный возраст женщины; отсутствие экстрагенитальных и гинекологических заболеваний; неосложненный репродуктивный анамнез; неосложненное течение беременности, родов и послеродового периода.
Критерии невключения пациенток в основную группу и группу сравнения: выявление инфекций и воспалительных процессов любой локализации.
Критерии исключения пациентов из исследования: отказ пациента от дальнейшего участия в исследовании; завершение беременности на сроке до 22 недель; выявление пороков развития, хромосомных и генетических аномалий плода, инфекций любой локализации.
Диагноз «преэклампсия» был поставлен согласно критериям, представленным в клинических рекомендациях «Преэклампсия. Эклампсия. Отеки, протеинурия и гипертензивные расстройства во время беременности, в родах и послеродовом периоде» (2021). Обследование, терапевтические мероприятия и родоразрешение пациенток проводились в рамках указанных клинических рекомендаций. Дополнительно у всех пациенток определяли сывороточные концентрации 7 факторов комплемента (С1q, C3, С5а, фактор B – FB, фактор H – FH, фактор I – FI, фактор D – FD); забор крови проводился при госпитализации до начала терапевтических мероприятий. Забор пуповинной крови в объеме 1–2 мл осуществляли сразу после родоразрешения из остатка пуповины. Выбор анализируемых факторов комплемента определялся необходимостью исследования всех путей его возможной активации.
Образцы крови отстаивались до образования плотного сгустка, затем центрифугировались при 1000 g в течение 12–15 минут. Полученная надосадочная жидкость собиралась в пробирки типа Appеndorf, транспортировалась в лабораторию, где образцы подвергались заморозке и хранились при -80°С до проведения исследования.
Применялся мультиплексный анализ белков комплемента (методика Multiplex), при котором образцы плазмы одновременно анализировались на 7 вышеуказанных комплементарных факторов с использованием панелей Human Complement Merck (Millipore; Германия) в соответствии с протоколом производителя. Концентрации белков комплемента рассчитывали, исходя из калибровочных кривых стандарта для каждого белка.
Исследование проведено в ГНЦ ФГБУН «Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН», в лаборатории молекулярной биомедицины (зав. лабораторией – зам. директора по науке, д.х.н. А.А. Белогуров).
Статистический анализ
Для статистической обработки полученных результатов исследования использовали статистический пакет IBM SPSS Statistics v22 (IBM Corp., США). Все полученные количественные параметры были проверены на соответствие нормальному распределению с помощью критерия Шапиро–Уилка. Все параметры имели распределение, отличное от нормального, поэтому представлены в формате Мe (Q25%;Q75%), где Мe – медиана, а Q25% и Q75% – верхний и нижний квартили.
Для сравнения количественных данных применяли непараметрические методы Краскела–Уоллиса (для нескольких групп) и затем осуществляли попарное сравнение групп с помощью U-критерия Манна–Уитни для несвязанных совокупностей.
При множественных сравнениях применяли поправку Бонферрони: при сравнении 3 исследуемых групп с учетом данной поправки критическая величина уровня значимости р<0,017.
При сравнении категориальных показателей между группами применяли двусторонний критерий Фишера. При невозможности использования критерия Фишера (одна из долей при сопоставлении двух выборок равна 0% или 100%) использовали Z-критерий для долей с поправкой для концевых точек.
Корреляционный анализ проводился на основе непараметрической ранговой корреляции по Спирмену. Уровень статистической значимости был зафиксирован на уровне вероятности ошибки 0,05.
Результаты
Клиническая характеристика пациенток
Все обследуемые женщины были сопоставимы по социально-экономическим факторам, наличию вредных привычек и профессиональных вредностей. Возраст беременных варьировал от 18 до 41 года и составил в основной группе 30 (27;36) лет, в группе сравнения – 32 (30;35) года (р=0,17). Первобеременными были 5/22 (22,7%) пациенток группы сравнения, 14/25 (56%) – основной группы (p=0,01), первородящими – 8/22 (36,4%) и 16/25 (64%) соответственно (p=0,05).
Cтруктура экстрагенитальных и гинекологических заболеваний, а также репродуктивный анамнез пациенток представлены в таблице 1.

Как показано в таблице 1, пациентки основной группы значимо чаще имели отягощенный коморбидный фон: заболевания сердечно-сосудистой системы (в основном хроническая артериальная гипертензия), почек и мочевыводящих путей, желудочно-кишечного тракта (хронический холецистит, желчнокаменная болезнь, хронический панкреатит), нейрообменно-эндокринные нарушения (ожирение, сахарный диабет, заболевания щитовидной железы), генетические формы тромбофилии, а также бесплодие и СПКЯ.
Неосложненный репродуктивный анамнез отмечен только у 9/25 (36%) женщин основной группы, что значимо отличается от группы сравнения – у 16/22 (72,7%; p=0,009). У 12/25 (48%) пациенток основной группы во время предыдущей беременности имели место плацентарные синдромы: преэклампсия (16%), синдром задержки роста плода (12%), невынашивание беременности (20%), преждевременные роды (16%).
Особенности течения беременности и родоразрешения пациенток анализируемых групп представлены в таблице 2.

Согласно результатам 1-го пренатального скрининга, высокий риск развития преэклампсии и задержки роста плода выявлен у 10/25 (40%) женщин основной группы, что значимо отличалось от группы сравнения – у 1/22 (4,5%; p=0,002).
Все женщины группы сравнения родоразрешены в доношенном сроке беременности, 7/22 (31,8%) из них путем операции кесарева сечения (в связи с наличием рубца на матке, неправильным положением плода, появлением признаков клинически узкого таза). Преждевременное родоразрешение имело место у 12/25 (48%) женщин основной группы в связи с нарастанием тяжести преэклампсии и/или ухудшением состояния плода. Оперативным путем (кесарево сечение) родоразрешены 20/25 (80%) пациенток (в связи с прогрессированием преэклампсии, острой гипоксией плода, необходимостью быстрого родоразрешения при отсутствии готовности родовых путей, рубцом на матке).
Умеренная преэклампсия диагностирована у 13/25 пациенток, тяжелая – у 12. Чаще всего в качестве первого симптома регистрировалась артериальная гипертензия – у 19/25 (76%), реже отечный синдром – у 6/25 (24%).
В подгруппе с умеренной преэклампсией ее начало отмечено в среднем в 34 (30;35) недели, с тяжелой – в 31 (27;36) неделю (p=0,28). Длительность течения данного осложнения беременности при умеренной преэклампсии составила в среднем 2 (2;4) недели, при тяжелой – 6,5 (5,5;8,5) недели (p=0,023).
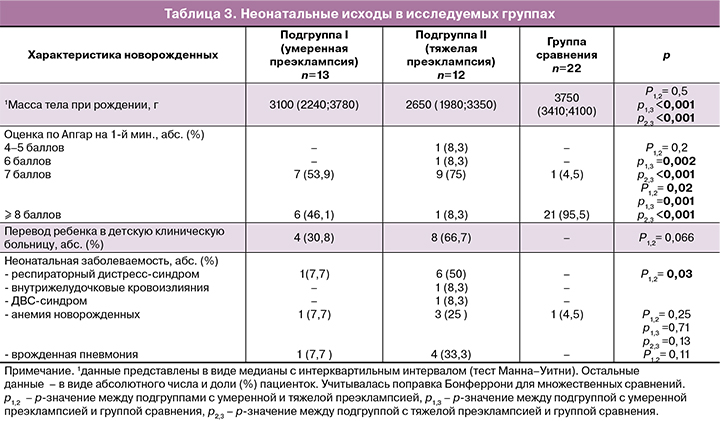
Неонатальные исходы при преэклампсии, особенно ее тяжелом течении, были ожидаемо хуже, чем в группе сравнения (табл. 3): новорожденные имели значимо более низкую массу тела при рождении, более половины родились в состоянии умеренной асфиксии. 4/13 (30,8%) и 8/12 (66,7%) детей, соответственно от матерей с умеренной и тяжелой преэклампсией, переведены для дальнейшего лечения и наблюдения в детские клинические больницы. Состояние новорожденных в подгруппах с преэклампсией определялось развитием респираторного дистресс-синдрома, пневмонии, внутрижелудочковых кровоизлияний, ДВС-синдрома, анемии. Все новорожденные группы сравнения выписаны домой на 4–5-е сутки в удовлетворительном состоянии.
Исследование факторов системы комплемента
Определение концентрации 7 факторов комплемента в сыворотке крови беременных и в пуповинной крови новорожденных показало довольно большой разброс показателей в пределах каждой группы, что свидетельствует о широком диапазоне индивидуальных различий (табл. 4).
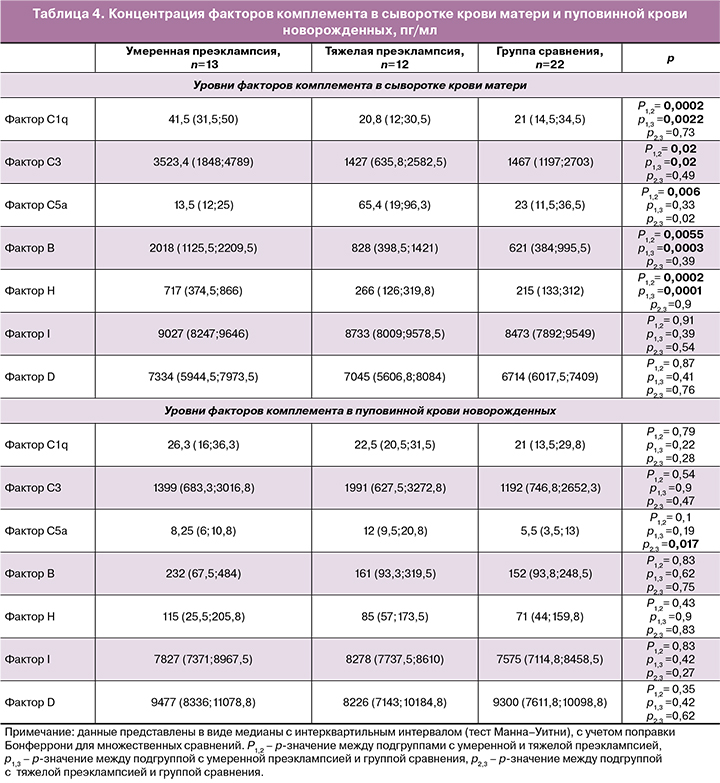
При развитии умеренной преэклампсии выявлена явная проактивация системы комплемента, которая сопровождалась значимым повышением уровней большинства факторов относительно группы сравнения: С1q до 41,5 (31,5; 50) по сравнению с 21 (14,5;34,5) пг/мл (p=0,0022), C3 до 3523,4 (1848;4789) по сравнению с 1467 (1197;2703) пг/мл (p=0,017), FB до 2018 (1125,5; 2209,5) в сравнении с 621 (384; 995,5) пг/мл (p=0,0003), FH до 717 (374,5; 866) в сравнении с 215 (133;312) пг/мл (p=0,0001). Определялось также увеличение концентраций FI и FD, однако эти изменения были менее выражены (p>0,017). Концентрация фактора С5а у пациенток с умеренной преэклампсией значимо не отличалась от группы сравнения.
При тяжелой преэклампсии, учитывая нарастание тяжести патофизиологических изменений, свойственных данному осложнению беременности, мы ожидали получить доказательства еще более выраженной активации системы комплемента. Однако нами выявлено кардинально противоположное изменение уровней его белков: в сравнении с умеренной преэклампсией отмечено значимое снижение С1q до 20,8 (12;30,5) пг/мл (p=0,0002), С3 до 1427 (635,8;2582,5) пг/мл (p=0,02), FB до 828 (398,5;1421) пг/мл (p=0,0055) и FH до 266 (126;319,8) пг/мл (p=0,0002). Также имело место снижение FI и FD, однако статистически не значимое (p>0,017).
Несколько иная закономерность выявлена в отношении динамики С5а. Если при умеренной преэклампсии нами не получено значимых изменений данного фактора: его концентрация составила в среднем 13,5 (12;25) пг/мл, по сравнению с 23 (11,5;36,5) пг/мл в группе сравнения (p=0,33), то при тяжелой преэклампсии определялись довольно высокие его уровни – в среднем 65,4 (19;96,3) пг/мл, что почти в 5 раз превышало те же показатели при умеренной преэклампсии (p=0,006).
Изменение уровней факторов комплемента в пуповинной крови новорожденных было не столь выражено, как у женщин, но имело много общего с ними. В подгруппе детей от матерей с умеренной преэклампсией в той или иной степени определялось повышение всех изучаемых комплементарных белков относительно группы сравнения: С1q в среднем до 26,3 (16;36,3) в сравнении с 21 (13,5;29,8) пг/мл (p=0,22), C3 до 1399 (683,3; 3016,8) в сравнении с 1192 (746,8; 2652,3) пг/мл (p=0,9), С5а до 8,25 (6; 10,8) в сравнении с 5,5 (3,5; 13) пг/мл (p=0,19), FB до 232 (67,5;484) в сравнении с 152 (93,8;248,5) пг/мл (p=0,62), FH до 115 (25,5;205,8) в сравнении с 71 (44;159,8) пг/мл (p=0,9), FI до 7827 (7371;8967,5) в сравнении с 7575 (7114,8;8458,5) пг/мл (p=0,42), FD до 9477 (8336;11078,8) в сравнении с 9300 (7611,8; 10098,8) пг/мл (p=0,42); однако все эти изменения были статистически не значимы.
В подгруппе с тяжелой преэклампсией изменения С1q, FB, FH и FD у детей носили однонаправленный характер с материнскими – имело место их снижение по сравнению с подгруппой с умеренной преэклампсией (табл. 4), однако не достигающее тех же показателей в группе сравнения. При этом уровни C3, С5а и FI в пуповинной крови, в отличие от материнских, имели тенденцию к повышению. Статистически значимыми были изменения активированного фактора С5а у новорожденных в подгруппе с тяжелой преэклампсией – его концентрация в пуповинной крови возрастает в среднем до 12 (9,5;20,8) в сравнении с 5,5 (3,5;13) пг/мл (p=0,017) в группе сравнения.
В целом уровни факторов комплемента в пуповинной крови новорожденных были ниже материнских, за исключением FD.
С целью изучения взаимосвязи между уровнями факторов комплемента у матери и новорожденного, а также связи их с клиническими данными проведен корреляционный анализ на основе непараметрической ранговой корреляции по Спирмену.
Наиболее значимые положительные корреляционные связи были установлены между материнскими уровнями С3 и С1q (r=0,694; p=0,0001; 95% ДИ 0,438–1,274), С3 и FB (r=0,83; p<0,001; 95% ДИ 0,78–1,616), С3 и FH (r=0,672; p<0,001; 95% ДИ 0,397–1,233), а также между уровнями FB и FH (r=0,84; p<0,001; 95% ДИ 0,806–1,642), FD и FI (r=0,59; p=0,002; 95% ДИ 0,252–1,087). Сходные параллели между исследуемыми факторами отмечены и в пуповинной крови новорожденных: между С3 и С1q (r=0,662; p=0,005; 95% ДИ 0,41–1,302), С3 и FB (r=0,70; p=0,0025; 95% ДИ 0,39–1,216), С3 и FH (r=0,768; p=0,0005; 95% ДИ 0,44–1,509), а также между FB и FH (r=0,94; p<0,001; 95% ДИ 0,762–1,703), FD и FI (r=0,55; p=0,026; 95% ДИ 0,303–1,112).
В отношении активированного фактора С5а выявлена положительная связь между его концентрацией у матери и С1q новорожденного (r=0,454; p=0,05; 95% ДИ -0,054–1,033), и наоборот, между С5а новорожденного и материнскими уровнями С1q (r=-0,47; p=0,05; 95% ДИ -1,058–0,030), FH (r=-0,63; p=0,009; 95% ДИ -1,281–-0,194), FD (r=-0,43; p=0,05; 95% ДИ -1,002–0,085) и FI (r=-0,46; p=0,05; 95% ДИ -1,040–0,047).
Анализ взаимосвязи уровней факторов комплемента в сыворотке крови беременных с клиническими данными показал значимую отрицательную корреляцию между степенью тяжести преэклампсии и С1q (r=-0,7; p=0,0001; 95% ДИ -1,285–-0,450), C3 (r=-0,43; p=0,03; 95% ДИ -0,881–-0,046), FB (r=-0,57; p=0,003; 95% ДИ -1,060–-0,224), FH (r= -0,76; p<0,001; 95% ДИ -1,402–-0,567) и положительную корреляцию с C5a (r=0,561; p=0,003; 95% ДИ 0,217–1,053). Длительность течения преэклампсии от момента клинической манифестации до родоразрешения также отрицательно коррелировала с материнскими уровнями С1q (r=-0,562; p=0,003; 95% ДИ -1,053–-0,217), FB (r=-0,509; p=0,009; 95% ДИ -0,979–-0,143), FH (r=-0,53; p=0,006; 95% ДИ -1,009–-0,173) и положительно – с C5a новорожденного (r=0,45; p=0,05; 95% ДИ 0,201–1,069).
Выраженность артериальной гипертензии у беременных с преэклампсией имела значимую связь только с показателями С5а (r=0,47; p=0,017; 95% ДИ 0,094– 0,929), FB (r=-0,4; p=0,05; 95% ДИ -0,729–0,107) и FH (r=-0,51; p=0,009; 95% ДИ -0,814–0,022). Выявлена также взаимосвязь между величиной протеинурии и уровнями C1q (r=-0,55; p=0,054; 95% ДИ -1,272–0,035), FH (r=-0,611; p=0,035; 95% ДИ -1,363–-0,056) у матери и С5а у новорожденного (r=0,5; p=0,05; 95% ДИ 0,234–1,152).
Анализ взаимосвязи выраженности изменений лабораторных показателей у беременных основной группы с факторами комплемента показал значимую корреляцию между величиной гематокрита и материнским С5а (r=0,563; p=0,023; 95% ДИ 0,093–1,181), креатинином матери и C1q новорожденного (r=0,518; p=0,04; 95% ДИ 0,087–1,279), между лактатдегидрогеназой матери и ее С5а (r=0,745; p=0,0022; 95% ДИ -1,553–-0,371), между лактатдегидрогеназой матери и пуповинными уровнями С1q (r=-0,895; p=0,0011; 95% ДИ -1,402–-0,476), C3 (r=-0,883; p=0,0016; 95% ДИ -1,322–-0,601), FB (r=-0,717; p=0,03; 95% ДИ -1,228–-0,336), FH (r=-0,783; p=0,0125; 95% ДИ -1,32–-0,448).
Интересно, что нами не получено значимой корреляции между уровнями факторов комплемента в пуповинной крови и состоянием новорожденного (тяжестью асфиксии), весом ребенка при рождении, частотой перевода в детские клинические больницы для дальнейшего лечения и выхаживания. Данный факт, впрочем, объясним, учитывая не столь выраженные изменения концентраций комплементарных белков у новорожденных по сравнению в материнскими. В то же время имела место значимая взаимосвязь между уровнями материнских факторов С3 (r=0,44; p=0,023; 95% ДИ 0,055–0,890), FB (r=0,43; p=0,03; 95% ДИ 0,041–0,877) и FH (r=0,404; p=0,045; 95% ДИ 0,010–0,846) и низкой оценкой по Апгар (менее 5 баллов). А сроки манифестации преэклампсии у матери положительно коррелировали с уровнями С3 и С5а у новорожденных (r=0,522; p=0,038; 95% ДИ 0,09–1,179 и r=0,44; p=0,058; 95% ДИ 0,071–1,09 соответственно).
Обобщая результаты проведенного нами исследования можно выделить следующее.
1. При развитии умеренной преэклампсии имеет место:
- повышение фактора C1q, что свидетельствует об активации системы комплемента по классическому пути;
- повышение уровня С3 – ключевого звена активации всех путей системы комплемента;
- повышение факторов FB и FD, маркеров активации системы комплемента по альтернативному пути;
- повышение факторов FH и FI – регуляторных (ингибиторных) белков, ответственных за ограничение чрезмерной активации комплемента.
2. При тяжелой преэклампсии у беременных определяется парадоксальное снижение всех анализируемых факторов комплемента, за исключением С5а, что, по сути, является «гипокомплементемией потребления». Рост концентрации С5а подтверждает продолжающийся процесс активации системы комплемента, косвенно свидетельствует о формировании МАК и продолжающемся повреждении собственных клеток и тканей матери.
3. Динамика уровней белков системы комплемента в пуповинной крови новорожденных во многом совпадает с материнской, однако они менее выражены. Отмечено значимое повышение фактора С5а у детей в подгруппе с тяжелой преэклампсией. При этом значимой корреляции между состоянием новорожденного и уровнем его собственных факторов комплемента нами не выявлено.
Обсуждение
Согласно опубликованным данным, даже при физиологической беременности отмечается умеренная активация системы комплемента, сопровождающаяся увеличением его регуляторных факторов, таких как FH, CD46, CD55 и CD59 [11–14]. Существует мнение, что этот процесс индуцируется апоптотическими клетками или свободной ДНК плода, которые неизбежно попадают в кровоток матери в процессе плацентации уже с ранних сроков беременности [13, 15].
Однако любое отклонение от границ нормальной активации и регуляции системы комплемента может привести к неблагоприятным исходам беременности, таким как невынашивание беременности, преждевременные роды, преэклампсия, задержка роста плода [16, 17].
С целью изучения роли системы комплемента в развитии преэклампсии и диагностической значимости изменений уровней его белков и регуляторов нами определены концентрации семи факторов системы комплемента (С1q, C3, С5а, FB, FH, FD, FI) у здоровых беременных, беременных с преэклампсией, а также в пуповинной крови их новорожденных.
Результаты исследования оказались довольно неожиданными. В целом отмечена общая тенденция к изменению исследуемых нами белков в каждой подгруппе женщин и у новорожденных.
Так, при умеренной преэклампсии в сыворотке крови беременных выявлено значимое увеличение концентраций факторов С1q, С3, FB, FH, в меньшей степени – FD, FI, что свидетельствует о явной активации как минимум двух путей системы комплемента (классического и альтернативного).
При тяжелой преэклампсии получена обратная динамика – отмечено довольно резкое снижение всех исследуемых белков, за исключением С5а, концентрация которого увеличивалась у таких женщин до максимальных значений. Такое снижение факторов комплемента, по-видимому, связано с их потреблением на фоне длительной активации каскада по мере прогрессирования преэклампсии (гипокомплементемия потребления), что может служить диагностическим маркером тяжести данного осложнения беременности. Аналогичная ситуация имеет место при длительно текущих иммунокомплексных заболеваниях, когда на фоне избыточного потребления факторов комплемента постепенно происходит их истощение с развитием гипокомплементемии.
Фактор C1q является первым гликопротеином в каскаде классического пути активации комплемента, широко экспрессируется в децидуальной оболочке, вневорсинчатом трофобласте и играет важную роль в формировании плаценты и развитии беременности [18].
Рост концентрации С1q при умеренной преэклампсии свидетельствует об активации системы комплемента по классическому пути, который индуцируется, как правило, комплексом антиген-антитело и во многом подтверждает развитие иммунопатологических реакций при данном осложнении беременности. Сходная динамика С1q при преэклампсии описана и другими авторами [19].
С1q также крайне важен для полноценной миграции инвазивного цитотрофобласта и ремоделирования спиральных артерий. Выявлено, что C1q, помимо печени, синтезируется децидуальными макрофагами и некоторыми клетками децидуальной оболочки матки, а также вневорсинчатым трофобластом, что облегчает его инвазию в эндо- и миометрий [16, 20]. При этом не было обнаружено ни одного депозита C4 в децидуальной оболочке в месте локализации C1q [13, 15], указывая на то, что C1q при нормальной беременности не инициирует локальную активацию комплемента в области взаимодействия матери и плода.
Накопленные данные в отношении C1q свидетельствуют о необходимости проведения дальнейших исследований для понимания его роли в развитии беременности и патофизиологии преэклампсии.
Опубликованные данные об активации альтернативного пути комплемента довольно противоречивы, однако в большинстве исследований анализировался, как правило, только один или два фактора. В связи с этим мы поставили задачу комплексной оценки наиболее важных его маркеров и регуляторов.
Важной особенностью альтернативного пути комплемента является его минимальная, но постоянная активация [21], что обеспечивается спонтанным гидролизом С3 компонента с образованием С3b-фрагмента. Последний может связываться как с патогенами, так и с собственными клетками организма: после его связывания с FB на поверхности клетки образуется нестабильная С3-конвертаза, которая расщепляет С3 на С3а- и C3b-фрагменты. При присоединении к С3-конвертазе С3b образуется С5-конвертаза – энзиматический комплекс, расщепляющий С5-компонент комплемента с образованием С5а и С5b с последующей сборкой МАК.
FB считается основным маркером активации системы комплемента по альтернативному пути, он расщепляется фактором D с образованием C3-конвертазы альтернативного пути (C3bBb), что способствует запуску дальнейшего каскада комплемента вплоть до терминального комплекса МАК. FD (адипсин), синтезируемый гепатоцитами и адипоцитами, таким образом, также является активатором альтернативного пути комплемента.
Основные регуляторные белки (ингибиторы) альтернативного пути активации комплемента – FH и FI, циркулирующие в плазме крови. FH блокирует образование С3-конвертазы и напрямую ускоряет ее распад. FI расщепляет С3b до неактивного фрагмента в присутствии кофакторов.
C5a является довольно мощным анафилотоксином, усиливает провоспалительное состояние, участвует в реакциях гиперчувствительности немедленного типа, увеличивает проницаемость сосудов микроциркуляции, вызывает вазоконстрикцию – по сути, поддерживает основные механизмы патогенеза преэклампсии.
По нашим данным, у беременных с умеренной преэклампсией определяются высокие уровни FB и FD, что свидетельствует о чрезмерной активации альтернативного пути комплемента. Рост FB и FD положительно коррелировал также с повышением показателей FH и FI в той же группе женщин, что можно объяснить компенсаторной активацией белков-регуляторов системы комплемента. Подобные результаты были получены и некоторыми другими авторами [9, 22]. По данным Lynch A.M. et al., в случае развития преэклампсии повышение FB определяется уже с ранних сроков беременности, в связи с чем авторы предлагают использовать его в качестве раннего предиктора преэклампсии [23].
Отмеченное нами значимое снижение концентраций FB, FH при длительном и тяжелом течении преэклампсии указывает на перспективу их использования не только как маркеров активации комплемента по альтернативному пути, но и в качестве критериев оценки степени тяжести преэклампсии.
Динамика уровней С3 при преэклампсии имела те же закономерности, что и описанные выше факторы. Низкие концентрации С3 обычно определяются при генетических дефектах факторов комплемента, а также описаны у 80% пациенток с атипическим гемолитико-уремическим синдромом при наличии мутации гена С3 [24]. Однако при развитии тяжелой преэклампсии потребление C3 на фоне длительной активации системы комплемента может привести к снижению его уровня.
Поскольку увеличение уровней FB, FD и C3, по нашим данным, происходит параллельно с ростом концентраций регуляторных белков FH и FI, мы полагаем, что данный механизм позволяет до определенного времени сдерживать избыточную активацию комплемента по альтернативному пути на уровне C3. Снижение же активности основных ингибиторов альтернативного пути комплемента является плохим прогностическим признаком, поскольку блокируется основной регулирующий механизм, ограничивающий чрезмерную активацию комплементарного каскада, что может привести к повреждению собственных клеток и тканей (клубочков почек, гепатоцитов, эндотелиоцитов, альвеолоцитов, трофобласта плаценты и др.), хронической активации тромбоцитов, лейкоцитов, нейтрофилов и эндотелиальных клеток с микротромбообразованием и окклюзией мелких сосудов, отеку и разрушению эндотелиоцитов (системная тромботическая микроангиопатия) и в конечном итоге – к полиорганной дисфункции.
Свидетельством активации терминального пути системы комплемента являются выявленные нами постепенно нарастающие уровни C5a в сыворотке крови беременных пациенток с преэклампсией, что согласуется с результатами других авторов [25]. При этом повышение С5а у беременных прямо коррелировало со степенью тяжести преэклампсии и отмечалось не только у женщин, но и в пуповинной крови новорожденного. Данный феномен описан и Denny K.J. et al. (2013) [26].
В настоящее время также опубликованы данные о ключевой роли анафилотоксина С5а в аберрантной плацентации при преэклампсии. Ма Y. et al. (2018) описали взаимодействие C5a с его рецептором C5aR на клетках трофобласта и показали, что C5a непосредственно ингибирует миграцию вневорсинчатого трофобласта и индуцирует его развитие по антиангиогенному фенотипу, опосредуя дисбаланс растворимой fms-подобной тирозинкиназы-1 (sFlt-1) и плацентарного фактора роста (PIGF) [27]. В связи с этим С5а может быть важной терапевтической мишенью, особенно при ранней и тяжелой преэклампсии, связанной с поверхностной плацентацией и недостаточностью инвазивного цитотрофобласта.
В заключение необходимо отметить также исследования, свидетельствующие и об активации системы комплемента по лектиновому пути при преэклампсии с изменением концентраций его маркеров [28]. Точная роль лектинового пути в развитии преэклампсии пока не ясна, однако высокие концентрации его маркеров в материнской плазме свидетельствуют о вовлечении данного механизма в патофизиологию преэклампсии.
Подобные материнским изменения уровней комплементарных белков в пуповинной крови новорожденного позволяют предположить возможность проникновения как провоспалительных факторов, так и продуктов активации комплемента от матери к плоду. Опубликованы исследования, свидетельствующие о важной роли активации комплемента в повреждении органов плода (в частности, сердца, головного мозга), развитии нейрокогнитивных и психических расстройств в его постнатальной жизни [29–31].
Таким образом, чрезмерная активация комплемента при преэклампсии может индуцироваться и классическим, и альтернативным, и лектиновым путями, что усложняет терапевтические возможности коррекции какого-либо из этих звеньев. Однако в настоящее время активно ведется поиск терапевтических средств, способных регулировать функциональную активность комплемента.
В частности, выявлено, что низкие дозы ацетилсалициловой кислоты при своевременном применении могут влиять на трофобластическую инвазию за счет подавления экспрессии С3 и фактора B в плаценте [32]. Описаны новые аспекты применения низкомолекулярного гепарина при преэклампсии: экспериментально показано его положительное действие на материнскую сосудистую сеть и эндотелиальную функцию за счет увеличения уровней PIGF и подавления активации комплемента за счет ингибирования C5a [33, 34]. Исследования показали также влияние нестероидного противовоспалительного ингибитора циклооксигеназы-2 целекоксиба на восстановление антиангиогенного дисбаланса и регуляцию системы комплемента [35]. Активно исследуются таргетные терапевтические средства, влияющие на те или иные звенья системы комплемента – моноклональный ингибитор С5 (экулизумаб), моноклональные антитела к FH, ингибиторы С3- и С5-конвертазы, ингибитор С5, антагонисты С5а и С3а и др. [36–39].
Заключение
На основании опубликованных данных и собственных исследований получены доказательства важной роли системы комплемента в патогенезе преэклампсии как одного из звеньев механизма нарушения иммунологической толерантности.
Учитывая выявленную активацию комплемента по классическому пути, индуцируемому комплексами антиген-антитело, необходим поиск потенциальных антигенов. Сроки возникновения преэклампсии (согласно данным доказательной медицины – 22 недели и позже) подразумевают определенную степень созревания высших структур центральной нервной системы плода, позволяющих ему выжить при сверхраннем рождении. Логично предположить роль церебральных белков плодового генеза в формировании иммунных комплексов и генерализованном иммунном повреждении эндотелия сосудов микроциркуляции матери. В нашем исследовании планировалось одновременное изучение нейроспецифических белков в тех же образцах сыворотки крови, однако результаты мы не получили.
Чрезмерная активация комплемента по альтернативному пути характерна для тромботической микроангиопатии с тяжелым полиорганным характером поражений, вариантом которой является и тяжелая преэклампсия. Отягощающим фактором при этом является коморбидный фон пациенток, что подтверждено и в нашем исследовании. В случае ухудшения состояния после родоразрешения у таких женщин необходимо в первую очередь подозревать наличие активации альтернативного пути комплемента.
Важным аспектом проблемы является и тот факт, что чрезмерная активация и дисрегуляция комплемента у матери при преэклампсии значительно увеличивают риск различных нарушений у детей.
Существующие варианты терапии преэклампсии преимущественно симптоматические, а потому – малоэффективные, в связи с чем перспективны дальнейшие исследования системы комплемента как потенциальной мишени в лечении и профилактике данного осложнения беременности.



