Одной из актуальных проблем в гинекологии, резко снижающей качество жизни у женщин в климактерии, является синдром вульвовагинальной атрофии (ВВА). В отличие от вазомоторных симптомов, которые проходят со временем, симптомы ВВА, как правило, возникают в перименопаузе, и прогрессируют в постменопаузальном периоде, приводя к функциональным и анатомическим изменениям. [1]
У 15% женщин в перименопаузе и 40–57% женщин в постменопаузе отмечаются симптомы ВВА, такие как сухость влагалища – 27–55%, жжение и зуд – 18%, диспареуния – 33–41%, а также повышенная восприимчивость к инфекционным заболеваниям органов малого таза – 6–8%, что значительно ухудшает состояние здоровья, негативно влияет на общее и сексуальное качество жизни [1–3]. У 41% женщин в возрасте 50–79 лет есть хотя бы один из симптомов ВВА [4].
Слизистая оболочка влагалища состоит из четырех основных слоев эпителиальных клеток: базальный слой; парабазальный слой (или митотически-активный); промежуточный гликогенсодержащий слой; поверхностный (слущивающийся) [5]. Эстрогеновые рецепторы располагаются в основном в базальном и парабазальном слоях влагалища и практически отсутствуют в промежуточном и поверхностном [6]. Митотическая активность базального и парабазального слоев эпителия влагалищной стенки блокируется при дефиците половых стероидов. Следствием прекращения пролиферативных процессов во влагалищном эпителии является исчезновение гликогена – питательной среды для лактобактерий, что приводит к полной элиминации из влагалищного биотопа его основного компонента – лактобацилл [7, 8].
Перекисьпродуцирующие лактобациллы, преобладающие в микробиоцинозе влагалища у женщин репродуктивного возраста, играют ключевую роль в предотвращении появления заболеваний урогенитального тракта. Вследствие расщепления гликогена, который образуется в эпителии влагалища при условии наличия достаточного количества эстрогенов, образуется молочная кислота, обеспечивающая кислую среду влагалища (в пределах колебаний рН от 3,8 до 4,4). Подобный защитный механизм приводит к подавлению роста патогенных и условно-патогенных бактерий. В период постменопаузы слизистая оболочка влагалища утрачивает эти защитные свойства, истончается, легко травмируется с последующим инфицированием не только патогенными, но и условно-патогенными микроорганизмами [9, 10].
Физические признаки атрофии слизистой вульвы и влагалища включают истончение эпителия, уменьшение вагинальной складчатости, побледнение, наличие петехиальных кровоизлияний, признаков воспаления. Происходит потеря упругости тканей, подкожно-жировой клетчатки и выпадение лобковых волос, снижается секреторная активность бартолиниевых желез [11–13].
Учитывая единое эмбриональное происхождение структур мочевой и половой систем, а также наличие рецепторов к половым стероидам во всех структурах урогенитального тракта, патологические изменения в пери- и постменопаузе развиваются в уретре, мочевом пузыре, мышцах и связках малого таза, что выражается в возникновении недержания мочи в покое и при напряжении, частых, болезненных мочеиспусканий и рецидивирующих инфекций мочевыводящих путей [10, 14]. Распространенность нарушений мочеиспускания у женщин в пери- и постменопаузе достаточна высока. B. Monz и соавт., изучив данные 21 эпидемиологического исследования, проведенных в разных странах мира, сообщили, что в группе женщин в возрасте от 30 до 60 лет распространенность недержания мочи составила 21,5%, а в группе женщин старше 60 лет – 44% Большинство женщин с нарушением мочеиспускания старше 45 лет указывают на совпадение начала заболевания с наступлением менопаузы. Прослеживается связь распространенности симптомокомплекса с длительностью постменопаузы и увеличением ее с 15,5% при постменопаузе до 5 лет до 71,4% при длительности постменопаузы более 20 лет [15].
Вызывает споры тот факт, что термин «атрофический вагинит» подразумевает наличие воспаления. Однако в работах, посвященных проблеме вагинальной атрофии (ВА), не было выявлено массивной колонизации влагалища условно-патогенными микроорганизмами (УПМ), в частности энтерококками, стрептококками, кишечными палочками, и количество лейкоцитов не превышало 10 в поле зрения, что может свидетельствовать об отсутствии воспалительной реакции во влагалище. К тому же, термин «атрофия» вызывает негативное отношение у женщин старшего возраста [16]. Учитывая вышеизложенное, в ходе специальной консенсусной конференции в 2012 г. эксперты Международного общества по изучению женского сексуального здоровья (International Society for the Study of Women’s Sexual Health – ISSWSH)) и Североамериканское сообщество по менопаузе (North American Menopause Society – NAMS) предложили заменить используемый в настоящее время термин «вульвовагинальная атрофия» на термин «генитоуринарный менопаузальный синдром» (ГУМС). По их мнению, он является с медицинской точки зрения более точным, всеобъемлющим и приемлемым для клиницистов, исследователей, преподавателей, пациенток и средств массовой информации. Комиссии NAMS и ISSWSH формально уже утвердили новую терминологию в 2014 г. Термин ГУМС будет представлен и обсужден на годовых собраниях обществ, посвященных здоровью женщин [10].
ГУМС – симптомокомплекс, ассоциированный со снижением эстрогенов и других половых стероидов, включающий в себя изменения, возникающие в наружных половых органах, промежности, влагалище, уретре и мочевом пузыре. Урогенитальные симптомы, обусловленные дефицитом эстрогенов, характеризуются физиологическими и анатомическими изменениями.
Симптомы ГУМС:
- Вульва – повышенная чувствительность к химическим и физическим раздражителям, механическим повреждениям и инфекциям; зуд; отек и болезненные ощущения (вульводиния).
- Влагалище – сухость и недостаточное увлажнение; диспареуния (боль и/или дискомфорт при половом акте); ощущение жжения и зуда; замедленное заживление механических повреждений и послеоперационных ран; рецидивирующие вагинальные выделения; кровоточивость вагинальной слизистой; посткоитальные кровяные выделения; снижение либидо, оргазма.
- Мочевой пузырь и уретра – поллакиурия (частые мочеиспускания – более 8 раз в день); ноктурия (любое пробуждение ночью для мочеиспускания без преобладания ночного диуреза над дневным); никтурия – преобладние ночного диуреза над дневным; цисталгия (частые болезненные мочеиспускания при отсутствии объективных признаков поражения мочевого пузыря); стрессовое недержание мочи (при напряжении) – непроизвольная утечка мочи при чихании, кашле, смехе, сморкании, поднятии тяжести или физической нагрузке; ургентное недержание мочи – непроизвольная потеря мочи, возникающая сразу после внезапного резкого позыва к мочеиспусканию; смешанная форма недержания мочи – непроизвольные потери мочи при сильном позыве в сочетании с недержанием мочи при физической нагрузке; рецидивирующие инфекции мочевых путей; гиперактивный мочевой пузырь – синдром, который характеризуется частыми неотложными позывами к мочеиспусканию при условии отсутствия инфекции или другого заболевания мочеполовой сферы с или без ургентного недержания мочи.
Диагностика ГУМС базируется на данных осмотра, лабораторных и инструментальных исследований.
Инструментально-лабораторная диагностика включает:
- Определение вагинального pH (более 5.0).
- Определение индекса созревания (ИС) вагинального эпителия (появление базальных, парабазальных клеток):
- ИС = 0,5 х количество промежуточных клеток (%) + 1 х количество поверхностных клеток (%)
- Норма – 65% и выше поверхностных клеток.
- Мазок по Паппаниколау (PAP-тест).
Микробиологическое исследование вагинального содержимого: снижение титра или элиминация лактобацилл, умеренное повышение титра УПМ.
Микробиоценоз влагалища методом полимеразной цепной реакции в режиме реального времени – преобладание условно патогенной, преимущественно анаэробной микрофлоры, снижение количества лактобактерий.
Кольпоскопия: истончение слизистой оболочки влагалища с неравномерной слабой окраской раствором Люголя, обширная капиллярная сеть в подслизистом слое.
Ультразвуковое исследование малого таза
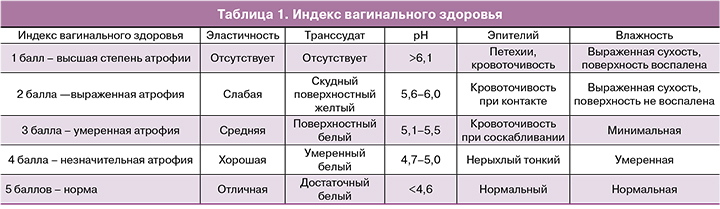
Индекс вагинального здоровья от 1 до 5 (табл. 1).
При наличии нарушений мочеиспускания необходимо проводить оценку:
- дневников мочеиспускания (частоту дневных и ночных мочеиспусканий, потерь мочи при напряжении и/или при неотложных позывах на мочеиспускание);
- функциональных проб (Вальсальвы и кашлевой);
- результатов комплексного уродинамического исследования (физиологического и максимального объема мочевого пузыря, максимальной скорости потока мочи, максимального уретрального сопротивления, индекса уретрального сопротивления, наличия или отсутствия внезапных подъемов уретрального и/или детрузорного давления, наличия остаточной мочи).
Лечение пациенток с ГУМС представляет собой сложную, длительную и трудоемкую задачу. Целью терапии является коррекция симптомов, профилактика рецидивов и улучшение качества жизни женщин в климактерическом периоде.
Принимая во внимание патогенез заболевания, терапия эстрогенами является золотым стандартом лечения ГУМС/ВВА. Все клинические рекомендации по лечению ГУМС/ВВА сходятся во мнении, что наиболее распространенным и эффективным методом лечения является системная или локальная гормональная терапия эстрогенами в различных формах, так как она достаточно быстро улучшает ИС и толщину слизистой оболочки влагалища, снижает рН влагалища и устраняет симптомы заболевания [9, 11, 12, 16]. Для лечения симптомов атрофии, сочетающихся с вегетативными и психо-эмоциональными проявлениями климактерия, используют системую менопаузальную гормональную терапию (МГТ). При наличии интактной матки с целью защиты эндометрия в состав МГТ, помимо эстрогена, необходимо включать гестаген в циклическом режиме в пременопаузе и в непрерывном – в постменопаузе. У женщин с хирургической менопаузой (гистерэктомия и пангитерэктомия) проводится монотерапия эстрогенами. Если показанием к операции был наружный генитальный эндометриоз, показана сочетанная терапия (эстрогены + гестагены) [9, 12].
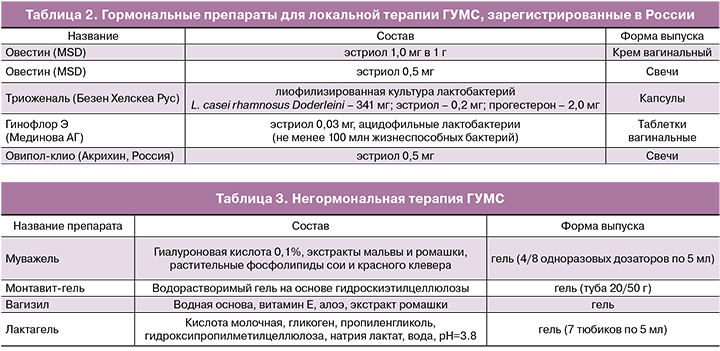
В случаях, когда пациентку беспокоят исключительно симптомы ГУМС/ВВА, отдают предпочтение локальной терапии эстриолом в виде свечей, крема или капсул, позволяющей избежать большинства системных побочных эффектов [9, 12]. Важно отметить, что эффективность локальной терапии эстриолом составляет 80–90%, в то время как системная МГТ устраняет симптомы ГУМС/ВВА лишь в 75% случаев. Из трех природных эстрогенов человеческого организма эстриол имеет самый короткий период полувыведения и наименьшую биологическую активность. Учитывая слабое пролиферативное действие на эндометрий при использовании эстриола, дополнительное введение прогестагена не требуется. Многочисленные исследования показали, что ежедневное применение эстриола в дозе 0,5 мг и 1 мг оказывает выраженный пролиферативный эффект на эпителий влагалища. В связи с этим в Российской Федерации в качестве средств первой линии лечения ГУМС/ВВА рекомендуют препараты, содержащие 0,5 и 0,2 мг эстриола [17]. Локальное применение эстриолсодержащих препаратов является безопасным и эффективным подходом к предотвращению и лечению ГУМС/ВВА, не имеющим ограничений по возрастному аспекту и длительности лечения. Локальная терапия эстрогенами ГУМС/ВВА имеет ряд преимуществ по сравнению с системным введением препаратов. Она исключает метаболизм в печени, минимально воздействует на эндометрий, имеет низкую гормональную нагрузку, минимальные побочные эффекты, не требует добавления прогестагенов, оказывает в основном локальный эффект. Пациентка должна быть проинформирована о том, что эффект достигается после одного – трех месяцев лечения и для сохранения лечебного эффекта терапия назначается длительно. После периода насыщения, составляющего 3–4 недели, в последующем доза и кратность приема препарата снижаются [12] (табл. 2).
В связи с тем, что ВВА, как правило, сопровождается практически полной элиминацией лактобацилл, патогенетически обоснованным представляется применение препаратов для местного применения, содержащих не только эстриол, но и лактобациллы. В этом ключе интерес представляет препарат гинофлор Э (Мединова АГ), содержащий не менее 100 млн жизнеспособных лактобацилл и 0,03 мг эстриола. Учитывая низкое содержание эстриола в препарате, гинофлор Э можно рекомендовать в качестве поддерживающей терапии для местного лечения ВВА, как самостоятельно, так и в сочетании с системной МГТ при ее недостаточном влиянии на урогенитальный тракт [18].

Негормональная терапия применяется при наличии противопоказаний к МГТ или в сочетании с ней. Вагинальные любриканты увлажняют слизистую влагалища, уменьшают болезненность при половой жизни (табл. 3).
Наблюдение за пациентками проводится: 1 раз в 6 месяцев в течение первого года терапии, затем 1 раз в год. Контрольное обследование включает: осмотр пациентки, ультразвуковое исследование органов малого таза; мазок на степень чистоты; мазок по Паппаниколау; определение ИС вагинального эпителия.
Лечение нарушений мочеиспускания
Консервативное лечение стрессового недержания мочи
При легкой степени эффективны тренировка мышц тазового дна по методике, разработанной калифорнийским гинекологом Арнольдом Кегелем и направленная на повышение их тонуса и развитие сильного рефлекторного сокращения в ответ на внезапное повышение внутрибрюшного давления. Но, как показывают исследования, эффективность таких тренировок в домашних условиях не превышает 40%. Основная трудность и недостаток методики Кегеля заключается в том, что пациентки не способны изолированно сокращать мышцы тазового дна, так как эти мышцы являются анатомически скрытыми. Задача изолированной тренировки различных групп мышц тазового дна может быть решена при применении аппаратов биологической обратной связи (БОС), поскольку в данном случае наглядная информация доводится непосредственно до пациентки, что позволяет легко контролировать правильность выполнения упражнений.
Механизм действия БОС заключается в возможности сократительной способности произвольного уретрального сфинктера, а также достижении его мышечной гипертрофии. Эффективность метода БОС доказана многими клиническими исследованиями. На основании всестороннего анализа 14 исследований показано, что систематические тренировки мышц тазового дна методом БОС, проводимые под контролем медицинского персонала, приводили к излечению у 24% и улучшению состояния у 47% (р=0,01) женщин с различными формами недержания мочи по сравнению с пациентками не получавшими лечения [19, 20].
Оперативное лечение стрессового недержания мочи
Для коррекции стрессового недержания мочи применяются различные оперативные методики. Выбор того или иного метода хирургического лечения должен осуществляться с учетом типа и степени тяжести недержания мочи, а также с учетом наличия и степени цистоцеле. Наиболее распространенными операциями при I и II типах стрессового недержания мочи, обусловленных гипермобильностью уретры, являются различные варианты уретроцистоцервикопексий [19–21]. При III типе, обусловленном недостаточностью внутреннего сфинктера уретры, показаны следующие оперативные методы:
При легкой и среднетяжелой степени стрессового недержания мочи, эффективно периуретральное введение объемообразующих веществ (рисунок). Механизм действия объемообразующих веществ заключается в:
- компенсации дефицита мягких тканей в области шейки мочевого пузыря за счет увеличения их объема;
- компрессии проксимальной уретры и шейки мочевого пузыря, за счет чего происходит увеличение давления закрытия уретры [22].
Современные синтетические материалы (силикон, уродекс, булкамид и др.), используемые для парауретрального введения, показывают хорошую биосовместимость, эффективность и безопасность. По данным рандомизированных исследований, эффективность данного метода при нетяжелой форме недержания мочи составляет 75–80% через год наблюдения [22].
При тяжелой степени стрессового недержания мочи показаны петлевые (слинговые) операции. Первой методикой была операция TVT (Tension-free Vaginal Tape). Метод был разработан и успешно применен на практике в 1996 [23]. В настоящее время TVT практически полностью вытеснила методика TVT-O, которая более проста в исполнении (не требует постоянного цистоскопического контроля за ходом проводников) и малотравматична. Эффективность слинговых операций (TVT, TVT-o) по данным многочисленных исследований составляет от 80 до 90% [23].

Лечение гиперактивного мочевого пузыря (ГМП)
Медикаментозная терапия является основополагающей в лечении императивных нарушений мочеиспускания. Большое значение при этом имеет правильный выбор селективного модулятора негормональных рецепторов мочеполового тракта, что возможно только на основании результатов комплексного уродинамического исследования. Препаратами первой линии для лечения ГМП являются антагонисты мускариновых рецепторов (оксибутинина хлорид, толтеродин, троспия хлорид, солифенацин). Блокада м-холинорецепторов сопровождается стереотипной реакцией детрузора, которая выражается в его расслаблении в фазу наполнения, увеличении резервуарной функции мочевого пузыря). Вследствие этого достигаются существенные позитивные изменения функционального состояния нижнего отдела мочевого тракта, что выражается в исчезновении поллакиурии и нормализации суточного профиля [24].
Перечисленные препараты снижают тонус гладкой мускулатуры мочевого пузыря (детрузора) как за счет антихолинергического эффекта, так и вследствие прямого миотропного антиспастического влияния (табл. 4).
Следует отметить, что у 10–15% больных ГМП холинолитики оказываются не эффективными. Кроме того, некоторые пациенты отказываются от длительного приема данных препаратов из-за побочных эффектов (запоры, сухость во рту, кожи, зрительные нарушения и др.). В связи с этим практическую ценность приобретают эффективные альтернативные методы лечения, из которых все большее внимание уделяется электростимуляции и нейромодуляции. Поверхностная электростимуляция мочевого пузыря применяется как при гипертонусе детрузора (по тормозной методике), так и при угнетении эвакуаторной функции (по стимулирующей методике). Она осуществляется диадинамическими или синусоидальными модулированными токами. Трансректальная (аногенитальная) методика применяется по тем же показаниям. Эффект ее действия связан с развитием пузырно-пудендального рефлекса: при стимуляции пудендального нерва снижается тонус детрузора. Данные методики чаще применяются в комплексной терапии ГМП (например, медикаментозная терапия и поверхностная электростимуляция) [24, 25].
В составе тибиального нерва проходят волокна из II и III сакральных сегментов спинного мозга, которые в большей степени, чем другие ответственны за иннервацию мочевого пузыря и его сфинктеров. Поэтому, учитывая доступность этого нерва, для лечения пациентов с ГМП применяется тибиальная нейромодуляция. Данный метод представляет собой раздражение большеберцового (тибиального) нерва слабым электрическим током. Тонкий игольчатый электрод чрезкожно вводят на глубину 3–4 см в области лодыжки снаружи. Второй (пассивный) электрод накладывают с внутренней стороны голеностопного сустава. Методика является инвазивной и болезненной, поэтому не нашла широкого применения. Поверхностная (кожная) тибиальная нейромодуляция – более простой и доступный метод, однако, по данным клинических исследований эффективность ее невысока – 25–40% [25].
Оперативное лечение ГМП
При неэффективности консервативных методов лечения применяются оперативные методы: постоянная сакральная нейромодуляция, эндоскопическое инъекционное введение ботулинического токсина в наружный сфинктер уретры и детрузор.
Сакральная нейромодуляция – это стимуляции слабым электрическим током волокон третьего сакрального нерва в крестцовом отделе позвоночника. Механизм действия метода основан на том, что стимуляция нервов на уровне моторных проводящих путей приводит к увеличению силы сокращения мышц тазового дна, что в свою очередь, подавляет сократительную активность детрузора. Кроме того, известно, что эфферентная активность тазового нерва, ответственного за сокращение мочевого пузыря, контролируется афферентными импульсами других нервов, которые действуют через центральные структуры на подчревный и тазовый нервы. Нарушение центрального механизма подавления эфферентной активности тазового нерва может быть компенсировано стимуляцией сакральных нервов. Данное оперативное вмешательство проводится совместно с невропатологом.
Эффективность метода сакральной нейромодуляции по данным литературы достигает 60–65% [24, 25].
Введение ботулотоксина в мочевой пузырь
Механизм действия ботулинического токсина обусловлен блокадой высвобождения ацетилхолина в пресинаптическую щель и, как следствие, развитием стойкой химической денервации. Препарат ботулинического токсина (лантокс, ботокс и др.) вводится инъекционным способом в детрузор, в 20–30 точек, через эндоскоп. Эффективность после введения довольно высока – 82–88%. К недостаткам метода стоит отнести обратимость его клинического эффекта, наступающую в среднем через 6–12 месяцев, что требует повторных введений препарата [24, 25].
Более сложные оперативные вмешательства при нейрогенной дисфункции мочевого пузыря: эндоскопическая сфинктеротомия; трансуретральная резекция и инцизия шейки мочевого пузыря; эндоскопическая миэктомия детрузора; заместительная кишечная пластика мочевого пузыря применяются редко.
Заключение
Таким образом, ГУМС – это часто встречающаяся патология у женщин пери- и постменопаузального возраста, приводящая к снижению качества жизни, трудоспособности, сексуальным нарушениям. Лечение данного заболевания длительное и трудоемкое. В связи с этим большое внимание необходимо уделять профилактическим мерам, которые включают:
- Сохранение регулярной половой жизни в пре- и постменопаузе. Это связано с тем, что половой акт улучшает микроциркуляцию крови во влагалище, семенная жидкость содержит половые стероиды, простагландины и незаменимые жирных кислоты, оказывающие благоприятное влияние на слизистую влагалища.
- Соблюдение определенных принципов личной гигиены: применение бесщелочных моющих средств и гелей, содержащих лактобациллы.
- Тренировка мышц тазового дна, использование аппаратов биологической обратной связи и электростимуляции мышц тазового дна.
- Отказ от курения.
- Снижение веса.



