Ангиотензинпревращающий фермент 2 (АПФ2) является одним из главных компонентов ренин-ангиотензиновой системы (РАС), которая представляет собой гормональную систему, регулирующую в организме кровяное давление, баланс жидкости и электролитов и системное сосудистое сопротивление [1]. АПФ2 преобразует компоненты провоспалительной оси РАС, такие как ангиотензин I (Анг I) и особенно ангиотензин II (Анг II), в компоненты противовоспалительной оси РАС, такие как Анг1-9 и Анг1-7 [2, 3]. Анг II действует на рецепторы ангиотензина типа 1 (АТ1) и активирует комплекс НАДФН-оксидазы, продуцирующий супероксид и стимулирующий клеточные прооксидантные и провоспалительные реакции, в то время как Анг1-7 действует на рецепторы Mas, стимулируя клеточные антиоксидантные и противовоспалительные реакции.
Научный интерес к АПФ2 особенно возрос в условиях новой коронавирусной инфекции COVID-19 вследствие того, что АПФ2 служит основным рецептором, необходимым для проникновения вируса SARS-CoV-2 в клетки человека; при этом повышенная экспрессия АПФ2 может способствовать усилению инфицирования клеток [4]. Дисрегуляция тканевой РАС предполагается как главный механизм развития тяжелых форм COVID-19 [5]. Связывание SARS-CoV-2 с АПФ2 снижает содержание АПФ2 на поверхности клеток, смещая баланс РАС в сторону провоспалительной оси (оси Анг II/AT1), что приводит к воспалению, фиброзу и прогрессированию тяжести заболевания [3, 6]. Аутоантитела к АПФ2 могут способствовать усилению провоспалительных эффектов РАС и, как предполагается, возможно их использование для оценки риска развития тяжелых форм COVID-19 [7–9].
Однако важно отметить, что АПФ2 экспрессируется не только на пневмоцитах типа II, но также на клетках эндотелия, миокарда, слизистой оболочки кишечника, эндокринных желез (щитовидной железы, надпочечников) и жировой ткани, в тканях репродуктивных органов у мужчин и женщин (в яичниках, матке), а также в тканях плаценты и клетках пуповины [10–12]. Высокая экспрессия АПФ2 в плаценте предполагает возможность внутриутробного инфицирования плода SARS-CoV-2 [13].
АПФ2 является ключевым ферментом, регулирующим превращение Анг II и Анг1-7, которые оказывают важное влияние на репродуктивные процессы у женщин [12]. Анг II стимулирует синтез стероидных гормонов, способствует развитию фолликулов и созреванию ооцитов, влияет на овуляцию, инициирует менструацию через сужение сосудов спиральных артерий, поддерживает функцию желтого тела. Баланс между Анг II и Анг1-7 имеет значение в регуляции регенерации эндометрия и сократительной активности миометрия. Кроме того, Анг II повышает пролиферацию эпителиальных и стромальных клеток матки и усиливает фиброз эндометрия. Анг 1-7 стимулирует синтез эстрадиола и прогестерона, способствует овуляции и мейозу в ооцитах. Уровень Анг1-7 ассоциируется с созреванием ооцитов человека [14]. Изменение активности АПФ2 может привести к нарушению фолликулогенеза, овуляции, функции желтого тела и способствовать развитию дисфункциональных маточных кровотечений, ассоциированных с гиперпластическими процессами эндометрия [12]. Дисрегуляция РАС яичников может вовлекаться в патофизиологию синдрома поликистозных яичников и синдрома гиперстимуляции яичников [15].
На основании вышеизложенного можно предположить, что у женщин с бесплодием, особенно с историей COVID-19, могут вырабатываться аутоантитела к АПФ2, способствующие изменению функциональной активности АПФ2, дисрегуляции РАС и развитию нарушений репродуктивной функции.
В связи с этим цель настоящего исследования: изучить распространенность и уровни аутоантител к АПФ2 у пациенток с бесплодием, перенесших СOVID-19, и у фертильных женщин.
Материалы и методы
В одномоментное исследование были включены 200 женщин, проходивших обследование по поводу бесплодия в ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России: группа 1 – пациентки, перенесшие COVID-19 в легкой и среднетяжелой форме в период с сентября 2020 г. по декабрь 2021 г. за 153 (44; 243) дня до проведения исследования (n=121); группа 2 – пациентки, не болевшие ранее COVID-19 (n=79). Тяжесть COVID-19 устанавливалась в соответствии с временными методическими рекомендациями Минздрава России «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Критериями включения женщин в исследование для групп 1 и 2 были: подписанное информированное согласие на участие в исследовании, возраст 18–45 лет, разные формы первичного и вторичного бесплодия; для группы 1– перенесенное заболевание COVID-19, подтвержденное полимеразной цепной реакцией (ПЦР) и положительным тестом на IgG-антитела к SARS-CoV-2; для группы 2 – отрицательные результаты теста на IgG-антитела к SARS-CoV-2 и отсутствие заболевания COVID-19 в анамнезе.
Группу 3 (группа сравнения) составили относительно здоровые фертильные женщины репродуктивного возраста, не болевшие ранее COVID-19 (n=80). Критериями включения в исследование были: возраст от 18 до 45 лет, сохраненная менструальная функция, отрицательный результат исследования на РНК SARS-CoV-2 методом ПЦР и отрицательные результаты тестов на антитела IgМ и IgG к SARS-CoV-2, отсутствие в анамнезе заболевания COVID-19.
Критерии исключения для всех групп: беременность и период лактации, острые воспалительные и инфекционные заболевания, тяжелые соматические и аутоиммунные заболевания, онкологические заболевания, применение гормональной и иммуномодулирующей терапии, вакцинация от COVID-19.
Идентификацию SARS-CoV-2 в мазке из ротоглотки проводили с использованием «Набора реагентов для выявления РНК коронавирусов SARS-CoV-2 и подобных SARS-CoV методом обратной транскрипции и ПЦР в режиме реального времени (SARS-CoV-2/SARS-CoV)» (ООО НПО «ДНК-Технология», Россия). Для определения антител классов М и G к SARS-CoV-2 использовали иммунохроматографический тест «ХЕМАТест анти-SARS-CoV-2» (ООО «ХЕМА», Россия). Полуколичественную оценку уровня антител класса G к SARS-CoV-2 выполняли с помощью «Набора реагентов для выявления антител класса G к spike белку SARS-CoV-2 методом иммуноферментного анализа» («ДС-ИФА-АНТИ-SARS-CoV-2-G(S)») производства НПО «Диагностические системы» (Россия).
Определение аутоантител (M, G) к АПФ2 проводили с помощью модификации непрямого твердофазного ИФА с использованием рекомбинантного АПФ2 человека, предоставленного ООО «ХЕМА» (Россия), конъюгатов моноклональных антител против IgM и IgG человека с пероксидазой хрена и других реагентов и буферных растворов для ИФА производства ООО «ХЕМА» (Россия). Препарат АПФ2 иммобилизовали на полистирольные микропланшеты MaxiSorp (Thermo Scientific Nunc, Дания) в концентрации 2,5 мкг/мл, образцы сыворотки крови исследовали в разведении 1:100, конъюгаты против IgM и IgG человека с пероксидазой хрена использовали в рабочих разведениях. Оптическую плотность (ОП) измеряли на фотометре MULTISKAN EX (Thermo Electron (Shanghai) Instrument Co., Китай) при длине волны 450 нм. Результат считали положительным, если средняя ОП исследуемого образца превышала среднюю ОП отрицательных контрольных сывороток более чем на два стандартных отклонения (2δ).
Для определения антител к прогестерону (ПГ) и фолликулостимулирующему гормону (ФСГ) применяли описанные ранее модифицированные методики ИФА с использованием конъюгата прогестерона с БСА (Progesterone 3-(O-carboxymethyl) oxime: BSA) и высокоочищенного препарата ФСГ (Sigma-Aldrich, США), конъюгатов против IgM и IgG человека с пероксидазой хрена и реагентов для ИФА производства ООО «ХЕМА» (Россия) [16, 17].
Антитела к антигенам щитовидной железы – тиреоглобулину (ТГ) и тиреопероксидазе (ТПО) определяли с использованием иммуноферментных наборов фирмы ORGENTEC Diagnostika GmbH (Германия).
Исследование было одобрено комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Статистический анализ
Статистическая обработка полученных результатов проводилась с использованием электронных таблиц Microsoft Excel и статистических программных пакетов MedCalc v. 12 (MedCalc Software Ltd, Бельгия), Statistica v. 10 (StatSoft Inc., США). Нормальность распределения данных в выборках определяли с помощью тестов Колмогорова–Смирнова и Шапиро–Уилка. В большинстве случаев при отклонении количественных данных от нормального распределения рассчитывали медианные значения с интерквартильным размахом (Mе (Q1; Q3)); для анализа применяли методы непараметрической статистики, различия между данными в двух группах оценивали с использованием U-теста Манна–Уитни, в трех группах – с использованием теста Краскела–Уоллиса с поправкой Бонферрони для множественных сравнений. Качественные данные представляли абсолютными (n) и относительными величинами (%), для оценки различий между ними использовали тест χ2. Для выявления корреляционной связи между переменными рассчитывали коэффициент корреляции Спирмена. Связь между антителами к АПФ2 и бесплодием оценивали по значению относительного риска (ОР) с 95% доверительным интервалом. Различия считали статистически значимыми при уровне значимости P<0,05.
Результаты
При сравнении клинико-анамнестических данных у женщин исследуемых групп обращает на себя внимание сопоставимость этих групп по среднему возрасту женщин, числу женщин раннего (≤35 лет) и позднего (>35 лет) репродуктивного возраста (РРВ и ПРВ), частоте инфекций, передаваемых половым путем (ИППП), и соматической заболеваемости, включая сердечно-сосудистые заболевания, хронические заболевания желудочно-кишечного тракта (ЖКТ) и мочевыделительной системы, ЛОР-органов (табл. 1). При этом группы 1 и 2 отличались от фертильных женщин значимо меньшей частотой беременностей и родов в срок и большей частотой самопроизвольных выкидышей. Кроме того, группы 1 и 2 отличались от группы сравнения более высокой частотой таких гинекологических заболеваний, как эндометриоз и полип эндометрия, и операций на органах малого таза (тубэктомий и миомэктомий), а также заболеваний эндокринной системы, преимущественно щитовидной железы. При попарном сравнении с группой 3 в группе 1 у пациенток чаще диагностировались хронический сальпингоофорит (P=0,03) и миома матки (P=0,01), а в группе 2 – хронический эндометрит (P=0,02) и аденомиоз (P=0,005). Напротив, аллергические заболевания чаще выявлялись в группе 3 у фертильных женщин, чем в группах 1 (P=0,04) и 2 (P=0,001).
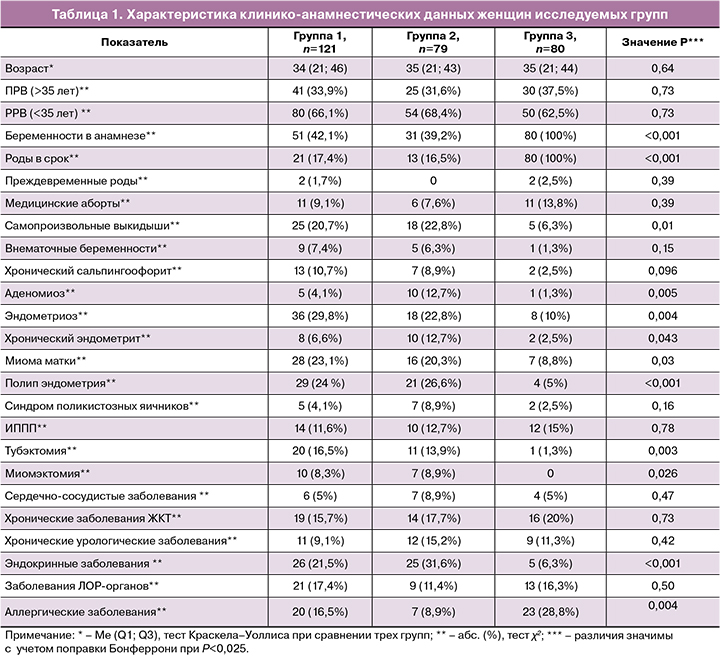
Следует отметить, что группы 1 и 2 значимо не различались между собой по частоте гинекологических и соматических заболеваний, за исключением аденомиоза, который чаще наблюдался в группе 2 (P=0,024). При этом наиболее часто в этих группах диагностировались эндометриоз, миома матки, полип эндометрия, патология щитовидной железы и наблюдались самопроизвольные выкидыши. Частота первичного бесплодия в группах 1 и 2 составляла соответственно 71/121 (58,7%) и 45/79 (57%), частота вторичного бесплодия – 50/121 (41,3%) и 34/79 (43%). Пациентки группы 1 и группы 2 не различались по длительности бесплодия (4 (3–6,5) и 5 (3–6) лет (P=0,63)) и количеству попыток ЭКО в анамнезе соответственно (1 (1–8) и 1 (1–5) (P=0,37)).
В группе 1 у пациенток, перенесших COVID-19 в легкой или среднетяжелой форме, выявлялся высокий уровень специфических противовирусных IgG-антител к SARS-CoV-2 (индекс позитивности (ИП) составлял 6,08 (2,80–10,79)) по сравнению с не болевшими COVID-19 пациентками группы 2 (ИП 0,13 (0,12–0,96)) и женщинами группы 3 (ИП 0,12 (0,11–0, 9)) (P<0,001).
В анамнезе у женщин в группе 3 наиболее часто отмечались аллергические заболевания, хронические заболевания ЖКТ, заболевания ЛОР-органов, ИППП, хронические урологические заболевания и медицинские аборты.
Антитела к АПФ2 классов M и G суммарно выявлялись более часто у женщин с бесплодием, как у переболевших COVID-19 (у 47/121 (38,8%)), так и у не болевших COVID-19 (у 32/79 (40,5%)), по сравнению с фертильными женщинами (у 16/80 (20%)) (P=0,008). Следует отметить, что частота обнаружения антител у пациенток с бесплодием в группах 1 и 2 не различалась (P=0,81) и не зависела от наличия COVID-19 в анамнезе. При этом вероятность обнаружения антител к АПФ2 у пациенток с бесплодием в группах 1 и 2 была в 1,9 и 2 раза выше, чем у фертильных женщин, значения ОР составляли соответственно 1,9 [1,2–3,2] (P=0,008) и 2,0 [1,2–3,4] (P=0,007). Частота выявления антител у пациенток с первичным и вторичным бесплодием в группе 1 (у 30/71 (42,3%) и 17/50 (34%)) и в группе 2 (у 21/45 (46,7%) и 11/34 (32,4%)) значимо не различалась (P=0,2; P=0,36).
У пациенток с первичным и вторичным бесплодием, положительных на антитела к АПФ2, в анамнезе наиболее часто отмечались: эндометриоз (у 14/51 (27,5%) и 6/28 (21,4%)), миома матки (у 12/51 (23,5%) и 7/28 (25%)), полип эндометрия (у 12/51 (23,5%) и 9/28 (32,1%)), тубэктомии (у 9/51 (17,6%) и 5/28 (17,9%)), эндокринные (у 9/51 (17,6%) и 12/28 (42,9%)) и аллергические (у 8/51 (15,7%) и 4/28 (14,3%)) заболевания. При этом заболевания щитовидной железы более часто были диагностированы у серопозитивных пациенток с вторичным бесплодием (P=0,016).
У женщин группы сравнения, позитивных на антитела к АПФ2, в анамнезе отмечалась высокая частота аллергических заболеваний (у 7/16 (43,8%)), заболеваний ЛОР-органов (у 3/16 (18,8%)), органов ЖКТ (у 3/16 (18,8%)) и ИППП (у 3/16 (18,8%)).
Частота выявления антител к АПФ2 классов M и G при сравнении трех групп значимо не различалась, однако отмечалась тенденция к более высокой частоте выявления антител у пациенток с бесплодием (табл. 2). При попарном сравнении групп частота обнаружения данных антител (M, G) в группах 1 и 2 также не различалась (значения P соответственно 0,36 и 0,40). В то время как частота выявления IgM-антител у пациенток с бесплодием в группах 1 и 2 и IgG-антител в группе 1 была значимо выше, чем у фертильных женщин (значения P соответственно 0,04; 0,01; 0,03). При этом вероятность обнаружения IgG-антител к АПФ2 у пациенток с бесплодием, перенесших COVID-19, была в 5,6 раза выше, чем у фертильных женщин (ОР 5,6 [2,1–15,2]; P<0,001).
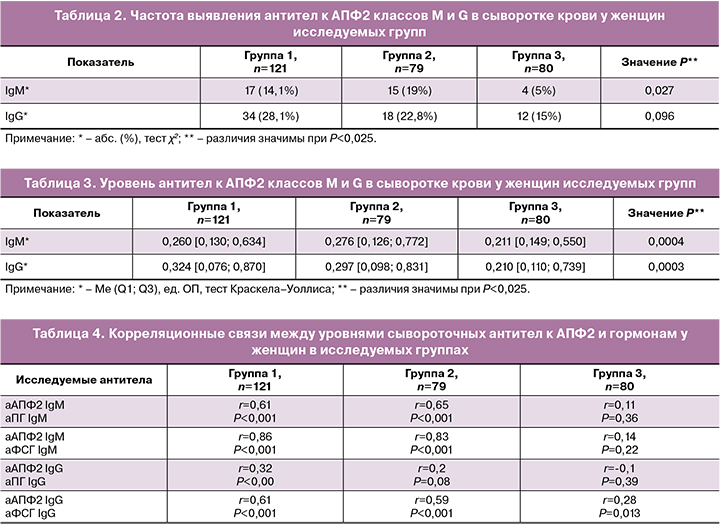
Сравнение сывороточных уровней антител к АПФ2 у женщин исследуемых групп выявило значительное различие между тремя группами по медианному уровню аутоантител к АПФ2, как класса M, так и класса G (табл. 3). При попарном сравнении групп значимо более высокие уровни аутоантител к АПФ2 классов M и G отмечались у пациенток с бесплодием по сравнению с фертильными женщинами (P=0,001 или P<0,001). При этом средние уровни аутоантител к АПФ2 (M, G) в группах 1 и 2 значимо не различались (P=0,38; P=0,22), то есть не зависели от наличия COVID-19 в анамнезе пациенток.
При сравнении частоты выявления и медианного уровня антител к АПФ2 классов M и G у пациенток с бесплодием РРВ и ПРВ в группах 1 и 2 значимых различий не было выявлено, за исключением уровня IgM-антител к АПФ2 у переболевших COVID-19 пациенток РРВ (0,273 [0,130; 0,634] ед. ОП), который был значимо выше, чем у аналогичных пациенток ПРВ (0,224 [0,132; 0,551] ед. ОП) (P=0,015).
Кроме антител к АПФ2, у пациенток с бесплодием были выявлены антитела к гормонам (ФСГ и ПГ) и к антигенам щитовидной железы (ТПО и ТГ): в группе 1 – у 32/121 (26,4%), 28/121 (23,1%), 8/121 (6,6%) и 8/121 (6,6%) женщин соответственно; в группе 2 – у 21/79 (26,6%), 19/79 (24,1%), 3/79 (3,8%) и 3/79 (3,8%) женщин. При сравнении профиля аутоантител у пациенток с бесплодием в группах 1 и 2 была найдена прямая корреляционная связь между уровнями антител классов M и G к АПФ2 и гормонам, особенно выраженная с антителами к ФСГ (табл. 4). При этом в группах 1 и 2 у пациенток, положительных на антитела к АПФ2, значимо чаще выявлялись антитела (M, G) к гормонам (к ПГ – у 17/47 (36,2%) и 11/32 (34,4%), к ФСГ – у 28/47 (59,6%) и 17/32 (53,1%)), чем у пациенток с отрицательными результатами на антитела к АПФ2 (к ПГ – у 12/74 (16,2%) и 4/47 (8,5%), к ФСГ – у 9/74 (12,2%) и 3/32 (6,4%)) (P<0,05). У фертильных женщин аналогичные корреляционные связи были слабыми или отсутствовали. Не было выявлено корреляционных связей между IgG-антителами к АПФ2 и IgG-антителами к SARS-CoV-2 в группе 1, а также между IgG-антителами к АПФ2 и IgG-антителами к антигенам щитовидной железы во всех исследуемых группах.
Обсуждение
По данным научной литературы, уровень АПФ2 в плазме крови или моче ассоциируется с различными патологиями, такими как почечные, сердечно-сосудистые заболевания и метаболические нарушения [18]. Уровни АПФ2 в плазме крови часто коррелируют с артериальной гипертензией, сердечной недостаточностью, микроальбуминурией и нефропатией у больных сахарным диабетом [19, 20]. При этом, несмотря на более высокий уровень АПФ2 в плазме, у этих пациентов наблюдалось снижение активности фермента АПФ2 и выявлялись значительные уровни циркулирующих аутоантител против АПФ2 [21]. Предполагается, что концентрации пептидов ангиотензина, в частности Анг1-7, соотношение Анг II/Анг1-7 и уровень аутоантител к АПФ2 могут использоваться как диагностические и прогностические биомаркеры при различных воспалительных заболеваниях [22].
Недавно было показано значительное повышение уровня аутоантител к АПФ2 у пациентов с COVID-19 по сравнению с неинфицированным контролем, особенно выраженное у пациентов со средней и тяжелой формой инфекции [8]. При этом связь уровней антител с тяжестью заболевания была более выраженной у больных диабетом. Предполагается, что присутствие инфекции SARS-CoV-2 усиливает сдвиг РАС в сторону провоспалительных эффектов, так как связывание вируса с АПФ2 уменьшает уровни трансмембранного АПФ2 и переводит его в растворимую циркулирующую форму. Повышение уровня циркулирующего АПФ2 может способствовать образованию специфических аутоантител. В свою очередь, присутствие высокого уровня аутоантител к АПФ2 приводит к дальнейшему снижению активности трансмембранного АПФ2 в легких и других тканях, усилению провоспалительных ответов и более тяжелым исходам COVID-19 [9].
Важно отметить, что, по результатам настоящего исследования, антитела к АПФ2 выявлялись с высокой частотой у пациенток с бесплодием независимо от наличия COVID-19 в анамнезе, значимо чаще по сравнению с фертильными женщинами. Вероятность их обнаружения у пациенток с бесплодием была в 1,9 и 2 раза выше, чем у фертильных женщин. При этом самая высокая вероятность обнаружения IgG-антител к АПФ2 (в 5,6 раза выше) была найдена у пациенток, перенесших COVID-19 в легкой или среднетяжелой форме.
Пациентки с бесплодием отличались от группы сравнения более высокой частотой самопроизвольных выкидышей, воспалительных гинекологических заболеваний, операций на органах малого таза и заболеваний щитовидной железы, в частности аутоиммунного тиреоидита. Следует отметить, что антитела к АПФ2 в значительной степени ассоциировались как с первичным, так и с вторичным бесплодием; при этом частота их обнаружения при данных формах бесплодия значимо не различалась. В анамнезе у серопозитивных фертильных женщин отмечалась высокая частота аллергических заболеваний, а также хронических заболеваний ЛОР-органов, ЖКТ и ИППП.
Обращает на себя внимание более высокий уровень антител к АПФ2 у пациенток с бесплодием по сравнению с фертильными женщинами и отсутствие значимого различия в уровнях этих антител у пациенток, перенесших COVID-19, и женщин, не болевших ранее этой инфекцией. Это, по-видимому, объясняется возможностью образования аутоантител к АПФ2 при других инфекционных и воспалительных заболеваниях, в частности, при гинекологических заболеваниях, таких как аднексит, эндометриоз, эндометрит, а также при аутоиммунном тиреоидите. Образованию данных антител могли способствовать предрасположенность женщин к аллергическим заболеваниям и проведение хирургических операций в прошлом.
Показано, что частота выявления и уровень антител к АПФ2 не зависят от возраста пациенток с бесплодием и не различаются у женщин РРВ и ПРВ; однако у пациенток РРВ, перенесших COVID-19, отмечался более высокий уровень IgM-антител к АПФ2.
Особый интерес представляют полученные данные о наличии прямых корреляционных связей между уровнями антител к АПФ2 и к гормонам, наиболее выраженных с антителами к ФСГ. Показано на животных моделях и у человека, что ось РАС, образованная АПФ2/Анг1-7/Mas, экспрессируется в яичниках, играет определенную роль в физиологии яичников и регулируется гонадотропными гормонами [15, 23]. Так, на животной модели при воздействии хорионического гонадотропина наблюдалось увеличение экспрессии мРНК АПФ2 и Mas в 2,1 и 3,3 раза соответственно. Так как при повышении уровня гонадотропных гормонов возрастает и уровень АПФ2, по-видимому, этим можно объяснить наличие выраженной прямой корреляционной связи между уровнями аутоантител к АПФ2 и ФСГ. Корреляционная связь между антителами к АПФ2 и ПГ может быть связана со стимулирующим влиянием компонентов РАС на стероидогенез.
Результаты проведенного исследования и научные данные о важном значении АПФ2 в регуляции РАС и поддержании репродуктивного здоровья и фертильности женщин позволяют предположить участие антител к АПФ2 в развитии нарушений репродуктивной функции, приводящих к бесплодию.
Заключение
Таким образом, антитела к АПФ2 выявляются с высокой частотой у пациенток с первичным и вторичным бесплодием, с воспалительными гинекологическими заболеваниями и заболеваниями щитовидной железы, независимо от наличия COVID-19 в анамнезе; при этом их частота выявления и сывороточный уровень значимо выше, чем у фертильных женщин, а вероятность обнаружения IgG-антител к АПФ2 выше у пациенток, перенесших COVID-19. Антитела к АПФ2 часто сочетаются и коррелируют по уровню с антителами к гормонам, особенно с антителами к ФСГ. На основании полученных данных, антитела к АПФ2 в значительной степени ассоциируются с первичным и вторичным бесплодием и могут вовлекаться в патофизиологию бесплодия у женщин.



