В последние десятилетия в мировой статистике отмечено существенное повышение частоты многоплодной беременности. Как известно, течение многоплодной беременности, особенно монохориальной, характеризуется высоким риском развития различных осложнений, в том числе и достаточно тяжелых, способных привести к неблагоприятному исходу [1, 2]. Одним из грозных осложнений, присущих монохориальному типу плацентации, является синдром фето-фетальной трансфузии (СФФТ), который развивается в 10–35% наблюдений [2] (TTTS. СФФТ, как правило, манифестирует во втором триместре в 15–25 недель гестации. В отсутствие внутриутробного лечения прогрессирующего СФФТ беременность в 80–100% наблюдений заканчивается неблагоприятным исходом для плода/плодов [3].
Доказанную роль в развитии СФФТ играют особенности ангиоархитектоники монохориальнойплаценты, заключающиеся в наличии межплодовых сосудистых анастомозов, объединяющих кровеносные системы плодов. Вследствие гемодинамического дисбаланса один плод становится «донором», второй – «реципиентом». Из-за гиповолемии у «донора» развиваются анурия, олигогидрамнион и артериальная гипотензия, с возможным развитием анемии, селективной задержки роста плода и ангидрамниона. У «реципиента», напротив, развиваются полиурия, полигидрамнион, гемоконцентрация и артериальная гипертензия и сердечная недостаточность.
Выделяют три типа плацентарных анастомозов: артерио-артериальные (АА), вено-венозные (ВВ) и артерио-венозные (AВ), которые расположены на плацентарной пластине и соединяют пуповины плодов-близнецов [4]. Решающая роль в патогенезе СФФТ отводится АВ анастомозам, роль АА и ВВ анастомозов остается до конца неясной и активно обсуждается в научной литературе [5, 6]. Кровоток по АВ анастомозам является однонаправленным, артерия и вена двух плодов связаны через общий котиледон, трансфузия осуществляется от артерии к вене [7].
Направление кровотока в АА и ВВ анастомозах зависит от градиента давления в кровеносных системах плодов, поэтому некоторые исследователи предполагают, что эти анастомозы способны компенсировать несбалансированную гемотрансфузию через АВ анастомозы. Возможную протективную роль АА анастомозов в патогенезе СФФТ связывают также с тем, что они чаще наблюдаются в плацентах при монохориальных беременностях, не осложненных СФФТ [6]. В то же время плацентарные ВВ анастомозы выявляются чаще при беременности, осложнившейся СФФТ [8]. По данным литературы, наличие ВВ анастомозов является независимым фактором риска развития и прогрессирования СФФТ при отсутствии плацентарных АА анастомозов [9].
На сегодняшний день единственным патогенетически обоснованным методом лечения СФФТ является фетоскопическая лазерная фотокоагуляция анастомозов (ФЛКА). Операция показана начиная с 15–16 недель гестации при II-IV стадии по Quintero или при остро нарастающем многоводии при I стадии СФФТ [10, 11]. Существуют три методики коагуляции: неселективная лазерная коагуляция с пересечением всех анастомозов на плацентарной пластинке, селективная лазерная коагуляция и по методике Соломона, при которой линейной коагуляцией сосудистого экватора соединяются уже скоагулированнные анастомозы.
Не все анастомозы могут быть визуализированы на поверхности плаценты фетоскопически [12]. Так, описаны «частично спрятанные» АА и ВВ анастомозы, которые на своем протяжении частично располагаются под сосудистым экватором внутри хорионической пластинки [13].
Цель исследования: оценить роль артерио-венозных, артерио-артериальных и вено-венозных плацентарных анастомозов в развитии и прогрессировании синдрома фето-фетальной гемотрансфузии у беременных с монохориальной двойней.
Материал и методы исследования
Нами были проанализированы течение и исходы беременности у 74 пациенток с МХБА двойней, осложненной СФФТ II-III стадии по Quintero, перенесших ФЛКА в сроки беременности от 17 до 25 недель. ФЛКА плацентарных анастомозов и дальнейшее наблюдение пациенток проводились на базах Центра планирования семьи и репродукции ДЗ г. Москвы (главный врач – к.м.н. О.А. Латышкевич) и клинического госпиталя «Лапино» (руководитель – академик РАН М.А. Курцер) за период 2015–2017 гг.
Возраст пациенток варьировал от 18 до 39 лет. Первородящих было 50 (68%), из них первобеременных 43 (86%), повторнобеременных 11 (14%). Беременность наступила самопроизвольно у 51 пациентки, на фоне стимуляции овуляции – у 11, после ЭКО и переноса эмбрионов – у 12.
В зависимости от перинатальных исходов пациентки были разделены на две группы:
- группа 1 – благоприятный перинатальный исход, то есть рождение хотя бы одного живого ребенка (n=54);
- группа 2 – неблагоприятный перинатальный исход – гибель обоих плодов (n=20).
Показанием для проведения лазерной коагуляции плацентарных анастомозов являлось наличие СФФТ II-III стадии по классификации Quintero [10]. Ультразвуковое исследование проводили на аппарате экспертного класса «Siemens Antares» с допплерометрией кровотока в системе «мать-плацента-плод».
Для выполнения фетоскопиии ФЛКА использовали оборудование и инструменты фирмы «KarlStorz», АиГ-лазер «Dornier», интродюсер 11 F. Коагуляцию плацентарных анастомозов проводили хирургическим лазером.
В ходе ФЛКА в асептических условиях под эпидуральной анестезией и ультразвуковым контролем через переднюю брюшную стенку в полость матки проводился интродьюсер 11 F, вводился фетоскоп, производился осмотр плодовой поверхности плаценты, частей плода, амниотической перегородки. Перед началом коагуляции визуализировали межплодовую перегородку и тщательно отслеживали все сосуды, пересекающие ее. Ход сосудов по возможности просматривался до зоны анастомозов, обращалось внимание не только на количество анастомозов, но и на их направление (артерио-артериальные, вено-венозные, артерио-венозные) и диаметр сосудов. Конкретный вид анастомозов определялся исходя из морфологических признаков: артерия темно-синяя, вены – ярко-красные. Качественно размер сосудов (крупные и мелкие) определяли по соответствию размера сосуда размеру введенного оптоволокна известного диаметра (0,2 мм): сосуды, диаметр которых меньше или равен диаметру проводника относили к мелким; сосуды, диаметр которых в два раза толще – к крупным. Операцию завершала амниоредукция до нормальной для данного срока гестации величины максимального вертикального кармана амниотической жидкости. Через 10–15 минут после извлечения интродьюсера проводили УЗИ для исключения кровотечения из места доступа и осложнений со стороны матери и плода [14].
Общее количество АВ, АА и ВВ плацентарных анастомозов было подсчитано при изучении записей ФЛКА.
Все плаценты после родов были изучены на наличие резидуальных анастомозов. Для этого, сразу после рождения последа, все сосуды одной из пуповин наполнялись красителем (молоком), после распределения которого по мелким сосудам на поверхности плаценты хорошо визуализировалась вся ангиоархитектоника бассейна первой пуповины. При наличии остаточных анастомозов (поверхностных и глубоких) краситель, проходя по ним, наполнял также сосудистую систему второй пуповины (рис. 1).

В ходе анализа данных по группам перинатальных исходов и стадий СФФТ использовались непараметрические статистические тесты для независимых групп (U-тест Манна-Уитни), так как значения исследуемых признаков являются непрерывными количественными величинами, а группы являются независимыми. Основанием для использования критерия Манна-Уитни послужило распределение признака «общее количество анастомозов» отличное от нормального, что было подтверждено результатами частотного анализа, а также значениями критерия Колмогорова-Смирнова. Также с помощью критерия Манна-Уитни производился анализ различий в показателях количества крупных АВ, АА, ВВ анастомозов. В качестве зависимой переменной при анализе возможной статистической значимости различий в группах выступали количественные непрерывные величины, а именно – количество крупных и мелких АВ, АА и ВВ анастомозов от донора к реципиенту и от реципиента к донору, а в качестве группирующей переменной – перинатальные исходы: 1 – благоприятный, 2 – неблагоприятный, а также стадии СФФТ по Quintero II и III.
Для статистической обработки результатов исследования было использовано программное обеспечение Medcalc 11.5 (MedCalcSoftwarebvba, Ostend, Belgium). Критической величиной уровня значимости считали 0,05. При описании количественных переменных, имеющих ненормальное распределение, использовали значения медианы (Me), 1 и 3 квартили (Q1;Q3). Оценку нормальности распределения проводили с использованием критерия Колмогорова-Смирнова и частотного анализа.
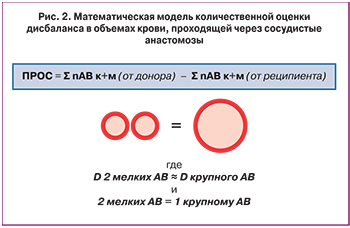 Для облегчения анализа была разработана математическая модель, которая позволила приближенно оценить разницу в объемах встречных потоков крови между плодами. Была введена безразмерная относительная величина, которая количественно отражает существующий между близнецами дисбаланс объемов кровотока. Данная величина не имела единиц измерения и определялась как разность между общим количеством крупных и мелких АВ анастомозов от донора к реципиенту и от реципиента к донору, где за 1 крупный АВ анастомоз принимается 2 мелких АВ анастомоза (рис. 2) и была обозначена нами, как приближенное расхождение в объемах сброса крови (ПРОС). Например, у пациентки с 2 крупными и 6 мелкими АВ анастомозами от донора к реципиенту и 2 мелкими АВ анастомозами от реципиента к донору без крупных АВ анастомозов, ПРОС рассчитывается как ((2×2) +6) – ((0×2) +2) и равно 8.
Для облегчения анализа была разработана математическая модель, которая позволила приближенно оценить разницу в объемах встречных потоков крови между плодами. Была введена безразмерная относительная величина, которая количественно отражает существующий между близнецами дисбаланс объемов кровотока. Данная величина не имела единиц измерения и определялась как разность между общим количеством крупных и мелких АВ анастомозов от донора к реципиенту и от реципиента к донору, где за 1 крупный АВ анастомоз принимается 2 мелких АВ анастомоза (рис. 2) и была обозначена нами, как приближенное расхождение в объемах сброса крови (ПРОС). Например, у пациентки с 2 крупными и 6 мелкими АВ анастомозами от донора к реципиенту и 2 мелкими АВ анастомозами от реципиента к донору без крупных АВ анастомозов, ПРОС рассчитывается как ((2×2) +6) – ((0×2) +2) и равно 8.
 Результаты и обсуждение
Результаты и обсуждение
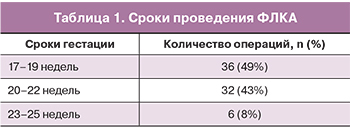
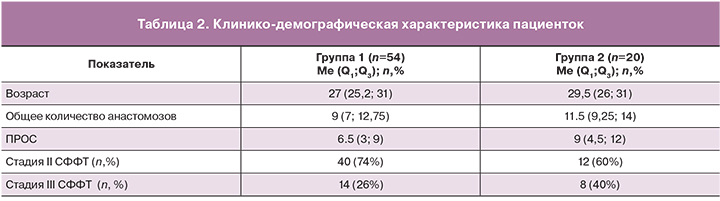
Достоверных различий между группами пациенток с различными перинатальными исходами по возрасту, анамнезу, соматической патологии выявлено не было. 36 (49%) ФЛКА было выполнено в сроки 17–19 недель, 32 (43%) операции – в 20–22 недели беременности и 6 (8%) операций – в сроки 23–25 недели. Таким образом, большинство беременных с СФФТ были прооперированы до 23 недель гестации (92%) (табл. 1). В таблице 2 приведена клинико-демографическая характеристика пациенток обеих групп. Медиана (Ме) возраста пациенток в 1-й группе составила 27 лет (25,2; 31), Ме возраста 2-й группы составила 29,5 лет (26; 31). Ме общего количества анастомозов в 1-й группе была равна 9 (7; 12,75), во 2-й группе – 11,5 (9,25; 14), также приведена описательная статистика величины ПРОС: Ме – 7, (3;10), для 1-й группы – 6,5, (3;9), для 2-й – 9 (4,5;12) (табл. 2).
Проведенный нами анализ показал, что общее количество и характер анастомозов на поверхности монохориальной плаценты при беременности, осложненной СФФТ, не связаны с перинатальными исходами и не определяют степень тяжести СФФТ (рис. 3). По данным литературы, количество анастомозов также не влияет перинатальный исход [7].
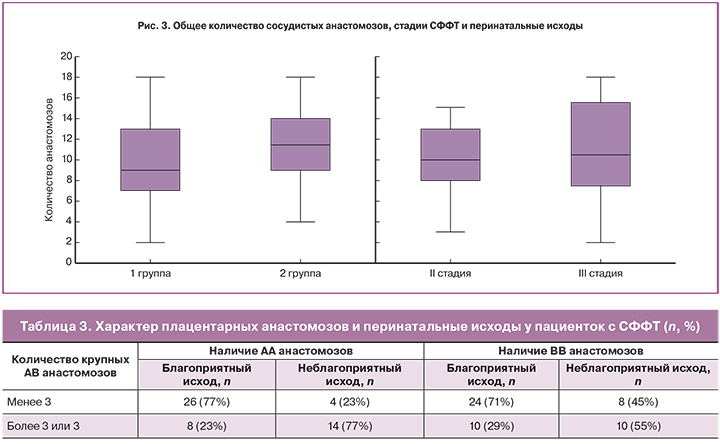
По результатам сравнения различия в общем количестве анастомозов между перинатальными исходами оказались статистически незначимыми по критерию Манна-Уитни (p=0,25).
Взяв стадию СФФТ по Quintero в качестве группирующей переменной, достоверных отличий в общем количестве анастомозов также выявлено не было (p=0,79).
Следовательно, степень гемодинамических нарушений при СФФТ определяется качественными характеристиками сосудов, а не их количеством.
Для изучения возможной протективной роли АА анастомозов в прогрессировании СФФТ и прогнозе перинатального исхода, изучены различия в количестве крупных АА анастомозов при различных исходах и стадиях СФФТ. По данным литературы, АА анастомозы встречаются в плацентах при беременностях, осложненных СФФТ реже, чем в здоровых, однако их количество при разных стадиях синдрома не изучалось [6]. В нашем исследовании различия между количеством крупных АА анастомозов в двух группах по критерию Манна-Уитни оказались статистически незначимыми (p=0,19); при этом большее число крупных АА анастомозов наблюдалось при большом количестве крупных АВ анастомозов, при более тяжелой стадии СФФТ и неблагоприятных перинатальных исходах (табл. 3).
Также была исследована возможная связь между величиной дисбаланса (ПРОС) по АВ анастомозам и наличием в плаценте АА анастомозов. Нами была предложена гипотеза, что в группах с АА анастомозами величина дисбаланса будет меньше, так как присутствие этих анастомозов способно его компенсировать. Различия в двух группах по критерию Манна-Уитни оказались статистически не значимыми (p=0,76). Как показали наши исследования, количество представленных на поверхности монохориальной плаценты АА анастомозов не связано с количеством проходящих от донора к реципиенту крупных АВ анастомозов, а также с величиной приближенного расхождения в объемах сброса крови от донора к реципиенту.
Различия между количеством крупных ВВ анастомозов в группах с различными перинатальными исходами выглядят еще менее значимыми (p=0,87). Это дает основание утверждать, что наличие или отсутствие АА и ВВ плацентарных анастомозов не влияет на перинатальные исходы у беременных с СФФТ. Различия в количестве АА и ВВ анастомозов в обеих группах наблюдения были незначительными, а двунаправленные поверхностные сосуды наблюдались чаще и в большем количестве при неблагоприятных перинатальных исходах. Поэтому нами был сделан вывод, что АА анастомозы не оказывают протективного действия при СФФТ у плодов-близнецов и не улучшают их выживаемость (табл. 4).

Для подтверждения патогенетической роли АВ анастомозов в развитии и прогрессировании СФФТ было проведено сравнения количества крупных АВ анастомозов и стадии СФФТ по Quintero на момент операции, а также их общего количества и перинатальных исходов.
В группе пациенток с благоприятным перинатальным исходом количество крупных АВ анастомозов было меньше, чем в группе пациенток с неблагоприятным исходом (р<0,05). Различия в двух группах по количеству анастомозов у пациенток с благоприятными и неблагоприятными исходами по критерию Манна-Уитни оказались статистически незначимыми (p=0,03) (табл. 4).
Различия в двух группах в значении величины приближенного расхождения в объемах сброса (ПРОС) крови по АВ анастомозам оказались статистически значимыми (p=0,07) (табл. 4).
Заключение
Полученные нами данные подтверждают определяющую роль в патогенезе СФФТ глубоких однонаправленных плацентарных АВ анастомозов от донора к реципиенту. Наблюдается связь между количеством АВ анастомозов от донора к реципиенту и перинатальными исходами после ФЛКА. Большее количество крупных АВ анастомозов (более трех) от донора к реципиенту предопределяет неблагоприятный перинатальный исход.
Таким образом, проведенное исследование позволило установить, что прогностически неблагоприятным в отношении перинатальных исходов при СФФТ является наличие более трех АВ плацентарных анастомозов. АА анастомозы не обладают протективной ролью, более того, их большое число усугубляет течение заболевания; ВВ анастомозы не являются определяющим фактором тяжести СФФТ. При проведении ФЛКА необходима оценка всех типов плацентарных анастомозов для прогнозирования перинатальных исходов после внутриутробной коррекции СФФТ.



