Андрогены – это половые гормоны, которые имеют важное значение в функционировании как мужской, так и женской репродуктивных систем. У женщин андрогены играют доминирующую роль в процессах фолликулогенеза, что ярко демонстрирует синдром поликистозных яичников (СПЯ) [1]. В сыворотке крови у женщин в порядке убывания концентрации основными циркулирующими андрогенами являются дегидроэпиандростерон-сульфат (ДГЭА-С), дегидроэпиандростерон (ДГЭА), андростендион (А), тестостерон (Т) и дигидротестостерон (ДГТ) [2]. Андрогены реализуют эффекты через связывание с андрогенными рецепторами (АР), которые относятся к суперсемейству ядерных рецепторов [3]. Непосредственно с АР связываются только биоактивные андрогены, тестостерон и ДГТ, в то время как проандрогены, ДГЭА и А, для реализации андрогенных эффектов, требуют преобразования [4].
С возрастом у женщин происходит прогрессивное уменьшение фолликулярного резерва в яичниках, что коррелирует со снижением фертильности, максимально в период от 30 до 40 лет. Наряду с наблюдаемым снижением количества антральных фолликулов (КАФ), также понижается качество ооцитов [5]. Известно, что основным фактором риска бедного овариального ответа (БОО) является возраст [6]. Подобное происходит не только из-за уменьшения пула фолликулов в яичниках [7], но также и в результате понижения чувствительности яичников на фолликулостимулирующий гормон (ФСГ) [8] и снижения уровня предшественников андрогенов (ДГЭАС, ДГЭА, А) и биоактивного андрогена – тестостерона [2, 9].
Можно допустить также, что биодоступность андрогенов в яичниках может сопровождаться активацией овариального ответа. Однако в недавнем исследовании с использованием высокочувствительных и специфичных методов жидкостной хроматографии-масс-спектрометрии показано, что уровни андрогенов в крови или фолликулярной жидкости доминантного фолликула не являются предикторами результатов программ вспомогательных репродуктивных технологий (ВРТ) [10]. Последнее инициирует дальнейшую дискуссию о роли андрогенов.
Сложности оценки показателей андрогенов обусловлены целым комплексом проблем, в том числе методом исследования биологических сред, используемым для диагностики различных клинических состояний. Так как молекула тестостерона характеризуется низкой молекулярной массой, то использование рутинных методов иммунохемилюминесцентного анализа (ИХЛА) не всегда в полной мере отражает циркулирующие уровни тестостерона, дополняя сложность тестирования различными реактивами определения и самой методикой исследования. «Золотым стандартом» определения стероидов в различных биологических жидкостях в настоящее время является жидкостная хроматография с масс-спектрометрией [11–13].
Фолликулярная жидкость обеспечивает критическую микросреду для развития ооцитов и представляет собой транссудат компонентов сыворотки и секрета тека-клеток и клеток гранулезы. Изучение ключевых регуляторных факторов в фолликулярной жидкости может предсказать физиологический статус созревающего ооцита, что важно для определения качества ооцита и его последующего потенциала стать жизнеспособной зиготой, адекватно поддерживающей развитие эмбриона.
Поскольку фолликулярная жидкость непосредственно участвует в метаболических процессах фолликулярной среды, а также сопряжена с качеством ооцитов, ее исследование актуально как при гиперандрогенных, так и при гипоандрогенных состояниях для оценки взаимосвязи с развитием сниженного овариального резерва (СОР) и БОО. Анализ корреляции между концентрациями андрогенов в сыворотке и фолликулярной жидкости представляется актуальным особенно в аспекте изучения СОР и БОО и для возможного определения андрогенного профиля в биологической среде и диагностического маркера снижения овариального резерва.
В связи с вышесказанным, целью данного исследования являлась оценка связи андрогенов в сыворотке крови и фолликулярной жидкости по данным ВЭЖХ-МС/МС у женщин с бесплодием в зависимости от овариального ответа в программах ВРТ (ЭКО/ИКСИ).
Материалы и методы
Было проведено одномоментное исследование в параллельных группах. Согласно критериям ESHRE (2011 г.) в исследование включены 150 пациенток с бесплодием, в период с 2019 по 2021 гг., обратившиеся в ФБГУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России для проведения программы ЭКО/ИКСИ и ПЭ. Средний возраст женщин составил 37,3 (2,4) лет. Все пациентки обследованы в соответствии с приказом 803Н Минздрава РФ и подписали информированное согласие для участия в исследовании. Критериями исключения из исследования были хирургическая менопауза, гистерэктомия, надпочечниковая недостаточность, гормонпродуцирующие опухоли, ожирение (ИМТ≥30 кг/м2) и дефицит массы тела (ИМТ≤18,5 кг/м2), ВИЧ-инфекция и другие иммунодефицитные состояния, иммуновоспалительные ревматические заболевания, иммуномодулирующая терапия, онкологические заболевания.
Пациенты были разделены на группы в зависимости от уровня овариального резерва, в соответствии со стратификацией по POSEIDON, и овариального ответа на стимуляцию, в соответствии с Болонскими критериями: 1-я группа – 50 пациенток с СОР (АМГ<1,2 нг/мл, КАФ<5) и БОО на стимуляцию (≤3 ооцитов во время трансвагинальной пункции), 2-я группа – 100 пациенток с нормальным овариальным резервом (НОР) (АМГ≥1,2 нг/мл, КАФ≥5), из них 50 пациенток с нормальным овариальным ответом (НОО) (>9 ооцитов) и 50 пациенток со сниженным овариальным ответом (СОО) (<9 ооцитов).
Пациенткам проводилась овариальная стимуляция в программе ВРТ (ЭКО/ИКСИ) препаратами рекомбинантного ФСГ (ГОНАЛ-ф, раствор для подкожного введения, «Мерк Сероно С.п.А.» (Италия)) и мочевыми гонадотропинами (Менопур, лиофилизат для приготовления раствора для внутримышечного и подкожного введения, «Ферринг ГмбХ»). При диаметре фолликула, не менее 17–18 мм вводился триггер овуляции за 36 ч до забора ооцитов. В день проведения трансвагинальной пункции яичников производился забор венозной крови из локтевой вены. Забранная кровь центрифугировалась при условиях: скорость, время и температура центрифугирования 300 g, 20 мин при 4°C. После центрифугирования надосадочная жидкость отбиралась и центрифугировалась повторно при условиях: скорость, время и температура центрифугирования 12000 g, 10 мин при комнатной температуре. При трансвагинальной пункции яичников производился забор фолликулярной жидкости из фолликулов. Полученный материал центрифугировался в течение 10 мин при скорости 3000 g и -4°C. Хранение биоматериала осуществлялось при температуре -80°C.
Для измерений концентраций гормонов методом тандемной масс-спектрометрии использовался набор аналитических стандартов стероидных гормонов SteroidHormonesinSerumLC-MS/MSAnalysisKit компании JASEM (Турция). Набор содержал 4 калибровочных смеси 16 стероидных гормонов в лиофилизованном виде, 2 уровней контроля качества в лиофилизованном виде и смеси внутренних стандартов (IS). Подвижные фазы A (дистиллированная вода miliQ с 0,01% муравьиной кислоты) и B (ацетонитрил c 0,01% муравьиной кислоты), а также MTBE (≥99,5%, HPLCgrade, FisherChemical), MeOH (99,9%, HPLCBasic, Scharlau), ацетонитрил (99,9%, HPLCGradientgrade, FisherChemical) и муравьиная кислота (98%, Sigma-Aldrich), которые использовались для подготовки фазы и пробоподготовки образцов. Разделение гормонов осуществлялось на колонке Poroshel 120 EC-C18 длиной 100 мм, внутренним диаметром 2,1 мм и размером зерна сорбента 2,7 мкм.
Для анализа образцов использовалась система ВЭЖХ-МС/МС, которая включает в себя тройной квадрупольный масс-спектрометрический детектор ABSciexQTRAP 5500 с источником электрораспылительной ионизации и жидкостной хроматограф Agilent 1260 Infinity (Agilent) с насосом высокого давления, термостатом колонок и автосемплером на 108 виал.
Статистический анализ
Для статистического анализа использовались скрипты, написанные на языке программирования R [R Core Team (2018). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/] в RStudio [RStudio Team (2016). RStudio: Integrated Development for R. RStudio, Inc., Boston, MA URL http://www.rstudio.com/].
Количественные показатели были проверены на соответствие нормальному распределению с помощью критерия Колмогорова–Смирнова, в случае подтверждения гипотезы о соответствии нормальному распределению представлены в виде средних значений и стандартных отклонений М (SD), в противном случае – в формате медиана и квартили Me (Q1; Q3). Качественные показатели представлены в виде абсолютных и относительных величин. Для определения возможной связи между переменными использовался корреляционный анализ Спирмена (R).
Сравнение характеристик по группам проводилось для количественных переменных с использованием параметрического критерия ANOVA или непараметрического критерия Круаскала–Уоллиса (при сравнении трех групп), попарное сравнение осуществлялось с помощью t-критерия Стьюдента или непараметрического теста Манна–Уитни (для двух групп); Значение р<0,05 считалось статистически значимым, а в случае применения поправки Бонферрони для множественного сравнения показателей между группами – считали уровень значимости при р<0,017.
Результаты
В исследование были включены женщины репродуктивного возраста с бесплодием, обратившиеся для достижения беременности в программе ЭКО/ИКСИ в ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России. Средний возраст женщин – 37,3 (2,4) года. У всех пациенток был регулярный менструальный цикл, средняя продолжительность которого составила 27,4 (2,1) дня. Возраст наступления менопаузы у матерей пациенток в группе составил 45,6 (2,6) года. Все пациентки отмечают высокий уровень интеллекта и социальной ответственности. Средний показатель индекса массы тела (ИМТ) составил 24,6 (5,4) кг/м2. Все вышеперечисленные выше показатели были сопоставимы по группам (р>0,05 критерий ANOVA).
Был проведен сравнительный анализ данных о концентрациях гормонов, полученных в сыворотке крови и фолликулярной жидкости в день аспирации ооцитов методами ВЭЖХ-МС/МС. Обнаружено статистически значимое снижение концентрации общего тестостерона и андростендиона в крови в зависимости от степени снижения овариального резерва и овариального ответа на стимуляцию в программе ЭКО. Так у женщин с СОО обнаружено статистически значимое понижение сывороточных показателей Тобщ – 0,438 (0,325; 0,553) и андростендиона – 1,795 (1,443; 2,509), по сравнению с женщинами с НОР и НОО (Тобщ – 0,654 (0,523; 0,945), А – 2,624 (2,145; 3,273)). Аналогичные, однако статистически незначимые изменения концентрации общего тестостерона, как в крови, установлены в фолликулярной жидкости, составив у пациенток с НОО и НОР 0,352 (0,117; 0,782) нг/мл, с НОР и СОО – 0,314 (0,106; 0,674) нг/мл, с СОР и БОО – 0,159 (0,097; 1,422) нг/мл соответственно. Также выявлено понижение концентрации ДГЭА-С в фолликулярной жидкости у женщин со снижением овариального резерва и ответа яичников. При исследовании показателей андростендиона в фолликулярной жидкости отмечена обратная, однако статистически незначимая тенденция, с более низкими значениями в группе женщин с НОР и НОО – 1,795 (1,443; 2,509) нг/мл, по сравнению с 2,238 (1,899; 2,914) нг/мл в группе женщин с НОР и СОО на стимуляцию, и 2,553 (1,448; 2,965) нг/мл у женщин с СОР (таблица).
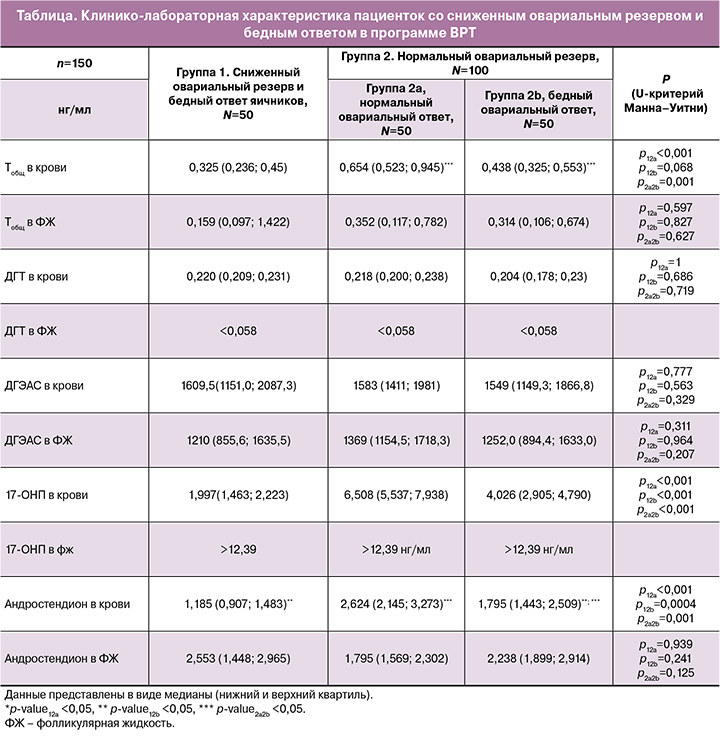
Также проведен сравнительный корреляционный анализ концентраций андрогенов, полученных в плазме крови и фолликулярной жидкости при исследовании последних методом ВЭЖХ-МС/МС в день аспирации ооцитов в каждой из групп (рис. 1–3).

В группе с СОР и БОО наблюдалась сильная корреляционная взаимосвязь между уровнями андростендиона и Тобщ в фолликулярной жидкости (R=0,8; р<0,001), умеренная корреляция между концентрациями андростендиона и Тобщ в крови (R=0,69; р<0,001), андростендиона и 17-гидроксипрогестерона (17-ОНП) в крови (R=0,65, р<0,001), ДГЭА-С в крови и фолликулярной жидкости (R=0,61; p=0,002), андростендиона в крови и фолликулярной жидкости (R=0,54; р=0,007), андростендиона в крови и ДГЭА-С в фолликулярной жидкости (R=0,51; р=0,009) и ДГЭА-С в фолликулярной жидкости и Тобщ в крови (R=0,5; р=0,012) (рис. 1).
В группе с НОР и СОО наблюдались сильные корреляционные связи между уровнями андростендиона и Тобщ в фолликулярной жидкости (R=0,83; р<0,001), андростендиона и Тобщ в крови (R=0,76; р<0,001) и между 17-ОНП и Тобщ в крови (R=0,74; р<0,001) (рис. 2).
В группе с НОР и НОО отмечены сильные корреляционные связи между уровнями андростендиона и Тобщ в крови (R=0,93; р<0,001), андростендиона и Тобщ в фолликулярной жидкости (R=0,87; р<0,001), андростендиона в крови и Тобщ в фолликулярной жидкости (R=0,84; р<0,001), Тобщ в крови и фолликулярной жидкости (R=0,78; р<0,001) и умеренные корреляционные связи между уровнями ДГЭА-С в крови и андростендиона в фолликулярной жидкости (R=0,7; р<0,001), ДГЭА-С в крови и фолликулярной жидкости (R=0,5; р=0,008) (рис. 3).
Таким образом, группа женщин с НОР и НОО в программе ЭКО прдемонстрировала наиболее сильные корреляционные взаимосвязи между показателями андростендиона в крови Тобщ в крови и андростендионом в крови и Тобщ в фол жидкости, что позволяет рассматривать данную группу как группу контроля. Тогда как в группах с измененным овариальным ответом как при СОР и БОО, так и НОО и СОР данные корреляционные механизмы не продемонстрировали свои силы, как в группе контроля.
Обсуждение
Исследования процессов фолликулогенеза свидетельствуют о вовлечении андрогенов в биорегуляцию овариального резерва, что приводит к особенностям оогенеза и эмбриогенеза и в отдельных случаях сопровождается нарушениями в ооцит-кумулюсных комплексах, отражаясь на качестве эмбрионов и частоте оплодотворения. В работе впервые проведена сравнительная оценка андрогенного профиля у пациенток с бесплодием, исследуемая с помощью «золотого стандарта» – масс-спектрометрии.
Закономерно, что андрогенный дефицит у женщин изучается в постменопаузальном периоде и не может резко клинически сформироваться, и вполне обоснована оценка его проявлений в более раннем периоде – репродуктивном возрасте при еще сохраненном ритме менструаций. Известно, что у женщин после 35 лет отмечается постепенное уменьшение КАФ и уровня АМГ независимо от их исходных показателей, что характерно и для пациенток с гиперандрогенией, СПЯ в том числе, что вносит вклад в проблему бесплодия.
Многочисленные работы, проведенные к настоящему времени, свидетельствуют о большом интересе к изучению андрогенов как определяющих половую дифференцировку и поведенческие реакции, обеспечивающие и поддерживающие качество жизни не только у мужчин, но и у женщин.
Адекватные уровни андрогенов необходимы для непрерывного роста и развития фолликулов и блокирования атрезии фолликулов. Реакция яичников на овариальную стимуляцию, безусловно, зависит от овариального резерва и возраста женщины [14, 15] и имеет низкую вариабельность [16]. Прогнозирование ответа яичников до вступления в программу экстракорпорального оплодотворения (ЭКО) может помочь определить тактику ведения и предсказать результативность [17]. Концентрации гормонов в сыворотке крови снижаются у женщин с возрастом наряду со снижением репродуктивного потенциала, аналогичные данные происходят и при первичной недостаточности яичников и СОР [18, 19].
Установлено, что даже после естественного прекращения синтеза эстрогенов, клетки гранулезы сохраняют способность секретировать андрогены при наличии андрогенного субстрата [20], следовательно, регулирующая система, возможно, находится не на уровне ароматазной активности (т.е. превращения тестостерона в эстрадиол). Уменьшение концентрации андрогенов приводит к постепенному снижению синтеза эстрадиола фолликулом, а этому предшествует депрессия концентрации андрогенов как более раннее физиологическое событие, так как осуществляется тека-клетками, а не клетками гранулезы [21].
Полученные нами данные подтверждают роль и вовлеченность андрогенов в процессы фолликулогенеза. Статистически значимые изменения концентрации одного из возможных маркеров фолликулогенеза – андростендиона в фолликулярной жидкости и в крови в зависимости от овариального резерва свидетельствуют о разных биохимических реакциях гранулезных клеток на экзогенные гонадотропины. В нашем исследовании обнаружили у женщин с нормальным овариальным ответом и нормальным овариальным резервом наиболее высокую концентрацию андростендиона в крови и низкую в фолликулярной жидкости, тогда как у женщин с бедным овариальным ответом и нормальным овариальным резервом и со сниженным овариальным резервом показатели андростендиона в сыворотке крови и фолликулярной жидкости статистически значимо отличались между группами. Более высокие показатели андростендиона в крови и в фолликулярной жидкости были отмечены у пациенток с нормальным овариальным резервом и бедным овариальным ответом, и, наоборот, самый высокий уровень андростендиона в фолликулярной жидкости и его низкая концентрация в сыворотке крови была отмечена у женщин с самыми низкими показателями АМГ – при сниженном овариальном резерве. Полученные результаты свидетельствуют о доминирующей роли андрогенов в процессах фолликулогенеза и овариального ответа и разнонаправленных изменениях андрогенного профиля в зависимости от овариального ответа, что является патогенетически обоснованным и подтверждает активность ферментных систем, участвующих в синтезе овариальных андрогенов.
Также отмечено снижение уровня тестостерона в зависимости от овариального ответа с наиболее низкими концентрациями как в сыворотке крови, так и в фолликулярной жидкости у женщин со сниженным овариальным резервом и бедным овариальным ответом, несмотря на отсутствие статистической значимости. Тогда как у женщин с нормальным овариальным ответом и нормальным овариальным резервом отмечены самые высокие уровни общего тестостерона как в сыворотке крови, так и в фолликулярной жидкости.
Подавляющее большинство работ о вовлеченности андрогенов в процесс фолликулогенеза подтверждают их стимулирующую роль на этапах раннего роста фолликула, поддерживающую роль в динамике его развития и их участие в инициации развития фолликулов на поздней стадии. Эти находки обосновывают своевременную, еще не доказанную, но принятую исследователями концепцию о возможности предварительного лечения андрогенами для усиления фолликулярного ответа на ФСГ у женщин, ранее имевших бедный ответ яичников в программе ЭКО. Все вышесказанное делает актуальным обсуждение роли гиперандрогении, как и гипоандрогении, в развитии ооцитов, например, при СПЯ [22]. Более того, наличие различных андрогенов в фолликулярной жидкости [23], сильная экспрессия АР в кумулюсных клетках преовуляторных фолликулов [24] и данные о том, что расширение кумулюсов и нарушения жизнеспособности ооцитов/эмбрионов из-за потери передачи сигналов андрогенными рецепторами гранулезы [25], предполагает, что потенциальное использование андрогенов в системах культивирования in vitro является областью, требующей дополнительных исследований.
Фундаментальные исследования, анализирующие концентрацию тестостерона в сыворотке крови и фолликулярной жидкости, достаточно противоречивы: снижение уровня тестостерона в сыворотке с возрастом, по данным Meldrum D.R., не обнаружено, так же, как и снижение его концентрации в фолликулярной жидкости пациентов с бедным ответом в естественном цикле [26]. В связи с чем необходимы исследования, оценивающие эндокринную связь между сывороткой и фолликулярной жидкостью, чтобы дать ответ насколько концентрация андрогенов в сыворотке крови тесно взаимосвязана с фолликулогенезом и оценить влияние андрогенов у пациенток с бесплодием и сниженным овариальным резервом.
В исследовании Fuentes A. et al. андрогенного профиля в сыворотке и фолликулярной жидкости женщин с БО в программе ЭКО показано, что уровень циркулирующих андрогенов в условиях контролируемой овариальной стимуляции без СОР выше, чем в естественных циклах. Показатели общего тестостерона, андростендиона и ДГЭА-С не отличались в группе POSEIDON 1, но значительно снизились в группе POSEIDON 3. Кроме того, значения ДГЭА-С в фолликулярной жидкости также были существенно снижены в группе POSEIDON 3, по сравнению с контролем. Кроме того, уровень тестостерона в сыворотке был снижен в группах POSEIDON 2 и 4, по сравнению с контролем [27].
Можно сформировать точку зрения о том, что более низкая концентрация периферических андрогенов у женщин с БО, которая, как известно, снижается с возрастом, может быть недостаточной для блокирования апоптоза фолликулов. Однако подобное может быть компенсировано увеличением их чувствительности к ФСГ для того, чтобы детерминировать их рост и развитие. По мнению Klein N.A. et al. низкое насыщение концентрации периферических андрогенов в сыворотке крови не связана с концентрацией андрогенов в фолликулярной жидкости [28]. По мнению некоторых исследователей, после эндогенного выброса или инъекции ХГЧ концентрация андростендиона снижается до разных значений, однако предполагается что уровень снижения должен меняться в зависимости от овариального ответа [29, 30]
Возможная точка зрения о способности фолликулярной среды компенсировать повышение или снижение концентрации андрогенов в сыворотке крови, по результатам нашего исследования, не подтверждена, иначе полученные данные были бы представлены в виде одинаковых значений. Более того, отмечено изменение концентрации андрогенов в фолликулярной жидкости в зависимости от овариального резерва и ответа. Таким образом, наше исследование подтверждает концепцию взаимосвязи концентраций андрогенов в фолликулярной жидкости и сыворотке крови в зависимости от овариального ответа. Эти данные подтверждены в исследовании Ung оценки фолликулярных концентраций ДГЭА-С в программе ВРТ. На фоне приема перорального приема ДГЭА, были отмечены более высокие фолликулярные концентрации ДГЭА-С у пациенток с бесплодием на фоне андрогенного прайминга за счет активности фолликулярной сульфатазы, превращающей ДГЭА в ДГЭА-С.
По нашим данным более высокие концентрации общего тестостерона в фолликулярной жидкости и в крови, а также андростендиона в крови и низкие концентрации в фолликулярной жидкости сопряжены с лучшими показателями оогенеза [31, 32]. Изменения концентрации фолликулярных гормонов во время овуляции необходимы для окончательного созревания ооцитов и репродуктивного успеха.
В данной работе впервые было показано, что снижение концентрации андрогенов носит разнонаправленный характер, и формирование его недостаточности или дефицита сопряжено со снижением овариального резерва и бесплодия, а четкая корреляционная динамика снижения андростендиона в зависимости от овариального резерва позволяет рассмотреть его в качестве биохимического маркера не только гиперандрогенных состояний, но и гипоандрогенных, в том числе андрогенного дефицита у молодых женщин.
Заключение
Таким образом, проведенное нами исследование подтверждает гипотезу о важной роли влияния андрогенов на процессы фолликулогенеза и определяющей овариальный ответ. Однако физиология овариальных процессов достаточно сложна и необходимы дополнительные исследования для изучения снижения овариального резерва и результатов программ ВРТ. Можно предположить, что полученные нами результаты позволят выделить и патогенетически обосновать целесообразность проведения исследований по влиянию гормонального прайминга у женщин с бесплодием и СОР как фактор, блокирующий апоптоз фолликулов и увеличивающий чувствительность к ФСГ.



