Генитальный эндометриоз представляет собой хроническое гормонозависимое гeнeтически обусловленное заболевание с доброкачественными разрастаниями эндометриальной ткани за пределами тела матки [1, 2]. По данным разных авторов, генитальный эндометриоз диагностируется в популяции у 15–40% женщин репродуктивного возраста и является причиной первичного и вторичного бесплодия [3].
Согласно клиническим и экспериментальным данным, генитальный эндометриоз определяется как эстрогензависимое заболевание [4–6]. Эстрогены способствуют выживанию эндометриоидных клеток, воспалению и прогрессированию поражений, а прогестерон, в свою очередь, подавляя экспрессию рецепторов эстрогенов, может блокировать действие эстрогена [7, 8]. Рецепторы эстрогенов альфа и бета (ESR1 и ESR2) и рецептор прогестерона (PGR) являются ключевыми стероидными рецепторами, участвующими в патофизиологии генитального эндометриоза [9,10]. Так, в некоторых исследованиях показан более низкий уровень ESR1 в эндометриоидной ткани в связи с переходом от преобладания ESR1 к ESR2 [11]. Экспрессия РНК ESR2 в 40–140 раз выше в стромальных клетках, полученных из эндометриом яичников, по сравнению со здоровыми эутопическими стромальными клетками эндометрия [12]. Экспрессия ESR2 также выше в эутопическом эндометрии у женщин с эндометриозом по сравнению со здоровыми женщинами. Предполагается, что высокие уровни ESR2 в эндометрии увеличивают риск развития эндометриоза [13].
Несмотря на то что патогенез эндометриоза до конца не изучен, важная роль в формировании и прогрессировании заболевания отводится генетическим факторам [14]. Благодаря развитию молекулярной генетики, все больше накапливается данных о генетически обусловленных изменениях на уровне нуклеотидной замены, которые оказывают влияние на уровень экспрессии кодируемых белков или их функциональную активность, которые, в свою очередь, могут определять формирование и развитие генитального эндометриоза [15]. В связи с этим важен поиск молекулярно-генетических маркеров генитального эндометриоза, который может способствовать разработке новых методов прогнозирования и выявления патологического процесса на ранних стадиях развития заболевания, а также внедрению новых методов лечения и профилактики генитального эндометриоза.
Цель исследования: изучить связь между полиморфными вариантами генов рецепторов эстрогенов и прогестерона и генитальным эндометриозом.
Материалы и методы
В исследовании приняли участие 890 женщин: 102 женщины с генитальным эндометриозом и 788 женщин группы контроля. Все женщины были коренными уроженками Центрального Черноземья России [16], не имеющими родства между собой. Группа для исследования формировалась сплошным методом на базе гинекологического отделения ОГБУЗ БОКБ Святителя Иoасафа. Критерием включения в группу больных являлось наличие изолированного генитального эндометриоза, верифицированного эхографически, гистероскопически и морфологически. Критерии исключения: наличие ранее диагностированных злокачественных заболеваний тела матки, яичников, эндометрия, беременность.
Группа контроля отбиралась из числа здоровых женщин без пролиферативных заболеваний органов репродуктивной системы, которые обратились в клинико-диагностическое отделение Перинатального центра Белгородской областной клинической больницы Святителя Иоасафа для прохождения диспансеризации.
Средний возраст женщин с генитальным эндометриозом (41,45±6,34 года) и группы контроля (41,76±6,89 года) был сопоставим (по U-критерию Манна–Уитни p>0,05). Данное исследование было одобрено Региональным комитетом по этике Белгородского государственного национального исследовательского университета (протокол №7 от 18 апреля 2013 г.). Все клинические, клинико-инструментальные, генетические исследования проводились с информированного согласия на использование материалов лечебно-диагностических мероприятий, связанных с заболеванием, для научно-исследовательских целей.
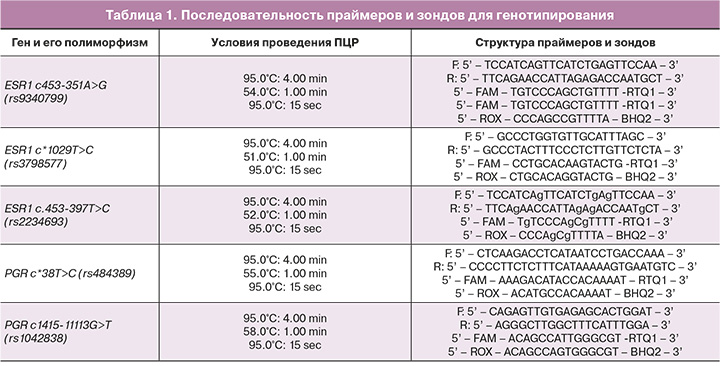
Материалом для исследования послужила геномная ДНК, выделенная методом фенол-хлороформной экстракции из лейкоцитов периферической крови. Для анализа были выбраны следующие полиморфные локусы генов рецепторов прогестерона и эстрогенов: ЕSR1 с453-397Т>С rs2234693, ЕSR1 c.1029Т>С rs3798577, ЕSR1с.453-351А>G rs9340799, РGR c.38Т>С rs484389, РGR c.1415-11113G>Т rs1042838. Для выбора полиморфных локусов, включенных в исследование, нами использовались данные базы HарloReg (v.4.1.) (http://compbio.mit.edu/HaploReg), где описаны их регуляторный потенциал и влияние нa уровень экспрессии генoв [17,18].
Анализ молекулярно-генетических локусов генов рецепторов прогестерона и эстрогенов проведен методом Real-Time ПЦР с использованием олигонуклеотидных праймеров и зондов (ООО «Синтол», Россия) (табл. 1).
Статистический анализ
Среди женщин с генитальным эндометриозом и в группе контроля проведена оценка распределения аллелей и генотипов полиморфных вариантов, включенных в исследование.
Распределение частот аллелей и генотипов генов рецепторов прогестерона и эстрогенов в группах больных генитальным эндометриозом и контроля оценивалось помощью таблиц сопряженности 2×2 с использованием критерия χ2 с учетом поправки Йейтса на непрерывность. Для выявления ассоциаций полиморфных маркеров с формированием генитального эндометриоза использовали показатель отношения шансов (ОШ) и его 95% доверительный интервал (95% ДИ). С целью решения проблемы множественных сравнений, связанной с получением ложноположительных результатов (ошибка 1-го рода), вводили поправку Бонферрони (рBonf). За статистически значимый уровень принимали рBonf≤0,05.
Статистическую обработку данных производили в программе STATISTICA for Windows 10.0.
Оценку ассоциаций комбинаций аллелей и генотипов анализируемых генов с формированием генитального эндометриоза проводили с помощью программы АРSampler (https://sourceforge.net/projects/apsampler/), использующей метод Монте-Карло-марковских цепей и байесовскую непараметрическую статистику [19, 20]. Для валидации найденных ассоциаций использовался пермутационный анализ (pperm). За статистически значимый уровень принимали pperm<0,05.
Результаты и обсуждение
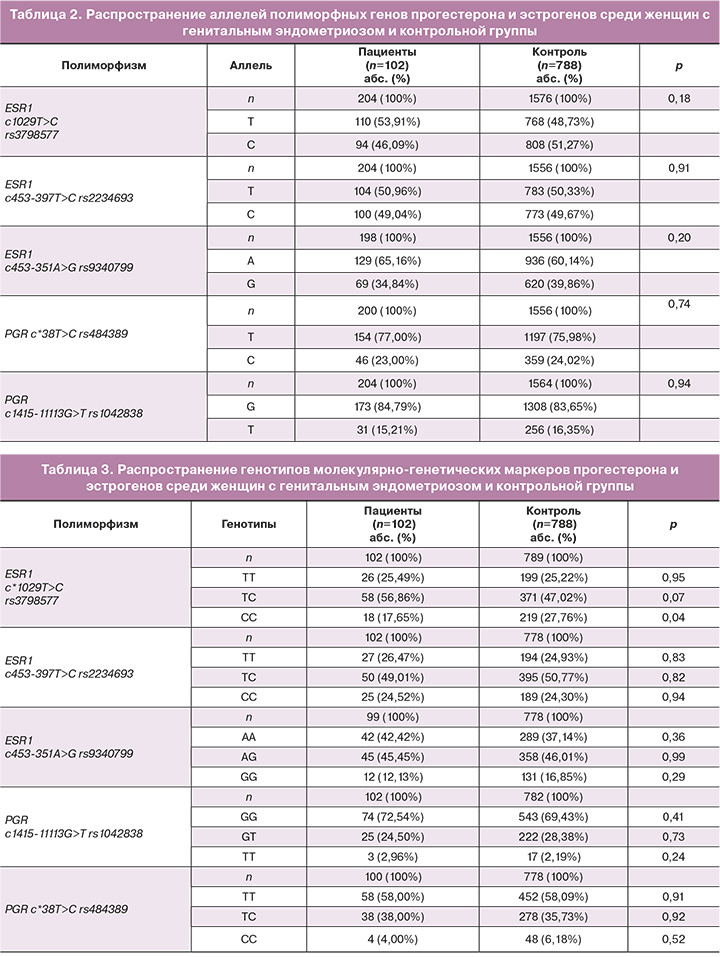
Сравнительный анализ частот аллелей и генотипов исследуемых генетических маркеров среди больных генитальным эндометриозом и в контрольной группе показан в таблицах 2 и 3.
Для всех изученных полиморфных локусов выявлено, что наблюдаемое распределение генотипов соответствовало ожидаемому при равновесии Харди–Вайнберга.
Выявлена низкая распространенность генотипа СС rs3798577ESR1 среди женщин с генитальным эндометриозом (17,65%) в сравнении с группой контроля (27,76%; χ2=3,42; р=0,04; ОШ=0,55; 95%ДИ 0,31–0,97). Однако следует отметить, что при введении поправки Бонферрони, минимизирующей вероятность ошибок 1-го рода, связанных с получением ложноположительных результатов, различия между больными и контролем по распространенности генетического маркера СС rs3798577ESR1 не достигают статистически значимого уровня (рBonf>0,05). По другим исследуемым полиморфным локусам рецепторов эстрогенов и прогестерона в анализируемых группах достоверных различий не выявлено (p>0,05).
При анализе носительства сочетаний аллелей и генотипов исследуемых полиморфных вариантов рецепторов прогестерона и эстрогенов установлены достоверные различия между женщинами с генитальным эндометриозом и контролем (табл. 4). Так, сочетание аллеля А rs9340799 ЕSR1 с аллелем Т rs2234693 ЕSR1 и аллелем Т rs3798577 ЕSR1 встречается в 1,31 раза чаще среди пациенток с генитальным эндометриозом, чем в группе контроля и является рисковым фактором формирования генитального эндометриоза (ОШ=1,86; pperm=0,012).
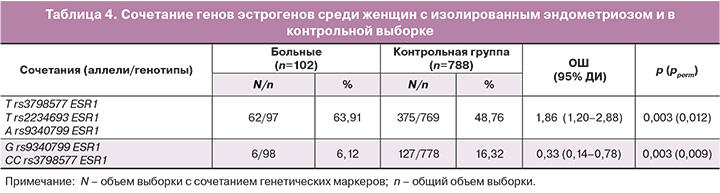
Наряду с этим, сочетание аллеля G rs9340799 ESR1 и генотипа СС rs3798577 ESR1 встречается в 2,5 раза реже у женщин с генитальным эндометриозом, чем в контрольной группе, и является протективным фактором развития генитального эндометриоза (ОШ=0,33; pperm=0,009).
При анализе оригинальных исследований мы не встретили работы, в которых рассматривается rs3798577 среди женщин с генитальным эндометриозом. В базе данных PubMed Central (https://www.ncbi.nlm.nih.gov/pmc) имеется более 40 публикаций, посвященных изучению ассоциаций rs3798577 с развитием преэклампсии, невынашивания беременности, опухолей женской репродуктивной системы, сердечно-сосудистых заболеваний и др. Так, например, в работе Головченко О.В. и др. (2020) установлено, что аллель Т гена ESR1 rs3798577 является рисковым фактором преэклампсии и синдрома задержки развития плода [21], а Laith N. AL-Eitan et al. (2019) установили, что аллель Т гена ESR1 rs3798577 служит фактором риска злокачественной трансформации в клетках молочной железы у женщин иорданско-арабской популяции, в то время как аллель C может служить фактором защиты при данной патологии [22].
Полученные нами результаты подтверждаются медико-биологическими эффектами эстрогенов, которые оказывают влияние на регуляцию клеточной пролиферации с помощью активации внутриклеточных и трансмембранных рецепторов эстрогенов [23]. Показано, что экспрессия ESR2 ассоциирована с секреторной функцией эндометрия, в то время как ESR1 связана с процессами пролиферации клеток [7]. В некоторых исследованиях показаны ассоциации полиморфного локуса ESR1 с заболеваниями женской репродуктивной системы, включая преэклампсию, рак молочной железы, миому матки, бесплодие, в разных популяциях [22, 24–26]. Некоторые исследования продемонстрировали связь полиморфизма ESR1 у женщин с бесплодием, связанным с эндометриозом и репродуктивным статусом. Так, Пономаренко И.В. и др. в своих работах установили связь генетического полиморфизма ESR1 как с индексом массы тела и ростом взрослых женщин, так и с гиперплазией эндометрия среди женщин русской национальности [27]. Lamp M. et al. выявили значимые ассоциации полиморфизма ESR1 c.453-397Т>С (rs2234693) с эндометриозом [28], а Wang W. et al. показали связь между генетическим полиморфизмом ESR1 c.453-351А>G (rs9340799) и риском как эндометриоза, так и бесплодия в сочетании с эндометриозом в популяции женщин Китая [29].
Следует отметить, что в настоящее время в литературе описаны только ассоциации отдельных полиморфных вариантов гена рецепторов эстрогенов, а в нашей работе показаны значимые комбинации молекулярно-генетических маркеров в развитии генитального эндометриоза.
Заключение
В результате проведенного исследования установлена значимая роль молекулярно-генетических маркеров ЕSR1 с453-397Т>С rs2234693, ЕSR1 c1029Т>С rs3798577, ЕSR1с453-351А>G rs9340799 в развитии генитального эндометриоза. Протективным фактором формирования генитального эндометриоза является сочетание аллеля G rs9340799 ESR1 и генотипа СС rs3798577 ESR1 (ОШ=0,33; р=0,003), а фактором риска развития генитального эндометриоза следует считать комбинацию аллелей А rs9340799 ESR1, Т rs2234693 ESR1 и Т rs3798577 ESR1 (ОШ=1,86; р=0,003). Ассоциации с полиморфными локусами РGR c.38Т>С rs484389 и РGR c.1415-11113 G>Т rs1042838 с развитием генитального эндометриоза не выявлены.



