Главным показателем эффективности экстракорпорального оплодотворения (ЭКО) является критерий «take-home baby» (отношение числа рожденных и выживших детей к числу процедур переноса эмбрионов) [1]. Система гемостаза и фибринолиза играет ключевую роль в формировании синдрома общей циркуляторной адаптации организма женщины к беременности и родам [2]. На фоне приобретенных или генетических аномалий системы гемостаза (тромбофилии, тромбоцитопатии, коагулопатии) физиологическая активация процессов коагуляции и системного воспалительного ответа при беременности может приводить к декомпенсации равновесия гемостатического потенциала (ГП), тем самым провоцируя развитие акушерских осложнений [3–5].
Клиническое наблюдение
Пациентка Т., 32 лет, обратилась в июле 2016 г. с жалобой на повторяющиеся самопроизвольные выкидыши на фоне геморрагического синдрома. Индекс массы тела – 23 кг/м2. В анамнезе: геморрагический синдром на фоне легкой травматизации. С двух лет – обильные носовые кровотечения, в подростковом возрасте – ювенильное маточное кровотечение. Дисменорея с менархе, менструации обильные, 5 дней, в среднем через 40 дней. Беременность планирует с 24 лет. При обследовании маточные трубы проходимы, гистосовместимость супругов по системе HLA отсутствует, сбалансированных хромосомных перестроек не выявлено. Мужской фактор бесплодия исключен. По данным ультразвукового исследования на 5, 7 и 12-й дни менструального цикла определяются фолликулы 4–5 мм до 10 в срезе, диффузно.
Выставлен диагноз: Ановуляторное бесплодие, мультифолликулярные яичники. Проводилось 20 попыток гормональной стимуляции («Гонал-Ф» 75 МЕ; «Пурегон» 150 МЕ); беременность наступала дважды. На сроках 5–7 недель открывалось кровотечение на фоне приема низкомолекулярного гепарина (НМГ), назначаемого для коррекции повышенного уровня D-димера (в среднем в 2 раза превышающего нормальные значения, 0,98 мкг/мл). В протоколы ЭКО вступала десятикратно. Беременности прерывались на ранних сроках по типу самопроизвольных выкидышей на фоне геморрагического синдрома. По результатам обследования в Алтайском гематологическом центре в 2014 г.: гипергомоцистеинемия и антифосфолипидный синдром не выявлены. Определены полиморфизмы в генах тромбоцитарных рецепторов, фибриногена, гликопротеина IIb/IIIa, фибринолиза, обмена фолатов. Агрегационная функция тромбоцитов снижена на аденозиндифосфат (АДФ) и адреналин. Таким образом, клинический диагноз: Тромбоцитопатия. Носитель гетерозиготных полиморфизмов тромбофилии: ITGB3, ITGА2, PAI-1, MTHFR. Варикозная болезнь вен нижних конечностей. Хроническая венозная недостаточность 0 ст. Синдром вегетативной дисфункции.
Исходя из того, что носительство полиморфизма генов способно вызывать коагулопатию во время беременности, а в сочетании с тромбоцитопатией может стать причиной многих осложнений [5, 6], спланировали ведение предстоящей беременности под динамическим мониторингом ГП с помощью низкочастотной тромбоэластограммы (НПТЭГ). Благодаря НПТЭГ возможно получить комплексную оценку показателей гемокоагуляции и фибринолиза цельной крови в режиме реального времени [7, 8]. Динамический контроль за состоянием сосудисто-тромбоцитарного, коагуляционного и фибринолитического звеньев системы регуляции агрегатного состояния крови позволяет осуществлять адекватный выбор доз антиагрегантов/ангиопротекторов, про-/антикоагулянтов, активаторов/ингибиторов фибринолиза [9] по принципу «2П+2Д». Принцип подразумевает сочетание Препаратов, их Дозы, Дискретность и Продолжительность назначения и обеспечивает возможность выбора индивидуального алгоритма терапии. После подписания пациенткой добровольного информированного согласия оценка состояния ГП цельной крови производилась на пьезотромбоэластографе НПТЭГ АРП-01М «Меднорд» (ФРС №2010/09767). Эффекты ангиопротекторов («Этамзилат», «Вессел Дуэ Ф»), антикоагулянта («Вессел Дуэ Ф») и активатора/ингибитора фибринолиза («Транексам»/«Вессел Дуэ Ф») оценивались под мониторингом ГП за два цикла до вступления в протокол ЭКО.
В естественном менструальном цикле [10] у пациентки была выявлена гипокоагуляция за счет выраженного снижения адгезивно-агрегационной активности форменных элементов крови в фолликулярную и лютеиновую фазы цикла (сдвиг кривой НПТЭГ «вправо и вниз»). В период овуляции наблюдалась гиперкоагуляция на протеолитическом и полимеризационном этапах фибриногенеза с компенсаторной активацией фибринолиза (интенсивность ретракции и лизиса сгустка (ИРЛС) – 3,07) (рис. 1).
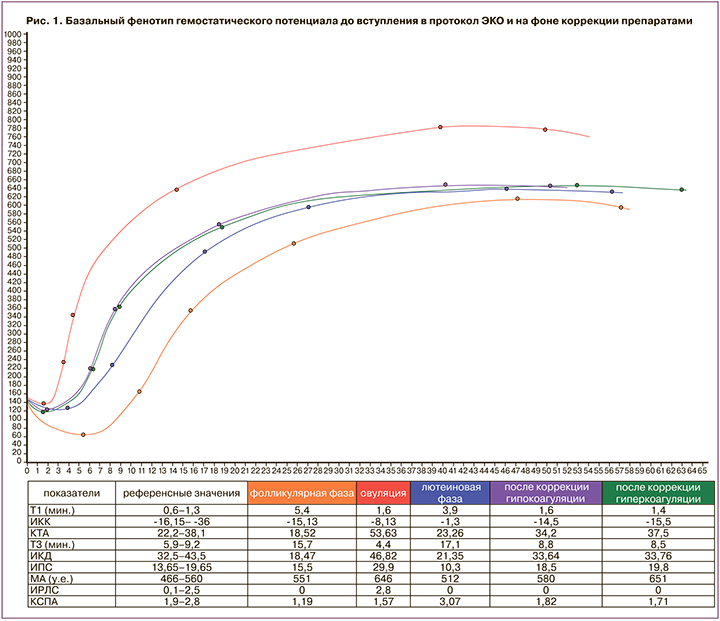
Под динамическим контролем НПТЭГ для коррекции гипокоагуляции на начальном этапе фибриногенеза был назначен «Этамзилат» (Луганский ХФЗ, Украина) (250–500 мг 3 раза в день); для угнетения усиленной фибринолитической активности – «Транексам» (STADA, Россия) (500 мг 1 раз в сутки). Витаминно-минеральные комплексы – «Фемибион Наталкер» I, II (MERCK KGaA & Co. Werk Spittal, Австрия) подбирались исходя из клинических протоколов. Коррекция гиперкоагуляционного состояния у данной пациентки, по нашему мнению, не должна была проводиться рутинно с применением лишь НМГ, а основываться на персонифицированном мониторинге НПТЭГ с применением «Вессел Дуэ Ф» (сулодексид) («Альфасигма С.п.А.», Италия), так как препарат рекомендован пациентам с тромбофилией и антифосфолипидным синдромом [11, 12]. А механизм действия сулодексида обусловлен двумя составляющими: гепариноподобная фракция (80%) обладает сродством к антитромбину III и дерматансульфатная (20%) – к кофактору II гепарина. «Вессел Дуэ Ф» оказывает ангиопротекторное, профибринолитическое, антикоагулянтное, антитромботическое и ангиопротекторное действие. Гепариноподобная фракция сулодексида оказывает деликатное влияние на все звенья системы гемостаза, обеспечивая комплексный антикоагулянтный эффект без резких скачков активности в течение суток, тем самым создавая высокий профиль безопасности. Фракция дерматана сульфата, благодаря высокой степени связывания с гепариновым кофактором II, обеспечивает локальное антикоагулянтное действие в зоне формирующегося тромба. Лекарственное средство обеспечивает выраженный ангиопротекторный эффект за счет его способности восстанавливать гликокаликс эндотелия и тем самым повышать антитромботический потенциал эндотелиальных клеток, увеличивая резистентность последних к воздействию гомоцистеина, медиаторов воспаления и лейкоцитарных протеаз, ингибировать адгезию клеток крови в случае повреждения эндотелия [11, 13, 14]. Режим применения препарата выгодно отличается от НМГ. «Вессел Дуэ Ф» эффективен при приеме внутрь, имеет длительный период полувыведения. Для коррекции гиперкоагуляции у пациентки «Вессел Дуэ Ф» применялся по 1 капсуле (250 ЛЕ) 2 раза в день.
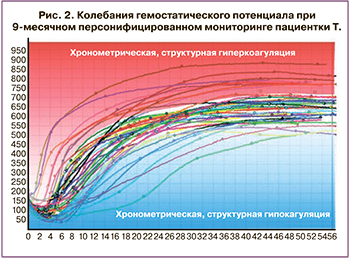 В сентябре 2016 г. при стимуляции суперовуляции яичников в программе ЭКО («Гонал-Ф» 150 МЕ) получено 17 ооцитов, 8 эмбрионов, 4 из них криоконсервированы. В ноябре 2016 г. пациентка вступила в криопротокол. Гормональная подготовка к переносу эмбриона включала препараты «Прогинова» (2 мг), «Дивигель» (1 мг) по индивидуальной схеме; после переноса эмбриона добавили «Метипред» (2 мг) и «Утрожестан» (200 мг). Вопреки современным представлениям о том, что гормональная терапия активирует процессы свертывания крови, у пациентки по данным НПТЭГ отмечались хронометрическая гипокоагуляция и структурная нормокоагуляция. Перенос эмбриона и его имплантация характеризовались на НПТЭГ выраженной структурной и хронометрической гиперкоагуляцией. Алгоритм ведения пациентки при вступлении в протокол ЭКО и в течение всей беременности включал еженедельный мониторинг ГП с таргетной коррекцией выявленных отклонений для достижения референтного диапазона здоровых беременных женщин соответствующего срока гестации [2]. Колебания ГП при 9-месячном персонифицированном мониторинге пациентки Т. отклонялись как в сторону гипокоагуляции, так и гиперкоагуляции (рис. 2). Структурная и хронометрическая гипокоагуляция в I и II триместре беременности регистрировалась на НПТЭГ, в том числе и на фоне алиментарных привычек беременной (маринованный лук, чеснок, кетчуп, цитрусовые фреши, применение аскорбиновой кислоты), что потребовало исключения данных продуктов из рациона. Гиперкоагуляционное отклонение ГП с активацией фибринолитической системы у пациентки наблюдалось в I и III триместрах беременности и, вероятно, было обусловлено носительством гетерозиготных полиморфизмов тромбофилии. В сроке 39–40 недель беременности пациентка Т. была родоразрешена путем операции кесарева сечения в плановом порядке. Интраоперационная кровопотеря составила 600 мл. Родилась девочка массой 3240 г, длиной 54 см, с оценкой по Апгар 8/9 баллов. Ранний адаптационный период протекал без особенностей. Послеродовой период – без осложнений. Выписаны на 5-е сутки послеродового периода. Сейчас девочке 3 года, показатели соматического и нейропсихического развития соответствуют норме. Проводился мониторинг ГП в течение 6 месяцев после родов с назначением «Вессел Дуэ Ф».
В сентябре 2016 г. при стимуляции суперовуляции яичников в программе ЭКО («Гонал-Ф» 150 МЕ) получено 17 ооцитов, 8 эмбрионов, 4 из них криоконсервированы. В ноябре 2016 г. пациентка вступила в криопротокол. Гормональная подготовка к переносу эмбриона включала препараты «Прогинова» (2 мг), «Дивигель» (1 мг) по индивидуальной схеме; после переноса эмбриона добавили «Метипред» (2 мг) и «Утрожестан» (200 мг). Вопреки современным представлениям о том, что гормональная терапия активирует процессы свертывания крови, у пациентки по данным НПТЭГ отмечались хронометрическая гипокоагуляция и структурная нормокоагуляция. Перенос эмбриона и его имплантация характеризовались на НПТЭГ выраженной структурной и хронометрической гиперкоагуляцией. Алгоритм ведения пациентки при вступлении в протокол ЭКО и в течение всей беременности включал еженедельный мониторинг ГП с таргетной коррекцией выявленных отклонений для достижения референтного диапазона здоровых беременных женщин соответствующего срока гестации [2]. Колебания ГП при 9-месячном персонифицированном мониторинге пациентки Т. отклонялись как в сторону гипокоагуляции, так и гиперкоагуляции (рис. 2). Структурная и хронометрическая гипокоагуляция в I и II триместре беременности регистрировалась на НПТЭГ, в том числе и на фоне алиментарных привычек беременной (маринованный лук, чеснок, кетчуп, цитрусовые фреши, применение аскорбиновой кислоты), что потребовало исключения данных продуктов из рациона. Гиперкоагуляционное отклонение ГП с активацией фибринолитической системы у пациентки наблюдалось в I и III триместрах беременности и, вероятно, было обусловлено носительством гетерозиготных полиморфизмов тромбофилии. В сроке 39–40 недель беременности пациентка Т. была родоразрешена путем операции кесарева сечения в плановом порядке. Интраоперационная кровопотеря составила 600 мл. Родилась девочка массой 3240 г, длиной 54 см, с оценкой по Апгар 8/9 баллов. Ранний адаптационный период протекал без особенностей. Послеродовой период – без осложнений. Выписаны на 5-е сутки послеродового периода. Сейчас девочке 3 года, показатели соматического и нейропсихического развития соответствуют норме. Проводился мониторинг ГП в течение 6 месяцев после родов с назначением «Вессел Дуэ Ф».
Заключение
Следовательно, благодаря персонифицированному мониторингу ГП пациентки Т. методом НПТЭГ нам удалось подобрать и контролировать таргетную терапию по принципу «2П+2Д» и сохранить беременность. Таким образом, обоснована необходимость персонифицированной оценки ГП на АРП-01М «Меднорд» с целью оценки расстройств системы гемостаза. Коррекция выявленных расстройств назначением таргетной терапии и контроль ее эффективности по принципу «2П+2Д» привели к увеличению показателя «take-home baby».



