Глубокий эндометриоз (ГЭ) является наиболее тяжелой формой заболевания, которой страдают примерно 5–12% женщин с эндометриозом. Единственным действенным методом лечения пациенток с ГЭ является хирургический, с оптимальным удалением эндометриоидных инфильтратов, способствующий облегчению болевого синдрома и улучшающий качество жизни таких больных. Однако, по данным различных авторов, после комплексного лечения, которое включает хирургическое лечение и гормональную супрессию, рецидив эндометриоза достигает 60% [1–5]. Учитывая тот факт, что рецидив является ведущей проблемой заболевания, необходимо выявить ранние маркеры ГЭ и возможные факторы риска рецидива эндометриоза.
В настоящее время ведется активный поиск факторов риска рецидива эндометриоза. Так, Busacca M. et al. (2006) и Biacchiardi C.P. et al. (2011) в своих исследованиях выделили следующие основные факторы: молодой возраст пациентки на момент оперативного лечения, индекс массы тела, отсутствие радикальности при оперативном вмешательстве, бесплодие. Молодой возраст пациенток как фактор риска рецидива эндометриоза, скорее всего, связан с высокой концентрацией эстрадиола в крови, так как эстрадиол опосредованно влияет на рост эндометриоидных имплантов [6, 7]. Другие авторы утверждают, что частоту рецидивов скорее обуславливает агрессивность эндометриоза, нежели радикальность оперативного вмешательства [8]. Козаченко А.В. и соавт. (2018) считают, что факторами риска рецидива эндометриоза являются: интенсивные ациклические тазовые боли, наличие оперативных вмешательств в анамнезе по поводу наружного генитального эндометриоза, бесплодие, стимуляция овуляции гормональными препаратами в рамках проведения вспомогательных репродуктивных технологий, III–IV степень распространенности заболевания, выраженный спаечный процесс в малом тазу, ГЭ, большие размеры эндометриоидных кист и/или двусторонние поражения яичников [9].
На сегодняшний день основной причиной запущенных форм эндометриоза является задержка диагностики в связи с отсутствием специфических симптомов и молекулярно-биологических маркеров диагностики.
В качестве перспективного метода ранней и минимально инвазивной диагностики эндометриоза, в том числе глубоких его форм, рассматривается анализ эндометрия; однако в настоящее время ни один из подходящих анализов слизистой тела матки не может быть рекомендован для внедрения в клиническую практику [10].
Учитывая наличие некоторых схожих черт в развитии ГЭ и злокачественных опухолей, многие маркеры, используемые сегодня в качестве биомаркеров злокачественных клеток, могут проявить себя аналогично и при эндометриозе. В этом отношении особый интерес представляют эфриновые рецепторы (Eph), принадлежащие к крупнейшему семейству рецепторных тирозинкиназ. Открытие новой системы Eph/ephrin [11], регулирующей как физиологические, так и патологические процессы, привело к инициации целого ряда исследований, в ходе которых было показано, что большинство рецепторов Eph регулируют процессы прогрессирования опухоли и могут служить маркерами прогноза выживаемости, а также мишенью для патогенетической терапии [12, 13]. Данные рецепторы активизируются путем связывания с соответствующими лигандами эфрина, прикрепленными к мембране [14].
Так, например, рецепторы EphA1 и EphA2 экспрессируются в злокачественных клетках, выявлена корреляционная зависимость прогноза выживаемости от уровня экспрессии рецепторов EphA1 и EphA2 [15].
Муфтайдинова Ш.К. и соавт. (2021) исследовали активность рецепторов EphA1, EphA2 и EphA3 в эктопических очагах эндометрия в различных фазах менструального цикла. В них была обнаружена аномально повышенная экспрессия эфриновых рецепторов, особенно в секреторную фазу менструального цикла, при различных формах эндометриоза. При поверхностном эндометриозе экспрессия EphA1 в эутопическом и эктопическом эндометрии не отличается от экспрессии в нормальном эндометрии. При ГЭ EphA1, наоборот, экспрессируется в эутопическом и эктопическом эндометрии во всех фазах менструального цикла; показатель экспрессии статистически значимо не отличается от такового при аденокарциноме [16].
Несмотря на проводимые фундаментальные исследования и достигнутые результаты, в настоящее время отсутствуют четкие представления о механизмах развития и регуляции патологического процесса при эндометриозе, в связи с чем эффективность как медикаментозного, так и хирургического лечения ГЭ остается низкой [17]. На основе изучения молекулярных аспектов патогенеза эндометриоза продолжается поиск новых способов его диагностики и лечения [18].
Рецепторы Eph при дальнейшем изучении, возможно, станут ведущими маркерами инфильтративных форм эндометриоза, что подтверждает актуальность изучаемой проблемы. Эндометриоз, обычно проявляющийся как хроническое воспалительное заболевание, характеризуется сложной системой активации и ингибирования многочисленных факторов, приводящих к нарушенной регуляции апоптоза, иммунной системы, ангиогенеза, пролиферации клеток [19]. В связи с чем исследование маркеров указанных процессов также представляет особый интерес, в частности, bcl-2, Caspase3, VEGF.
Цель исследования: оценить индивидуальные факторы риска рецидива ГЭ на основании полученных клинико-анамнестических и молекулярно-биологических данных и разработать формулу индивидуального риска рецидива ГЭ.
Материалы и методы
Проведен анализ 200 историй болезни пациенток с ГЭ, проходивших хирургическое лечение на базе отделения общей хирургии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в период с 2020 по 2021 гг. 1-ю группу исследования составили 80 пациенток с рецидивом ГЭ, 2-ю – 120 пациенток с впервые выявленным ГЭ. В группу сравнения были включены 40 женщин с трубно-перитонеальным фактором бесплодия. Средний возраст пациенток составил 35,6±5,64 года и значимо не различался между исследуемыми группами. Диагноз ГЭ выставлен на основании лечебно-диагностической лапароскопии и подтвержден гистологическим исследованием. Проведено углубленное изучение клинико-анамнестических данных пациенток (возраст, продолжительность заболевания, хирургический анамнез, характер менструальной функции и т.д.). Особое внимание было уделено 1-й группе, где проведен углубленный анализ ранее проведенных оперативных вмешательств по поводу эндометриоза, анализировались объем операции, длительность послеоперационной гормональной терапии, межрецидивный интервал.
Во время хирургического лечения получены образцы эутопического и эктопического эндометрия (колоректальный инфильтрат); в последующем образцы подверглись иммуногистохимическому (ИГХ) исследованию рецепторов EphA1, EphA4 и EphВ4, белков VEGF, Bcl-2, Caspase3.
На первом этапе ИГХ-исследования проводилось гистологическое исследование. Оценивался макропрепарат, который фиксировался в 10% растворе формалина в течение 24 ч, далее готовили парафиновые блоки и при помощи микротома изготавливали срезы толщиной 4–5 мкм. Далее препарат исследовался на световом микроскопе при увеличении от 50 до 400. ИГХ-исследование эндометрия и эндометриоидных очагов в стенке кишки проводилось с созданием тканевых матриц при помощи набора сTissue-Tek Quick-Ray. Далее срезы окрашивали для оценки экспрессии рецепторов EphA1, EphA4, EphB4, белков VEGF, Bcl-2, Caspase3.
Для правильной подготовки ИГХ-реакции ставили положительный и отрицательные контроли; в качестве отрицательных контролей использовали образцы срезов, которые подвергали стандартной процедуре ИГХ-реакции, но без добавления первичных антител. После проведения ИГХ-реакции срезы дополнительно контрастировали гематоксилином и заключали в синтетическую среду Shandon mount TM. Далее все образцы оценивались при помощи шкалы Quick-score (Q-score). Результат окрашивания оценивался путем умножения процента положительно окрашенных клеток (Р) на интенсивность окрашивания (I) (Q=P×I), максимально 300 у.е. [20].
Статистический анализ
Статистическая обработка и анализ данных пациенток проведены при помощи программ MS Office Excel и GraphPad Prism 9.0.0.121 (CША). На первом этапе проведен тест на нормальность распределения данных. Учитывая, что в нашем исследовании группы имели распределение, отличное от нормального, мы использовали методы непараметрической статистики, анализ данных проводился с помощью теста Манна–Уитни, описание количественных данных представили в виде медианы (Me) с межквартильным размахом (Q1; Q3). Различия между группами считались статистически значимыми при p<0,05. В последующем был выполнен многофакторный логистический регрессионный анализ; в пошаговом режиме из совокупности клинических и ИГХ-данных были выделены возможные предикторы развития рецидива эндометриоза; на втором этапе проведен анализ бинарной регрессии. В результате многофакторного анализа разработана окончательная формула оценки риска рецидива ГЭ. В процессе создания математической модели использовалось уравнение регрессии:
y=a+b1*x1+ b2*x2+…+ bn*xn,
где y – зависимая переменная, принимающая два значения: 0 – нет рецидива ГЭ, 1 – есть рецидив ГЭ; a – константа; bn – коэффициенты регрессии; xn – независимые переменные.
Расчет вероятности диагностики рецидива эндометриоза проводился по формуле бинарной регрессии:
p=1/1+e-у
где р – прогностическая вероятность; е – экспонента, приближенное значение которой равно 2,72.
Логистическая регрессия позволит прогнозировать вероятность наступления события (рецидива ГЭ) в зависимости от значений имеющихся предикторов (факторов).
Результаты
На первом этапе исследования выполнен углубленный анализ клинико-анамнестических данных пациенток в группах исследования; результаты исследования были внесены в таблицу MS Office Excel.
Средний возраст женщин с рецидивом ГЭ составил 35 (32; 39) лет, без рецидива ГЭ – 36 (32;40) лет; возраст женщин значимо не различался между группами исследований (р=0,09). На момент выполнения первой операции пациентки с рецидивом ГЭ были значимо моложе, в отличие от аналогичного периода жизни женщин второй группы (28 (25,75; 32) лет против 36 (32;40) лет соответственно, р<0,0001), что, возможно, является важным фактором в развитии рецидива эндометриоза.
Учитывая данные литературы [21, 22] о снижении массы тела у пациенток с эндометриозом, в отличие от женщин с его отсутствием, нами проанализированы массо-ростовые показатели в группах исследования. Анализ не выявил значимых различий в средних параметрах роста, массы и, соответственно, индекса массы тела у пациенток с колоректальным эндометриозом по сравнению с женщинами без эндометриоза (p>0,05). При углубленном изучении отмечено, что у пациенток с рецидивом ГЭ значимо чаще встречался дефицит массы тела по сравнению с женщинами с впервые выявленным заболеванием (16,3% против 3,3% соответственно, р=0,0032).
Согласно плану исследования, проведено сравнение менструальной функции. Выявлено, что дисменорея встречалась значимо чаще в 1-й группе пациенток по сравнению со 2-й группой (91% против 69% соответственно, р=0,0002). Других значимых различий не было выявлено.
Известно, что аменорея является благоприятным фактором для течения эндометриоза. В данном направлении ведутся активные поиски [23, 24]. В нашем исследовании не выявлено значимых различий в паритете женщин между группами исследования. Частота бесплодия в группах исследования встречается практически с одинаковой процентной частотой и не имеет значимых статистических различий (46,2% против 58,3%, р=0,093). Но у пациенток с рецидивом ГЭ длительность бесплодия встречалась значимо чаще, чем в группе с первичным ГЭ (5 (3; 7) лет против 3 (2; 4) лет соответственно, р=0,0001) (табл. 1).
Пациентки, поступившие на оперативное лечение по поводу рецидива заболевания, имели в анамнезе различный объем предшествующих оперативных вмешательств по поводу различных форм ГЭ. При детальном изучении выявлено, что в основном у пациенток было одно оперативное вмешательство в анамнезе, а у каждой третьей – 2 и более. У большинства женщин (71,2%) было выполнено иссечение очагов эндометриоза брюшины малого таза, и у всех (100,0%) – резекция яичников. У трети из них течение эндометриоза было более агрессивным, в связи с чем им был выполнен «шейвинг» (16,3%) или сегментарная резекция кишки (12,5%).
В группе с рецидивом эндометриоза продолжительность заболевания была более длительной по сравнению с группой пациенток с первичным ГЭ (медиана пациенток с рецидивом ГЭ 6 (4; 9;) против медианы пациенток с первичным ГЭ 2 (1; 3), р<0,05).
Повторное оперативное вмешательство (межрецидивный интервал) пациенткам было выполнено в среднем спустя 6 (4; 10) лет. Межрецидивный интервал был значимо длиннее у пациенток с более радикальным объемом операции (3 (2; 11,5) года против 1 (1; 3) года соответственно, р<0,05). У пациенток после выполненного «шейвинга» кишки межрецидивный интервал был практически в 3 раза меньше в отличие от женщин после резекции кишки (2 (1; 3) года против 3 (2; 11,5) лет соответственно, р=0,001). После проведенного оперативного лечения 81,3% пациенток получали противорецидивную гормональную терапию различными группами препаратов: диеногест 2 мг – 57,5%; агонисты гонадотропин-рилизинг-гормона – 17,5%; комбинированные оральные контрацептивы – 20%; внутриматочные системы с левоноргестрелом – 2,5%; в среднем длительность противорецидивной терапии составляла 9 (6; 12) месяцев. При анализе влияния гормональной терапии и продолжительности безрецидивного промежутка не выявлено значимых различий между группами препаратов и длительности безрецидивного интервала. Таким образом, мы можем сделать вывод, что чем радикальнее оперативное вмешательство, тем продолжительнее межрецидивный интервал.
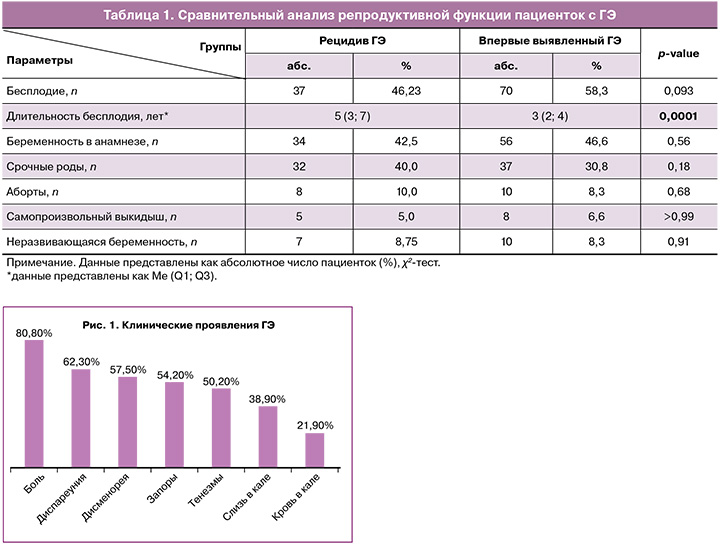
Основными клиническими проявлениями колоректального эндометриоза были боли внизу живота (80,8%), диспареуния (62,3%), дисменорея (57,5%) кишечные симптомы (слизь в кале (38,9%), кровь в кале (21,9%), тенезмы (50,2%), запоры (54,2%)) перед или в первые дни менструации (рис. 1). Время от момента появления клинической картины до оперативного вмешательства (продолжительность заболевания) составило в среднем 4 (2; 7) года и было значимо продолжительнее у пациенток с рецидивом заболевания (6 (4; 10) лет и 3 (2; 5) года соответственно, р<0,05).
После проведенного комплексного дообследования пациенткам выполнено оперативное лечение. По результатам ультразвукового исследования органов малого таза, магнитно-резонансной томографии колоректальный эндометриоз диагностирован всего у 20,3%; в результате колоноскопии – у 33% пациенток в исследуемых группах. Таким образом, можно прийти к выводу, что дополнительные методы диагностики недостаточно информативны в диагностике ГЭ.
В ходе проведенного оперативного вмешательства был выполнен оптимальный объем операции с иссечением очагов ретроцервикального эндометриоза (98%); ввиду массивного рубцово-спаечного процесса малого таза выполнен адгезиолизис (83,8%), в ряде случаев – сальпингэктомия (22,5%), резекция или «шейвинг» толстой кишки – в 100%. Отмечено, что резекция кишки наиболее чаще выполнялась в группе с рецидивом ГЭ, в отличие от второй группы (75% против 43,3% соответственно, р<0,0001). Также у пациенток с рецидивом заболевания значимо чаще был выполнен уретеролиз нижних отделов мочевыводящих путей (43,8 и 15,8% соответственно, р<0,0001).
Во время оперативного вмешательства у всех пациенток были получены образцы эутопического и эктопичеcкого эндометрия. Образцы подверглись ИГХ-исследованию, в результате которого изучена экспрессия в рецепторах эфрина (EphA1, EphA4, EphB4), рецепторах белка (VEGF, Bcl-2, Caspase3) в эутопическом и эктопическом эндометрии. Из всей когорты пациенток с эндометриозом для ИГХ-исследования выбраны 23 образца с рецидивом ГЭ, 29 образцов с впервые выявленным ГЭ; в качестве группы сравнения введена дополнительная группа пациенток (n=40) без эндометриоза (с трубно-перитонеальным бесплодием).
После проведения ИГХ-исследования выявлена значимо высокая экспрессия рецепторов EphA4, EphВ4, VEGF в эутопическом эндометрии женщин с ГЭ по сравнению с женщинами без эндометриоза (группа сравнения). Также отмечена значимо высокая экспрессия рецепторов EphA1, EphA4, EphВ4, VEGF в колоректальном инфильтрате у пациенток с ГЭ по сравнению с эутопическим эндометрием группы контроля.
В результате исследования мы выявили значимые различия между группой с рецидивом ГЭ и пациентками с первичным ГЭ в экспрессии рецептора эфрина EphA1 в эктопическом эндометрии, а также рецептора к белку VEGF в эктопическом и эутопическом эндометрии (рис. 2).
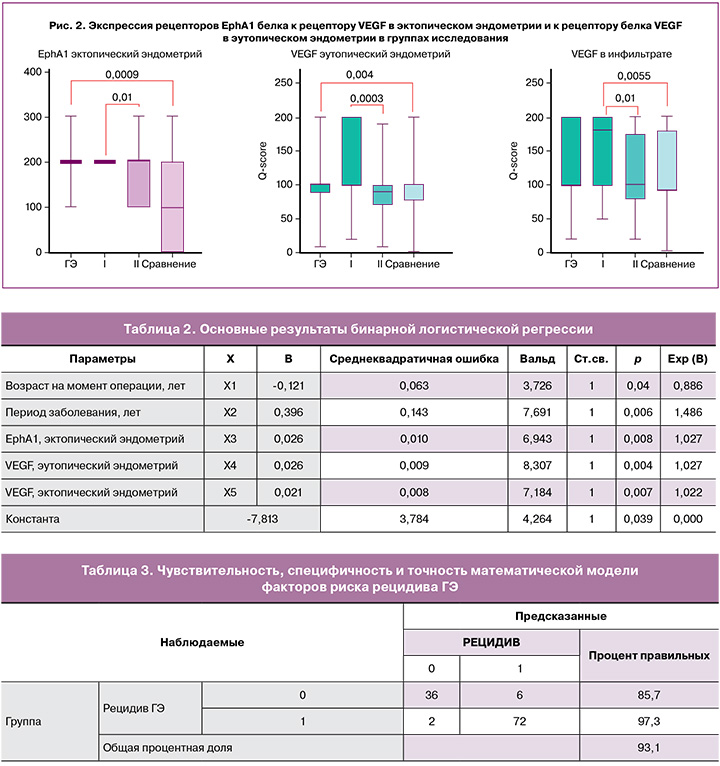
Таким образом, в возможной математической модели мы решили использовать рецепторы эфрина EphA1 в эктопическом эндометрии, рецепторы к белку VEGF в эутопическом и эктопическом эндометрии. Статистический анализ между группами исследования представлен на рисунке 2.
В результате анализа выделены 5 статистически значимых факторов риска рецидива ГЭ, которые могут влиять на развитие рецидива. Это возраст пациентки на момент первой операции, продолжительность заболевания, экспрессия в рецепторе EphA1 в эктопическом эндометрии, экспрессия в рецепторе белка VEGF в эктопическом и эктопическом эндометрии. Результаты бинарной логистической регрессии представлены в таблице 2.
В результате проведенного исследования математическая модель факторов риска рецидива ГЭ обладает чувствительностью 97,3% и специфичностью 85,7%, точность математической модели составляет 93,1% (табл. 3).
На основании полученных рассчитанных коэффициентов регрессии определялась прогностическая вероятность диагностики рецидива ГЭ по уравнению, описанному ниже:
p=1/(1+2,72-(-7,81+(-0,121)*x1+0,396*x2+0,026*х3+0,026*x4+0,021*x5))*100%,
где p – вероятность возникновения рецидива ГЭ; е – математическая константа 2,72. Точность математической модели составила 93,1%.
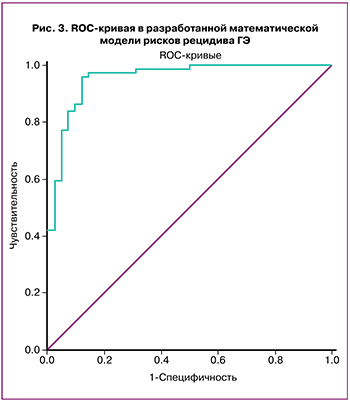
В разработанной математической модели рисков рецидива ГЭ полученные результаты были подвергнуты ROC-анализу, на основании которого построена ROC-кривая (рис. 3).
Обсуждение
По результатам некоторых исследований выделено несколько факторов риска рецидива эндометриоза: молодой возраст пациенток на момент оперативного вмешательства, возраст менархе, паритет, индекс массы тела, тяжесть заболевания, объем выполненной операции [25, 26]. Риск рецидива эндометриоза увеличивается, если поражения не полностью удалены во время оперативного вмешательства и рецидив возникает на том же месте, где ранее выполнено хирургическое лечение [27]. В нашем исследовании мы выявили, что молодой возраст пациентки на момент операции является основным фактором риска рецидива эндометриоза. В одном ретроспективном исследовании с участием 56 женщин раннего репродуктивного возраста (средний возраст составил 19,0±1,1 года) выявлен высокий процент рецидива эндометриоза у 32 пациенток (56%, 95% доверительный интервал 43–68%) в течение 5-летнего наблюдения. Исследователи отметили, что частота рецидива заболевания выше у молодых женщин по сравнению с женщинами старшего репродуктивного возраста; также отметили, что частота рецидива постоянно росла со временем от первой операции. Авторы не выявили взаимосвязи между частотой рецидивов и симптомами, стадией заболевания, послеоперационным лечением [28]. В нашем исследовании мы выявили предиктор рецидива – продолжительность заболевания; также мы выявили взаимосвязь между выполненным объемом операции и продолжительностью межрецидивного интервала – чем радикальнее выполнено оперативное вмешательство, тем ниже вероятность наступления рецидива.
Ведущую роль в прогнозировании рецидива ГЭ занимают молекулярные предикторы. Так, эфриновые рецепторы способны участвовать в таких процессах регуляции гомеостаза, как пролиферация, апоптоз, дифференцировка, клеточная адгезия и миграция клеток [29]. Рецептор EphA1 играет важнейшую роль в регуляции фолликулогенеза, транспортировке бластоцисты, а также имплантации эмбриона и формировании плаценты; данный рецептор обеспечивает инвазию трофобласта в толщу децидуализированного эндометрия [30, 31]. Экспрессия рецептора EphA1 выявлена при некоторых формах рака репродуктивной системы; так, при раке яичников и раке шейки матки выявлена значимая экспрессия рецептора EphA1 [32]. К большому сожалению, рецепторы эфрина ранее не изучались на модели с эндометриозом. Однако механизмы регуляции метаболизма клеток ГЭ схожи со злокачественными новообразованиями, в регуляции которых участвуют эфриновые рецепторы. Таким образом, мы предположили, что эфриновые рецепторы могут регулировать механизмы ангиогенеза, апоптоза, миграции, пролиферации в клетках эктопического эндометрия. В нашем исследовании мы выявили значимую экспрессию в рецепторах эфрина (EphA1, EphA4, EphВ4) и к белку рецептора VEGF, что подтверждает нашу гипотезу о схожести патологических механизмов эндометриоза и рака [33]. В зарубежной литературе мы не обнаружили публикаций о связи между рецидивом ГЭ и рецепторами эфрина. Однако в нашем исследовании мы получили сверхэкспрессию в рецепторе EphA1 в эктопическом эндометрии в группе пациенток с рецидивом ГЭ в сравнении с группой пациенток с первичным ГЭ. Таким образом, EphA1 может быть использован в качестве маркера ранней диагностики рецидива ГЭ.
Оптимальным методом лечения эндометриоза является хирургическое лечение. В нашем исследовании продолжительность межрецидивного интервала в среднем составила 48 (24; 72) месяцев. Межрецидивный интервал был значимо длительнее у пациенток с более радикальным объемом операции (3 (2; 11,5) года против 1 (1; 3) года соответственно, р<0,05). У пациенток после выполненного «шейвинга» кишки межрецидивный интервал был практически в 3 раза меньше в отличие от женщин после резекции кишки (2 (1; 3) года против 3 (2; 11,5) лет соответственно, р=0,001). Таким образом, иссечение всех видимых эндометриоидных очагов снижает риски рецидива эндометриоза.
Заключение
На основании полученных данных с применением бинарной логистической регрессии разработана математическая модель, которая обладает высокой чувствительностью и специфичностью. В дальнейшем необходима валидация представленной модели с целью определения возможных рисков развития рецидива эндометриоза, что может быть полезным в работе врача акушера-гинеколога.



