Неходжкинские лимфомы (НХЛ) – гетерогенная группа злокачественных новообразований, происходящих из 2 типов лимфоцитов (B- и T-лимфоциты) на разных стадиях дифференцировки [1]. Чаще всего опухоль возникает и/или диагностируется в лимфоидных тканях (лимфатические узлы, селезенка, костный мозг). Наиболее часто встречаемые экстранодальные опухоли локализованы в коже, желудочно-кишечном тракте и в центральной нервной системе [2].
Лимфома Ходжкина представляет собой В-клеточную лимфому с выраженным реактивным полиморфноклеточным окружением (клетки Ходжкина, Березовского–Штернберга, лакунарные, мумифицированные, LP-клетки), характеризующимся единым иммунофенотипом (CD-30, CD-15, PAX-5). Часто клетки опухоли содержат вирус Эпштейна–Барр (ВЭБ). Все остальные виды лимфопролиферативных заболеваний (до 90%) объединяются в общую группу неходжкинских лимфом (НХЛ). Среди возможных этиологических факторов упоминаются не только ВЭБ, но и другие инфекционные агенты, а также травматические воздействия, генетические и аутоиммунные заболевания; самым доказанным фактором развития патологического процесса является иммуносупрессия.
Группа гемобластозов является первой по частоте среди онкологических заболеваний у пациентов до 30 лет. По данным Российского центра информационных технологий и эпидемиологических исследований в области онкологии за 2019 г., НХЛ в 11,64% случаев диагностируются в возрасте от 20 до 35 лет, лимфогранулематоз – в 26,92% случаев [3]. Темпы заболеваемости НХЛ растут – прирост заболеваемости за последние 10 лет составил 13,32%.
Характер заболевания при разных формах НХЛ может варьироваться от индолентного течения (вялотекущий, неагрессивный процесс) при фолликулярной лимфоме до более агрессивных форм диффузной В-крупноклеточной лимфомы и лимфом Беркитта. НХЛ, в отличие от лимфомы Ходжкина, протекают в основном бессимптомно и поэтому проявляются поздно, с широко распространенным заболеванием и требуют более агрессивного лечения.
Основным методом лечения НХЛ является химиотерапия. Агрессивные лимфомы, как правило, требуют немедленного начала лечения. При этом средний возраст смерти женщин с лимфопролиферативными заболеваниями в России за 2019 г. составил 67,6 года, а статистические данные указывают на повышение эффективности лечения (прежде всего благодаря совершенствованию протоколов лечения, в том числе внедрению таргетной терапии). По данным American Cancer Society (Американского онкологического сообщества), пятилетняя выживаемость при НХЛ составляет от 65 до 84%, в зависимости от степени распространенности злокачественного процесса [4]. Эффективное лечение у пациентов женского пола обуславливает повышение частоты выживаемости, что делает актуальным вопрос о влиянии высокодозной химиотерапии на показатели овариального резерва у столь молодой когорты пациентов и о возможности реализации репродуктивной функции после лечения.
Мультидисциплинарный подход онкологов и акушеров-гинекологов к лечению онкологических заболеваний, в частности НХЛ, позволяет информировать молодых пациенток о рисках снижения овариального резерва еще до начала лечения. Возможность выбора препаратов для минимизации гонадотоксичного эффекта полихимиотерапии (ПХТ) (комбинированные оральные контрацептивы (КОК), агонисты гонадотропин-рилизинг-гормона (аГнРГ)), а также предварительная овариальная стимуляция с целью витрификации полученных ооцитов должны быть доступны еще до начала лечения онкологического заболевания [5]. Только так можно обеспечить полноценное планирование реализации репродуктивной функции после достижения ремиссии. В последнее время намечена тенденция к увеличению числа консультаций таких пациентов у акушеров-гинекологов [6], что повышает информированность женщин и позволяет им принимать взвешенное решение о мерах, направленных на сохранение фертильности [7].
Вместе с тем важнейшим и нерешенным на сегодняшний день является вопрос прогнозирования дальнейшей репродуктивной функции больных с НХЛ, прошедших химиотерапевтическое лечение. Решение этого вопроса позволило бы формировать персонифицированные программы для каждой пациентки и, несомненно, обеспечило бы реализацию репродуктивной функции заболевших молодых женщин.
В связи с этим целью настоящего исследования было провести анализ состояния менструальной и репродуктивной функции женщин, прошедших лечение НХЛ.
Материалы и методы
В исследование были включены 39 женщин с диагнозом НХЛ. Исследование было одобрено Этическим комитетом ФГБУ «НМИЦ АГиП им. В.И. Кулакова» Минздрава России.
Возраст женщин на момент постановки диагноза НХЛ составил 24 (20;27) года. Пять пациенток были моложе 18 лет, двое из них не достигли менархе. Все пациентки на момент проведения исследования находились в ремиссии. Опрос большинства пациенток с целью сбора ретроспективных данных проводился по телефону и по данным амбулаторных карт (стадия и форма НХЛ, оценка менструального статуса до и после ПХТ, применение КОК или аГнРГ во время ПХТ, режим ПХТ, акушерско-гинекологический анамнез, соматический анамнез).
В таблице представлен анализ состояния соматического здоровья пациенток до диагностики НХЛ.

Выявленные соматические патологии соответствовали наиболее часто встречающимся в популяции; их частота встречаемости не выходила за границы популяционной нормы.
При анализе гинекологического анамнеза обращает на себя внимание распространенность гормонально детерминированных патологий, таких как синдром поликистозных яичников (СПКЯ) (15,4%), миома матки (30,8%), полипы эндометрия (12,8%). Частота встречаемости других гинекологических заболеваний, таких как аденомиоз (5,1%), хронический сальпингоофорит (5,1%), кисты яичников (5,1%), хронический эндометрит (7,7%), инфекции, передающиеся половым путем (15,4%), соответствовала общепопуляционной. Среди вмешательств у пациенток были отмечены коагуляция эктопии шейки матки (41%) и резекция яичников (7,7%).
Объединяющей характеристикой большинства обследуемых женщин явились молодой возраст и априори хорошие показатели овариального резерва. До лечения длительность менструального цикла в среднем составила 28 дней, продолжительность менструации – 5 дней. Помимо упомянутых пациенток с диагностированным СПКЯ, нарушение менструального цикла по типу олигоменореи и мультифолликулярные яичники до начала ПХТ были отмечены еще у 7 женщин (17,95%).
До манифестации заболевания 74,36% пациенток не имели беременностей в анамнезе. Из 17,95% забеременевших до лечения пациенток роды хотя бы единожды были у каждой; из 13 беременностей только 2 закончились абортами и еще 2 были неразвивающимися. 10,26% обратившихся до лечения уже имели диагноз «бесплодие».
Результаты
Ретроспективная оценка тяжести НХЛ на момент постановки диагноза установила, что 1-я стадия заболевания была диагностирована у 2 пациенток (8,7%), 2-я стадия – у 9 (39,1%), 3-я стадия – у 4 (17,4%), 4-я стадия – у 8 (34,8%). Всем женщинам проводилась ПХТ в количестве от 3 до 14 курсов, одной пациентке диагноз НХЛ был поставлен во время беременности, в связи с чем ПХТ проводилась после родоразрешения. ПХТ совместно с лучевой терапией применялась у 16 из 39 женщин (41,03%), совместно с хирургическим лечением (в том числе для проведения гистологической верификации диагноза) – у 9 из 39 женщин (23,08%). Лучевая терапия на пограничную с органами малого таза область (правые паховые лимфатические узлы) проведена у 1 пациентки с диагнозом «фолликулярная лимфома».
Мы попытались провести анализ зависимости числа курсов ПХТ и состояния репродуктивной функции женщины после окончания лечения. Явной закономерности не было получено, хотя небольшое число наблюдений не позволило сделать однозначных выводов. Забеременевшие женщины проводили от 3–4 до более чем 11 курсов лечения (рис. 1). Одна пациентка, прошедшая 14 курсов ПХТ, не восстановила менструальную функцию; тем не менее единичного наблюдения недостаточно для достоверного установления зависимости.

Число курсов ПХТ (ретроспективные данные 27 женщин) составляло от 3 до 14. Медиана количества проведенных курсов – 6 (у 46,15% пациенток), 8 курсов – у 5 (30,77%). Более 11 курсов ПХТ проведено у 4 пациенток (10,26%); 3–4 курса ПХТ – у 5 (12,82%). Рецидив после 1-й линии ПХТ был зарегистрирован у 2 женщин с первичной медиастинальной В-крупноклеточной лимфомой и В-мелкоклеточной лимфомой 2-й стадии. Трансплантация гемопоэтических стволовых клеток проводилась только у одной пациентки с НХЛ.
Введение химиотерапевтических агентов проводили по разным алгоритмам, в том числе по схемам RCHOP, R-EPOCH, R-MACOP-B, mNHL-BFM-90, DHAP. Одним из наиболее распространенных режимов ПХТ T- и В-клеточных лимфом был R-CHOP, состоящий из таких компонентов, как циклофосфамид, доксорубицин, винкристин и преднизолон с добавлением ритуксимаба (моноклональное антитело, используемое при экспрессии антигена CD20+). Схемы лечения пациентов с лимфомами в подавляющем большинстве случаев подразумевают использование сразу нескольких препаратов [8], обладающих очень высокой степенью гонадотоксичности [9]: циклофосфамид, хлорамбуцил, прокарбазин, ифосфамид, препараты платины, мелфалан, дакарбазин; неалкилирующие препараты (антрациклины, блеомицин, этопозид, винкристин/винбластин, гемцитабин) обычно не указываются как обладающие высокой гонадотоксичностью [10].
Учитывая разнообразие схем ПХТ, в рамках ретроспективного анализа выделены наиболее часто используемые препараты (рис. 2).
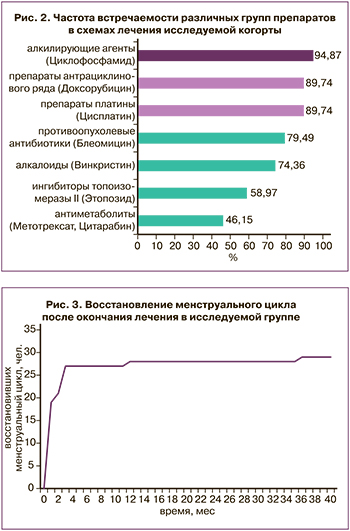
В настоящей работе среди забеременевших женщин защиту яичников во время проведения гонадотоксичного химиотерапевтического лечения применяли у 21 пациентки, 18 – препараты не назначали. Из 21 женщины 3 (14,29%) были назначены препараты аГнРГ, и 18 (85,71%) – КОК. У 32 (82,05%) больных после окончания лечения восстановился регулярный менструальный цикл. Из них 15 (46,88%) получали КОК и 3 (9,38%) – аГнРГ. У 3 женщин, получавших КОК (16,66%), после лечения наступила стойкая аменорея; в подгруппе женщин, получавших агонисты, не было отмечено аменореи ни у одной пациентки.
Период возобновления менструальной функции после окончания лечения составил в среднем 2,41 месяца. У большинства женщин (62,07%), получавших КОК в непрерывном режиме на время проведения курсов ПХТ, цикл восстановился сразу или в течение 1 месяца. Для пациенток, принимавших аГнРГ, был характерен более длинный интервал в 1–2 месяца ввиду его механизма действия. Период восстановления цикла у 6 (20,69%) женщин составил 3 месяца, у 2 (6,9%) – 2 месяца, у 1 (3,45%) – 12 месяцев, у 1 (3,45%) – 36 месяцев (рис. 3). У части женщин (34,48%) в дальнейшем отмечались эпизоды дисфункции яичников по типу олигоменореи.
После лечения длительность менструального цикла составила 29 (28;30) дней. Количество дней менструации (данные представлены для 14 женщин) составило от 3 до 7, у большинства (6 женщин – 42,9%) – 5 дней, что достоверно не отличалось от исходных данных.
На момент сбора ретроспективных данных средний возраст женщин составил 36 лет (медиана и мода 37 лет), у 7 женщин отмечено наступление преждевременной менопаузы.
Из женщин, восстановивших менструации, забеременели 82,76%. Беременность наступила самостоятельно в период от 24 до 54 месяцев после окончания ПХТ. Доля бесплодия среди пролечившихся пациенток повысилась с 10,26 до 23,07%, в том числе в 1 случае за счет трубно-перитонеального фактора (после сальпингита, возникшего как осложнение ПХТ). У 2 пациенток беременность наступила с помощью вспомогательных репродуктивных технологий.
Обсуждение
Наиболее сложной задачей явилось установление степени влияния проведенной ПХТ на репродуктивную функцию женщины. Сложность выяснения закономерностей связана как с небольшим числом наблюдений, так и с тем, что женщинам назначали разные схемы ПХТ и препараты с различающимися механизмами действия и, соответственно, влиянием на овариальную функцию.
Также отмечено назначение моноклональных антител к трансмембранному антигену CD20 (ритуксимаб) в 42,9% случаев (у 21 женщины, получавшей курсы ПХТ). На настоящий момент данные о гонадотоксичности препаратов моноклональных антител ограничены; даже вопрос о безопасности назначения ритуксимаба во время беременности остается открытым [11].
Что касается стадии заболевания, то зависимости восстановления репродуктивной функции от стадии выраженности процесса не обнаружено. Половина больных имели 1–2-ю стадии заболевания (48,72%), другая половина – 3–4-ю (51,28%).
Нерешенным является вопрос об эффективности защиты яичников на фоне проводимой ПХТ. Онкогематологи достаточно широко используют в клинической практике КОК и аГнРГ, ориентируясь на известные работы, показывающие, что десенситизация гипоталамо-гипофизарной системы и перевод яичников в «спящий» режим способны предотвратить повреждение овариального резерва и сохранить функцию яичников. Однако консолидированного мнения на этот счет не представлено [12].
Объединяющими характеристиками больных, восстановивших менструальный цикл, явились молодой возраст и априори хорошие показатели овариального резерва. Более того, сбор анамнеза показал, что до диагностики заболевания молодые женщины были практически здоровы, за исключением частой встречаемости гормонозависимых гинекологических заболеваний (СПКЯ, миомы матки, полипов эндометрия). Можно отметить, что пациентки, восстановившие менструальный цикл, были молодого возраста на момент начала лечения (до 27 лет) и в подавляющем большинстве имели мультифолликулярные или поликистозные яичники. При этом статистически не выявлено различий между наличием защиты яичников КОК и ее отсутствием (p=0,20).
Среди пациенток, принимавших аГнРГ, случаев аменореи и развития бесплодия не наблюдалось; в то же время доля девушек, получавших аГнРГ, слишком мала, чтобы можно было достоверно судить об их эффективности. В настоящее время аГнРГ применяются все чаще, что подчеркивает необходимость исследований в данном направлении.
Учитывая все еще довольно низкий процент обращения онкологических пациентов к гинекологам, прогностические модели сохранения овариального резерва в настоящее время отсутствуют. Однако подавляющее большинство случаев потери менструальной функции было сопряжено с определенными особенностями, повышающими вероятность истощения яичников. Эти клинические наблюдения могут быть описаны как типичные случаи высокого риска утери репродуктивного потенциала.
Из женщин, не восстановивших менструальный цикл, одна пациентка начала лечение с изначально низким овариальным резервом и манифестацией преждевременной недостаточности яичников, вступив после лечения в менопаузальное состояние. Помимо низкого овариального резерва, в качестве факторов риска можно выделить рецидивы, обуславливающие необходимость проведения повторных курсов химиотерапии второй линии, трансплантации стволовых клеток крови, а также приема пациенткой других видов гонадотоксичной терапии (такой как антиретровирусная у одной пациентки с ВИЧ).
В нашем исследовании восстановление менструальной функции происходило в первые 3 месяца после отмены препаратов, но крайне редко могло занимать и более года (у двух пациенток после приема заместительной гормональной терапии). Исходя из полученных данных, можно отметить, что шансы на восстановление менструальной функции тем ниже, чем больше времени прошло с момента окончания лечения.
Зависимость восстановления от возраста и овариального резерва подтверждается отечественными [5, 13, 14] и иностранными [15, 16] исследованиями. Показано, что вероятность стать родителями у пациентов со злокачественными заболеваниями тем ниже, чем старше они на момент обнаружения заболевания и лечения [17, 18]. При этом у женщин эта вероятность ниже, чем у мужчин, что, учитывая сложность предварительной криоконсервации генетического материала у женщин, еще раз подчеркивает необходимость разработки единых алгоритмов ведения онкологических пациентов у гинеколога.
Заключение
Решающими факторами восстановления менструальной функции после проведенной терапии по поводу НХЛ являются возраст пациентки, наличие мультифолликулярных яичников с высокими показателями овариального резерва, а также длительность и дозы проводимой химиотерапии. Важно отметить, что восстановление менструальной функции не в каждом случае означало восстановление репродуктивной функции, и некоторым пациенткам для достижения беременности потребовалось прибегнуть к методам вспомогательной репродукции, причем у части пациенток степень снижения овариального резерва диктовала необходимость использования донорских ооцитов. Данные исследования показали, что медикаментозная защита яичников не обеспечивает полного исключения гонадотоксичного влияния ПХТ. В связи с этим очевидной становится важность обследования онкологических пациенток у врача акушера-гинеколога не только после постановки диагноза, но и по завершении лечения. Только сотрудничество в ведении пациента онкологов и акушеров-гинекологов может способствовать корректному прогнозированию, снижению потери репродуктивной функции и полноценному информированию пациента относительно репродуктивных перспектив.



