В клинической практике минимальной толщиной эндометрия, связанной с повышенной вероятностью наступления беременности, принято считать толщину, равную 7 мм к концу фолликулярной фазы менструального цикла [1]. Толщина эндометрия больше данного порогового уровня ассоциирована с высокими показателями наступления беременности в программах экстракорпорального оплодотворения (ЭКО) и криопереноса [2]. В исследовании [3] показано, что «тонкий» эндометрий играет негативную роль в программах вспомогательных репродуктивных технологий, снижая вероятность наступления беременности в 9,1 раза.
Несмотря на то что частота встречаемости «тонкого» эндометрия невысока и равняется 2,4%, по данным Kasius et al. [4], в настоящее время эта проблема остается нерешенной, и у таких пациенток отмечается высокая частота отмены циклов переноса эмбриона (ПЭ). В настоящее время нет единого мнения, какая толщина эндометрия является достаточной для успешной имплантации. Более того, вероятно, для циклов с овариальной стимуляцией и для циклов с подготовкой эндометрия в программах донации ооцитов, суррогатного материнства и в криопротоколах эта толщина может быть различной [5]. В стимулированных циклах стандартных программ ЭКО, предусматривающих использование нативных собственных ооцитов пациентки, толщина эндометрия в день введения триггера овуляции при наличии в яичниках хотя бы одного нормально растущего фолликула по данным ультразвукового исследования (УЗИ) составляет в среднем 8–12 мм [6].
Было предложено множество методов лечения для увеличения толщины эндометрия, среди них применение низких доз аспирина, вазодилататоров, внутривлагалищное назначение витамина Е, L-аргинина и силденафил-цитрата [7], внутриматочное введение стволовых и прогениторных клеток. Но, несмотря на большое число назначаемых препаратов, на данный момент нет достоверно эффективного метода терапии «тонкого» эндометрия.
В 2011 г. Gleicher et al. впервые предложили применять препарат гранулоцитарного колониестимулирующего фактора (Г-КСФ) для лечения «тонкого» эндометрия у пациенток в программах ЭКО [8].
Г-КСФ – это гликопротеин, который принадлежит к группе колониестимулирующих факторов и стимулирует развитие колонии гранулоцитов. Г-КСФ является аминокислотным полипептидом, и многие клетки, в том числе эндотелиальные моноциты и клетки эндометрия, продуцируют его [9]. Предположительно, Г-КСФ играет важную роль в децидуализации эндометрия, в развитии трофобласта и в плацентарном метаболизме. Г-КСФ способствует мобилизации, миграции и дифференциации стволовых клеток. Также, возможно, он способствует регенерации эндометрия путем стимуляции ангиогенеза и снижения апоптозной активности клеток эндометрия. Существует предположение, что Г-КСФ играет роль в имплантации эмбриона и развитии беременности через временную супрессию иммунного ответа, т.к. Г-КСФ влияет на лимфоциты, макрофаги и Т-хелперы 2 [10]. Данный препарат с успехом применяется уже более 20 лет для лечения нейтропении у онкологических пациентов после химиотерапии, но в данном случае препарат вводится внутривенно или подкожно [11, 12].
После публикации ряда работ зарубежных исследователей об успешном применении Г-КСФ с целью терапии пациенток с «тонким» эндометрием для переноса эмбриона в криоциклах, а также об отсутствии негативного влияния на хромосомный набор эмбриона [8, 13–20], мы решили провести собственное исследование для оценки эффективности данного метода лечения.
Цель исследования – изучить эффективность внутриматочного введения препарата Г-КСФ с целью увеличения толщины эндометрия и частоты наступления беременности у пациенток с «тонким» эндометрием в программах переноса размороженных эмбрионов.
Материалы и методы
Мы провели нерандомизированное клиническое исследование. Оно было одобрено этическим комитетом Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии имени академика В.И. Кулакова. Следует отметить, что препарат Г-КСФ является «off lable», т.к. в инструкции нет показаний к терапии «тонкого» эндометрия и внутриматочному введению препарата.
В исследование вошли 15 пациенток с рефрактерным к стандартным методам лечения «тонким» эндометрием в программах переноса размороженных эмбрионов; они составили основную группу. Данным пациенткам неоднократно отменялся цикл переноса эмбриона в связи с недостаточной толщиной эндометрия. В группу контроля вошли 17 пациенток с «тонким» эндометрием, получивших только циклическую гормональную терапию (ЦГТ).
Критерии включения в исследование:
- возраст 20–42 лет;
- регулярный овуляторный менструальный цикл (25–34 дня);
- индекс массы тела: 18–30 кг/м2;
- бесплодие, обусловленное трубным, и/или мужским фактором, и/или наружным генитальным эндометриозом;
- идиопатическое бесплодие;
- отмены переноса эмбриона в анамнезе в связи с наличием «тонкого» эндометрия;
- отсутствие внутриматочной патологии на основании проведенной гистероскопии;
- наличие не менее 3 витрифицированных бластоцист классов: 1) отличного качества (≥3AA); 2) хорошего качества (3, 4, 5, 6 AB или BA) и/или среднего качества (3, 4, 5, 6 BB, AC и CA) (по классификации Gardner, Schoolcraft (1999));
- отсутствие индивидуальной непереносимости к препарату Г-КСФ и противопоказаний согласно инструкции данного препарата;
- информированное согласие на участие в исследовании.
Пациентки исключались из исследования при наличии онкологического заболевания в анамнезе, тяжелой формы наружного генитального эндометриоза или аденомиоза, внутриматочных синехий, полипов, субмукозной миомы матки, врожденных пороков развития матки до хирургического лечения.
Всем пациенткам в обеих группах назначалась ЦГТ в виде эстрадиола валерата (Bayer Schering Pharma, France) от 6 мг в день, с максимальной дозой до 12 мг в день, а также микронизированный прогестерон (CYNDEA PHARMA, S.L., Испания) в дозе 400 мг/сутки и дидрогестерон (Solvay Pharmaceuticals, Нидерланды) в дозе 40 мг/сутки для поддержки лютеиновой фазы менструального цикла (м.ц.). Пациенткам основной группы дополнительно к ЦГТ внутриматочно вводился препарат Г-КСФ (филграстим) в дозе 300 мкг (Лейкостим, «Биокад» ЗАО (Россия)) с помощью катетера для инсеминации (Smiths Medical International Ltd.) на 5–6-й и 12–13-й дни м.ц. Оценка толщины эндометрия производилась с помощью УЗИ малого таза (GE Voluson E8) на 14–15-й день м.ц. и в день переноса эмбриона (ПЭ) – на 20–21-й день м.ц. ПЭ осуществляли при достижении толщины эндометрия более 7 мм. Анализ крови на бета-субъединицу хорионического гонадотропина производили через 14 дней после ПЭ; УЗИ органов малого таза для определения клинической беременности проводилось через 28 дней после ПЭ. Первичная конечная точка – увеличение толщины эндометрия более 7 мм в день ПЭ, вторичная – частота наступления беременности.
Статистический анализ
Статистический анализ производился в программе STATISTICA (StatSoft Inc.). Для описания постоянных переменных, имеющих нормальное распределение, были использованы среднее арифметическое и стандартное отклонение – М (SD) и производилось их сравнение t-критерием Стьюдента между группами с нормальным распределением признаков и равенством дисперсий в сравниваемых группах. Для сравнения дискретных переменных был применен критерий χ2, результаты которых представлены в виде процентов. Значение p<0,05 оценивалось как статистически значимое. Для бинарных исходов размер эффекта был рассчитан как отношение шансов (ОШ) с 95% доверительным интервалом (ДИ), а для непрерывных данных – как разность средних значений с 95% ДИ.
Результаты и обсуждение
Характеристика пациенток представлена в таблице 1.
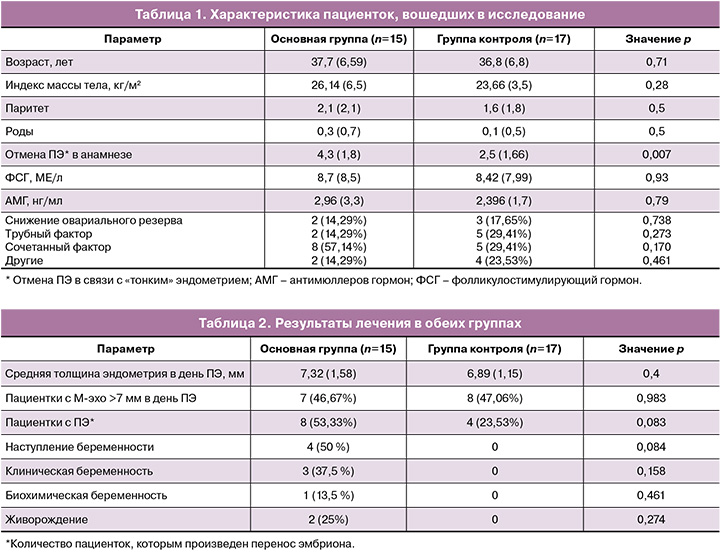
Толщина эндометрия более 7 мм в основной группе зафиксирована у 7 пациенток (46,67%), а в группе контроля – у 8 (47,06%) пациенток; разница статистически не значима (р=0,983, ОШ 0,984 с 95% ДИ – 0,245–3,958). Средний прирост толщины эндометрия по сравнению с предыдущим циклом составил 0,6 мм. Средняя толщина эндометрия в день ПЭ в основной группе составила 7,32 мм, в группе контроля средняя толщина эндометрия была 6,89 мм; различия статистически не значимы (p=0,4, разность средних значений – 0,43 с 95% ДИ -0,5594–1,4194). ПЭ произведен у 8 (53,3%) пациенток в основной группе, а в группе контроля – у 4 пациенток (23,53%); различия статистически не значимы (p=0,083; ОШ 3,714 с 95% ДИ – 0,819–16,840). В основной группе беременность наступила у 4 (50%) пациенток, клиническая беременность – у 3 (37,5%), у одной пациентки была биохимическая беременность. В группе контроля беременность не наступила ни у одной пациентки, значения статистически не значимы (p=0,84). На момент публикации статьи у двух пациенток (25%) из основной группы беременность закончилась живорождением, у одной пациентки – прогрессирует. Результаты лечения представлены в таблице 2.
В нашем исследовании не было отмечено ни одного побочного эффекта после применения препарата Г-КСФ.
Заключение
В анамнезе у пациенток среднее число отмены ПЭ было 4,3 (1,8); в нашем исследовании ПЭ был произведен у 8 (57,14%) пациенток, и беременность наступила у 4 (50%) пациенток, что свидетельствует о том, что, несмотря на статистически не значимые результаты, в группе с Г-КСФ имеется тенденция к увеличению толщины эндометрия и частоты наступления беременности. Также есть тенденция к уменьшению частоты отмены ПЭ в связи с «тонким» эндометрием.
Мы считаем, что необходимо провести исследование на большей выборке пациенток для более достоверных данных и возможности внесения данного препарата в рекомендации к подготовке «тонкого» эндометрия в программах ЭКО.



