Выхаживание детей с экстремально низкой (ЭНМТ) и очень низкой массой тела при рождении (ОНМТ) представляет серьезную проблему в связи с незрелостью органов и систем организма, частотой полиорганной недостаточности и выраженностью метаболических нарушений.
Одной из основных проблем в выхаживании детей с ЭНМТ и ОНМТ, определяющей не только ближайший исход, но и вероятность инвалидности в дальнейшем, является рациональное питание. С одной стороны, доказано, что повышение дозы вводимых парентерально углеводов, белков и жиров с первых часов жизни в дальнейшем ассоциировано с лучшими исходами и более адекватным когнитивным развитием. Экспериментальные исследования показали, что дефицит нутриентов связан с неоптимальным ростом окружности головы и задержкой психомоторного развития [1]. С другой стороны, увеличение дозы углеводов может вести к развитию гипергликемии, что ведет к риску развития многих патологических состояний. Гипергликемия, особенно длительная, связана с повышенной заболеваемостью, в том числе с возникновением внутрижелудочкового кровоизлияния (ВЖК) и ретинопатии недоношенных, а также смертностью, особенно у детей с ЭНМТ и ОНМТ [2–5]. Среди недоношенных детей гипергликемия определяется в 45–80% случаев в зависимости от гестационного возраста и патологического процесса [6, 7].
В постнатальном периоде поддержание гомеостаза глюкозы зависит от баланса между синтезом глюкозы печенью и потреблением ее тканями. У доношенных новорожденных глюкоза потребляется со скоростью от 4 до 6 мг/кг/мин, у плода в III триместре беременности и у недоношенных детей приблизительно в 2 раза быстрее (8–9 мг/кг/мин).
Главным негативным последствием повышения концентрации глюкозы в крови является изменение осмолярности (гиперосмия), увеличение проницаемости гистогематических барьеров и развитие осмотического диуреза. Повышение проницаемости гематоэнцефалического барьера увеличивает нейротоксичность непрямой фракции билирубина, что также может вести к выраженному неврологическому дефициту. У новорожденных повышение осмолярности приводит не только к выраженному синдрому угнетения центральной нервной системы, обусловленному отеком мозга, но и к развитию ВЖК и, как следствие, нарушению гемодинамики, дыхательной недостаточности, судорогам, апноэ и т.д. Гипергликемия также приводит к осмотическому диурезу и, как следствие, к обезвоживанию ребенка, нарушениям электролитного баланса [8, 9].
Наиболее частой причиной неонатальной гипергликемии является избыточное вливание концентрированных растворов глюкозы при проведении интенсивной терапии [10, 11]; на втором месте – инфекционный процесс [11, 12]. Гипергликемия часто встречаются у недоношенных и детей, перенесших асфиксию, синдром дыхательных расстройств [3]. Она также может быть проявлением транзиторного неонатального сахарного диабета, недостаточной функции поджелудочной железы. На таком фоне форсированная дотация белков, жиров, углеводов и энергии недоношенным детям с ЭНМТ и ОНМТ (преимущественно за счет их раннего парентерального введения) в сравнении с традиционной методикой, может нести риски увеличения частоты и выраженности гипергликемии, что обуславливает актуальность проведения данного исследования.
 Цель исследования: оценить влияние методики форсированной дотации нутриентов на частоту и выраженность гипергликемии у детей с ЭНМТ и ОНМТ при рождении.
Цель исследования: оценить влияние методики форсированной дотации нутриентов на частоту и выраженность гипергликемии у детей с ЭНМТ и ОНМТ при рождении.
Материал и методы исследования
Обследованы 120 новорожденных (из них 47 детей с ЭНМТ, 73 ребенка с ОНМТ при рождении), находившихся в отделении реанимации и интенсивной терапии ФГБУ НЦАГиП им. В.И. Кулакова с января 2012 года по январь 2014 года. Гестационный возраст детей составил (M±SD (min-max)) 29,2±2,0 (23–33) недель, масса тела при рождении 1120,6±294,96 (460–1500) г. Всем детям определяли уровень глюкозы в крови. При проведении полного и частичного парентерального питания измерение уровня глюкозы в крови проводилось каждые 6 часов, далее 2 раза в сутки. При выявлении гипергликемии, гипогликемии частота определения глюкозы крови проводилась по показаниям. Определение уровня глюкозы в капиллярной крови проводилось с помощью анализатора глюкозы крови, анализатора газов крови с опциями определения глюкозы в крови. Определение глюкозурии, кетонурии производилось с помощью тест полосок глюкозо-оксидазным методом при гипергликемии более 10 ммоль/л. Гипергликемией считалась двукратное повышение уровня глюкозы крови >8,0 ммоль/л, с интервалом 4 часа.
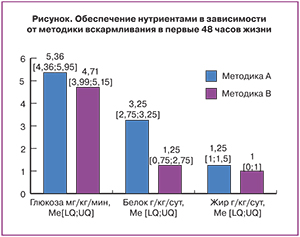
Парентеральное питание было начато в первые часы жизни (Ме [LQ; UQ]) 117,6 [24; 252] мин. Трофическое энтеральное питание было начато в первый день жизни. Дети были разделены по гестационному возрасту на следующие группы: I группа – 25–27 недель (n=22), II группа – 28–29 недель (n=43), III группа – 30–31 неделя (n=40) и IV группа – 32–33 недели (n=15). Каждая группа была поделена на подгруппы в зависимости от методики проведения парентерального питания: методика А – форсированная дотация нутриентов; методика В – традиционная дотация нутриентов (табл. 1, рисунок)
При выявлении гипергликемии проводилась терапия согласно протоколу, принятом в отделении. Гипергликемия купировалась снижением инфузии экзогенной глюкозы или внутривенным введением инсулина короткого действия (актрапид). Проведение инсулинотерапии потребовалось 21 пациенту в I группе, во II группе – 15 пациентам, в III группе – 9 детям, в IV группе – 1 ребенку.
Общая тяжесть состояния и степень выраженности полиорганной недостаточности в первую неделю жизни оценивалась ежедневно по шкале NEOMOD [13].
Критериями исключения были врожденные пороки развития, терминальные состояния ребенка (оценка по шкале NEOMOD >6 баллов).
По гестационному возрасту, массе тела при рождении, по частоте встречаемости респираторного дистресс синдрома, врожденной пневмонии, врожденного сепсиса, некротизирующего энтероколита, ретинопатии недоношенных, а также по тяжести состояния при рождении группы были однородны.
Статистическая обработка данных выполнялась с использованием пакета прикладных программ Statistica 8.0 (StatSoft Inc., США). Количественные признаки, имевшие нормальное распределение, описывали средними и среднеквадратическими отклонениями (М±SD); не имевшие нормального распределения описывали медианами и квартилями (Ме [LQ; UQ]). Для количественных признаков сравнение несвязанных групп проводилось с использованием непараметрического теста Манна–Уитни (U-test). Для сравнения частот значений признаков в группах применялся двухсторонний точный критерий Фишера (ТКФ). Различия считались статистически значимыми при достигнутом уровне значимости Р<0,05. Все дети в данном исследовании подбирались методом случайной выборки с учетом задач проводимого исследования.
Результаты исследования и обсуждение
В ходе исследования было установлено, что разница в частоте гипергликемии в зависимости от методики вскармливания оказалась статистически недостоверной. Данная тенденция была отмечена во всех группах (табл. 2).
Также при проведении сравнительного анализа использования двух методик парентерального питания, не было выявлено повышения среднего уровня глюкозы крови в первую неделю жизни в подгруппах с форсированной дотацией нутриентов (табл. 3).
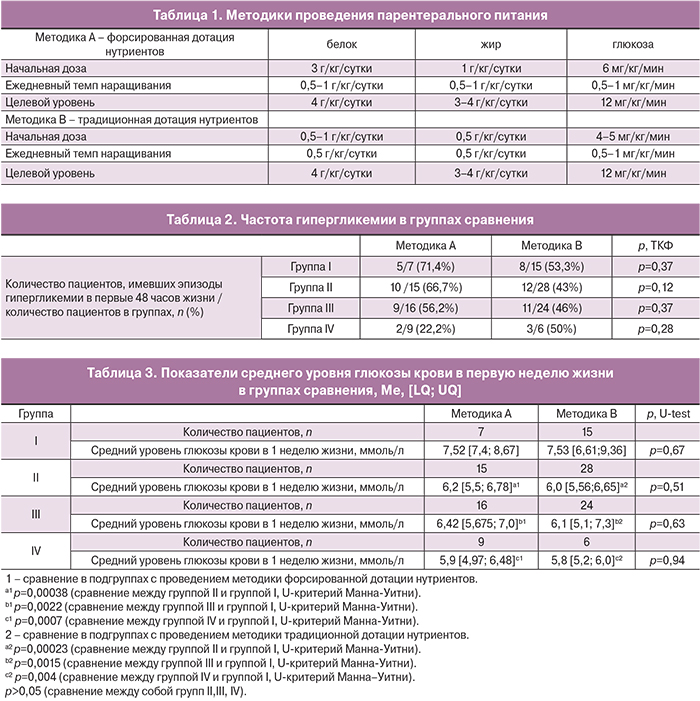
Склонность глубоко недоношенных новорожденных к гипергликемии обусловлена с одной стороны высоким уровнем контринсулярных веществ: катехоламинов, цитокинов, провоспалительных белков, а с другой – незрелостью клеток поджелудочной железы, не способной увеличивать выработку инсулина в ответ на углеводную нагрузку [14]. Проведенное исследование подтвердило это положение: при анализе показателей среднего уровня глюкозы крови в первую неделю жизни было выявлено статистически значимое его повышение пропорционально гестационному возрасту. В I группе (гестационный возраст 25–27 недель) отмечалось статистически значимое повышение среднего уровня глюкозы крови в первую неделю жизни по сравнению с группами II, III, IV(табл. 3).
Было выявлено повышение частоты ВЖК 1–2-й степени в I группе в подгруппе с применением традиционной дотации нутриентов – 66,7%, по сравнению с подгруппой с форсированной дотацией нутриентов – 14,2%, что является статистически достоверным, р=0,03. Таким образом, повышения частоты ВЖК при использовании методики форсированной дотации нутриентов выявлено не было.
При анализе возможных осложнений парентерального питания пациентов I группы, было выявлено увеличение частоты развития неонатального холестаза в подгруппе с применением методики традиционной дотации нутриентов – 60%, по сравнению с методикой форсированной дотации нутриентов (случаев неонатального холестаза выявлено не было), р=0,017. В нашем исследовании при применении методики форсированной дотации нутриентов увеличения частоты неонатального холестаза выявлено не было. Вероятнее всего, это связано с ранним введением трофического питания и его быстрым наращиванием, а также с более адекватным потребностям синтеза желчных кислот поступлением аминокислот, важность которого подчеркивается в литературе [15].
В группах детей, имевших гестационный возраст более 27 недель, достоверной разницы в частоте развития ВЖК, неонатального холестаза выявлено не было, р>0,05.
При исследовании двух методик парентерального питания статистической разницы в частоте развития ретинопатии недоношенных выявлено не было. Частота ретинопатии в подгруппе с применением методики А составила 21,3%, в подгруппе с применением методики В – 17,8%, р≥0,05.
Выводы
1. Применение методики форсированного питания у детей с ЭНМТ и ОНМТ не ведет к достоверному увеличению частоты и выраженности гипергликемии.
2. Отсутствие увеличения частоты возможных осложнений гипергликемии – ВЖК, ретинопатии, неонатального холестаза дополнительно свидетельствует о безопасности применения методики форсированной дотации нутриентов.



