Гестационный сахарный диабет (ГСД) представляет собой одно из наиболее частых эндокринных нарушений у беременных женщин. Ежегодно отмечается увеличение числа беременных с ГСД, что связано как с принятыми консенсусно значениями гликемии, так и с пандемией ожирения, а также с развитием сахарного диабета (СД) 2 типа [1–3]. Так, согласно данным Международной федерации диабета (International Diabetes Federation, IDF), 21,3 млн (16,2%) детей, рожденных в 2017 г., во внутриутробном периоде развития подверглись воздействию гипергликемии, в 86,4% случаев обусловленной ГСД. Ожидаемый прирост женщин репродуктивного возраста с нарушениями углеводного обмена в ближайшее десятилетие составляет более 58% [4].
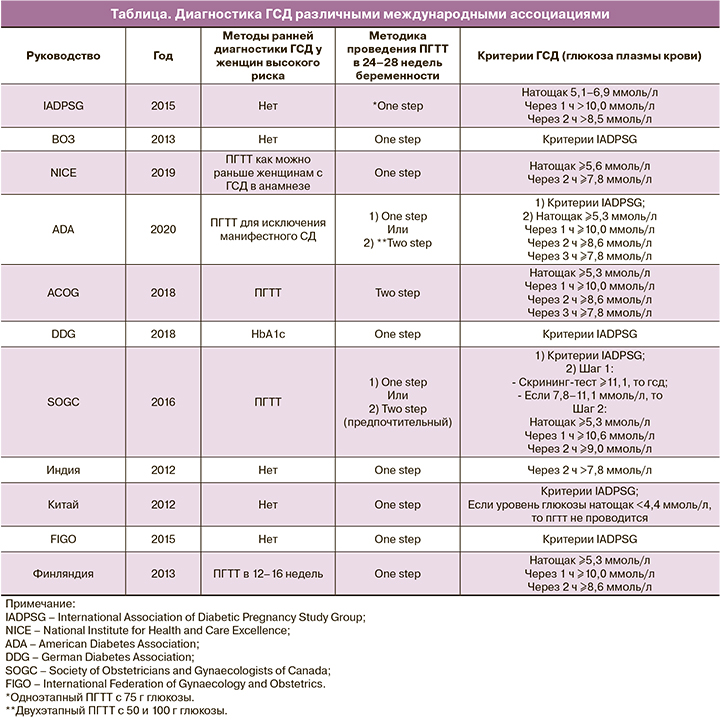
Под термином ГСД уже достаточно длительное время подразумевается заболевание, характеризующееся гипергликемией, впервые выявленной во время беременности, но не соответствующей критериям «манифестного» СД [5]. Тем не менее в настоящее время разными профессиональными медицинскими ассоциациями приняты несколько различающиеся пороговые значения гликемии для диагноза ГСД (таблица). Так, зарубежные ассоциации (ACOG – the American College of Obstetricians and Gynecologists [6], JCOG – the Journal of Obstetrics and Gynaecology Canada [7], Finnish Medical Society Duodecim [8], ADA – American Diabetes Association [9]) для диагностики ГСД используют значение уровня тощаковой глюкозы в венозной плазме ≥5,3 ммоль/л; отечественные рекомендации к пороговым значениям глюкозы плазмы натощак относят уровни ≥5,1 ммоль/л. Порогом отсечки для диагностики ГСД по рекомендациям Национального института здоровья и клинического совершенствования (The National Institute for Health and Care Excellence, NICE) был выбран уровень глюкозы в плазме крови ≥5,6 ммоль/л. Этим объясняется достаточно сильный разброс частоты распространенности ГСД, которая, согласно данным мировой литературы, колеблется от 2,0 до 37,0% от общего числа беременностей и в большей степени зависит от используемых методов исследования по выявлению гипергликемии, изучаемой популяции, индекса массы тела (ИМТ), возраста, распространенности СД 2 типа в отдельных этнических группах [4, 10, 11]. Согласно данным Государственного регистра СД, распространенность ГСД в России составляет 8–9%, в то время как по данным международных исследований около 17% всех беременностей осложняется ГСД, и наблюдается тенденция к росту заболеваемости [12]. Установлено, что рост заболеваемости ГСД происходит параллельно с ростом СД, темпы роста которого, однако, превышают темпы роста ГСД [13].
Выделен ряд факторов риска ГСД, которые в целом сходны с факторами, ассоциированными с развитием СД 2 типа; они включают возраст матери, ожирение, этническое происхождение, генетическую предрасположенность, случаи выявления ГСД при предыдущих беременностях [14–16]. Кроме этого, выделяют и другие факторы риска, такие как крупный вес детей при рождении при предыдущих беременностях, неблагоприятный исход предыдущей беременности, глюкозурия, многоводие или макросомия плода по данным ультразвукового скрининга при данной беременности [17, 18]. Также имеются экспериментальные и эпидемиологические исследования роли загрязнения воздуха как фактора риска развития ГСД, однако выводы авторов неоднозначны, и поэтому требуются дополнительные исследования [19]. Недавние исследования указывают на увеличение риска развития ГСД при нарушениях дыхания во время сна (храп, синдром обструктивного апноэ сна, гиповентиляция во время сна) [20]. Мужской пол плода ассоциирован с гипофункцией β-клеток, более высокой постпрандиальной гликемией и повышенным риском ГСД матери [21]. Продолжается активный поиск новых факторов риска ГСД [22].
Следует особо отметить, что реализация негативного воздействия даже незначительной гипергликемии во время беременности зависит от стадии эмбрио-фетогенеза. Кроме того, повышение уровня глюкозы в крови матери чресплацентарно влияет на плод, что приводит к повышенному риску развития макросомии, неонатальной желтухи, гипогликемии новорожденных, преждевременных родов и поступления новорожденных в отделение интенсивной терапии. Согласно данным исследования HAPO FUS, проведенного в 2013–2016 гг., внутриутробное воздействие повышенного уровня гликемии ассоциировано с нарушением толерантности к глюкозе и инсулинорезистентностью у детей и не зависит от ИМТ матери и ребенка [23]. Кроме того, ГСД ассоциирован не только с повышением частоты кесарева сечения, но и с риском развития гестационной артериальной гипертензии и преэклампсии [24], депрессии во время беременности [25]. В долгосрочной перспективе женщин, во время беременности которых был диагностирован ГСД, имеется риск развития СД 2 типа, метаболического синдрома и сердечно-сосудистых заболеваний. Так, у женщин с ГСД в анамнезе в 7,4 раза повышена вероятность развития СД 2 типа. К счастью, контроль гликемии у женщин с ГСД может улучшить исходы беременности [26, 27], поэтому ранняя диагностика и своевременная коррекция гипергликемии во время беременности могут стать успешным решением актуальной акушерской проблемы.
Ранний скрининг
В последнее время многие ученые особое внимание уделяют проблеме раннего скрининга ГСД. Многие организации здравоохранения рекомендуют при первом пренатальном визите тестировать на наличие манифестного СД женщин высокого риска [28, 29], что связано с более высоким риском врожденных пороков развития и неблагоприятных исходов беременности [30].
Международная ассоциация групп по изучению диабета и беременности (IADPSG) и ВОЗ рекомендуют проводить универсальный скрининг всех беременных в I триместре путем измерения глюкозы венозной плазмы натощак (ГВПН) [11, 31]. Главным преимуществом этого исследования является диагностика манифестного СД уже на первом пренатальном визите с использованием стандартных диагностических критериев, т.е. если ГВПН ≥126 мг/дл (≥7,0 ммоль/л) [32]. Ранний пероральный глюкозотолерантный тест (ПГТТ) с использованием пероральной нагрузки 75 г глюкозы, растворенной в 300 мл воды, до 24 недель гестации может также использоваться для диагностики манифестного диабета, если уровень глюкозы плазмы крови через 2 ч ≥200 мг/дл (≥11,1 ммоль/л) согласно рекомендациям FIGO и ВОЗ [31, 32].
Некоторые национальные общества [33, 6–9] предлагают проводить тестирование на наличие манифестного диабета у женщин из группы высокого риска при первом пренатальном визите путем проведения ПГТТ. Согласно ACOG, ранний ПГТТ следует проводить в начале беременности [6]. NICE рекомендует проводить как можно раньше двухчасовой ПГТТ с 75 г глюкозы для женщин, у которых был ГСД при предыдущей беременности [33]. Если результаты ранних тестов отрицательные, скрининг ГСД по-прежнему рекомендуется на 24–28-й неделе беременности [33, 6]. Точно так же Национальная система здравоохранения Италии [34, 35] рекомендует скрининг в сроке 16–18 недель беременности у женщин с ГСД в анамнезе, ожирением или повышением ГВПН (5,55–6,94 ммоль/л) в течение I триместра беременности [36]. Министерство здравоохранения Китая [37], Индийская группа по исследованию диабета при беременности (DIPSI) [38] рекомендуют универсальный скрининг всех беременных при первом пренатальном визите. Обобщающие данные приведены в таблице.
Большинство исследований по изучению эффективности ранней диагностики нарушений углеводного обмена имеют два основных ограничения: использование неподтвержденных диагностических критериев, отсутствие уточнения физиологических гликемических изменений в ранние сроки беременности, а также использование промежуточных результатов, таких как диагноз ГСД в 24–28 недель беременности, вместо использования истинных показателей неонатальных и материнских исходов беременности. Но в то же время женщины с диагностированным ГСД в конце II или начале III триместра имеют меньшее окно возможностей для контроля макросомии плода и других нарушений.
Методы раннего скрининга ГСД
С целью скрининга и диагностики ГСД в ранние сроки беременности используются прямые гликемические тесты, такие как ГВПН, случайное определение глюкозы венозной плазмы (СОГВП), ПГТТ, и косвенные методы – гликозилированный гемоглобин (HbA1c) или фруктозамин и более новые биохимические маркеры.
Измерение глюкозы венозной плазмы натощак
Анализ уровня ГВПН представляет определенные сложности, в первую очередь за счет высокой вероятности преаналитической ошибки, обусловленной несоблюдением правил забора, обработки и транспортировки проб крови в лабораторию. Кроме того, уровень ГВПН снижается с увеличением срока беременности. Например, в Китае средний показатель ГВПН составил 4,95 ммоль/л в сроке беременности 4–6 недель, 4,70 ммоль/л – в 10–12 недель, 4,53 ммоль/л – в 14–16 недель и был самым низким – 4,38 ммоль/л в 20–24 недели гестации [39]. Следует отметить, что при исследовании в другой китайской популяции пороговые значения ГВПН для прогнозирования ГСД после 24 недель беременности различались в зависимости от ИМТ. Предельное значение ГВПН было 4,77 ммоль/л – у женщин с недостаточной массой тела до беременности; 4,92 ммоль/л – у женщин с нормальным весом до беременности; 5,00 ммоль/л – с избыточным весом и 5,05 ммоль/л – у беременных с ожирением [40]. В целом порог ГВПН зависит от срока беременности и ИМТ. Продолжаются поиски оптимального порога для определения уровня ГВПН и ассоциации с ГСД или неблагоприятными исходами беременности.
Ретроспективный анализ проспективной когорты из 1228 беременных выявил, что в многонациональной популяции уровень ГВПН в I триместре беременности не имел преимуществ в качестве предиктора развития осложнений беременности по сравнению с HbA1c. Более того, HbA1c ≥5,8% (39,9 ммоль/моль) в ранние сроки беременности был ассоциирован с повышенным риском развития макросомии [41].
Случайное определение глюкозы венозной плазмы
Ретроспективное исследование 17 736 беременных показало, что СОГВП при обследовании в ранние сроки беременности (12–16 недель беременности) имеет достаточные показатели в качестве скринингового теста ГСД и в целом лучше, чем скрининг, основанный на установленных факторах риска (возраст и ИМТ матери). Также СОГВП может играть определенную роль в выявлении женщин, которые находятся в группе низкого риска развития ГСД и которые будут рассматриваться как имеющие низкий приоритет для ранней диагностики. И наоборот, СОГВП может использоваться для выявления женщин с высоким риском развития ГСД, которым необходима более ранняя диагностика или более ранние мероприятия по изменению образа жизни в ранние сроки беременности. Однако у женщин с низким уровнем глюкозы венозной плазмы вне зависимости от времени суток и приема пищи все же может развиться ГСД. Эти данные свидетельствуют о том, что при определении только случайной глюкозы венозной плазмы, без проведения ПГТТ во II триместре, существует риск пропуска около 30% случаев ГСД [42].
Пероральный глюкозотолерантный тест
ПГТТ может быть более точным диагностическим методом, чем однократное исследование ГВПН, для диагностики ГСД в ранние сроки беременности. Так, проведение раннего ПГТТ у беременных с ожирением привело к дополнительной диагностике 21,5% ГСД по сравнению с исследованием только ГВПН [43]. В исследовании, проведенном в Финляндии, беременным женщинам было предложено пройти двухчасовой 75 г ПГТТ на сроке 12–16 недель беременности, и, в случае нормального значения, повторное тестирование было проведено на сроке 24–28 недель беременности. Ранний ГСД был диагностирован у 209 (14,9%) человек, а поздний ГСД – у 114 (10,6%) человек. Авторы сделали выводы о необходимости разработки пороговых значений ПГТТ для ранней диагностики ГСД в зависимости от гестационного возраста [44].
Уровень гликозилированного гемоглобина
HbA1c может также использоваться для выявления манифестного диабета в I триместре (≥6,5%) в соответствии с действующими рекомендациями [45]. Тест должен быть выполнен в лаборатории с использованием метода определения, сертифицированного в соответствии с National Glycohemoglobin Standartization Programm (NGSP) и стандартизованного в соответствии с референсными значениями, принятыми в DCCT (Diabetes Control and Complications Study) [45]. Исследование HbA1c имеет то преимущество, что он недорог и выполняется не натощак. Fong et al. оценили его прогностическую эффективность для прогрессирования ГСД в ретроспективном когортном исследовании, которое выявило, что уровни HbA1c между 5,7 и 6,4% (39–46 ммоль/моль) могут эффективно идентифицировать пациентов с самым высоким риском развития ГСД [46]. Дальнейшее исследование из Новой Зеландии показало, что HbA1c ≥5,9% (41 ммоль/моль) является высоко прогностическим фактором для уже существующего СД и неблагоприятных исходов беременности [47]. Кроме того, в другом исследовании из Швейцарии был сделан вывод, что у всех беременных с HbA1c ≥6,0% в I триместре (42 ммоль/моль) позже развивается ГСД во время беременности, в то время как женщины с HbA1c <4,5% (26 ммоль/моль) не имеют этого осложнения беременности [48].
Другие биохимические маркеры
Повышается интерес к разработке простых анализов, которые помогут идентифицировать женщин с низким или высоким риском ГСД, снизив необходимость универсального тестирования на глюкозу. Многие биохимические маркеры были оценены в I триместре, но часто – только в небольших исследованиях случай-контроль без перспективной валидации. Исследование Dereke et al., опубликованное в 2020 г., показало увеличение циркулирующего плацентарного протеина, ассоциированного с беременностью (PAPP-A), у женщин с ранним ГСД, не зависящее от возраста, ИМТ, концентрации С-пептида и адипонектина [49]. Последнее исследование Alamolhoda et al. выявило достоверную взаимосвязь между повышением сывороточной концентрации С-реактивного белка (СРБ) в I триместре беременности и риском развития ГСД. Риск развития ГСД у женщин с самой высокой концентрацией СРБ в сыворотке крови оказался в три раза выше, чем у женщин с самой низкой его концентрацией [50]. Но в то же время серьезным недостатком использования СРБ в качестве инструмента скрининга является его неспецифический характер.
Адипоцитокины, такие как адипонектин и лептин, являются гормонами, выделяемыми жировой тканью. Адипонектин играет важную роль в регуляции глюкозы и, по-видимому, является хорошим маркером чувствительности всего организма к инсулину [51]. Недавний метаанализ, включающий восемь исследований с использованием уровней адипонектина на ранних сроках беременности, показал умеренную прогностическую способность адипонектина в прогнозировании ГСД с площадью под ROC-кривой 0,79, чувствительностью 60,3% и специфичностью 81,3% [52]. В ряде исследований глобулин, связывающий половые гормоны (ГСПГ), используется в качестве предиктора позднего развития ГСД. Систематический обзор, включающий 26 исследований, показал, что уровень ГСПГ значительно ниже у беременных женщин с ГСД, чем у здоровых женщин, и оценка этого маркера на ранних сроках беременности может рассматриваться как предположительный риск развития ГСД. Ряд зарубежных ученых (W. Guo, H. Wang et al., 2018) исследовали взаимосвязь между концентрацией сывороточного железа и ферритина в плазме крови и заболеваемостью ГСД. Исследование проводили в группе беременных на сроке до 12 недель гестации. Были сделаны выводы о том, что уровни ферритина и сывороточного железа в плазме крови в группе пациенток с ГСД выше, чем в группе пациенток с нормально протекающей беременностью (р<0,05) [53]. Исследование плазменного гликированного CD59 (pGCD59) показало, что pGCD59 является простым и точным биомаркером для выявления ГСД в ранние сроки беременности [54].
Стремительное развитие молекулярно-биологических наук способствовало поиску специфических молекул, возможных предикторов развития ГСД. Так, в последнее время появляется все больше исследований, показывающих роль экзосом в прогнозировании различных состояний, в том числе и ГСД. Экзосомы представляют собой небольшие (около 50–150 нм в диаметре) внеклеточные везикулы, которые активно секретируются всеми типами клеток во внеклеточное пространство и присутствуют во многих биологических жидкостях, включая плазму, сыворотку, амниотическую жидкость, мочу и грудное молоко. Saker et al. показали, что концентрация экзосом в плазме выше у нормальных беременных женщин, чем у небеременных [55]. А позднее Salomon et al. продемонстрировали двукратное увеличение содержания экзосом плаценты в крови у женщин с ГСД по сравнению с таковыми при нормальной беременности в трех гестационных точках (11–14, 22–24 и 32–36 недель беременности) [56], что может предоставить новые возможности для предикции ГСД. Lara J. Monteiro et al. показали более высокую концентрацию внеклеточных везикул, выделенных из жидкости десневой борозды, полученной на 11–14-й неделе беременности у женщин, у которых позже развивался ГСД, по сравнению с «нормогликемическими» беременными [57]. Количественное определение внеклеточных везикул у женщин низкого риска или в сочетании с факторами риска может потенциально использоваться в качестве скрининга ГСД в I триместре.
Недавно был опубликован обзор по физиологии и эпигенетике ГСД [58], при этом была описана связь ГСД с определенными микроРНК. МикроРНК могут высвобождаться из плаценты в материнский кровоток уже на 6-й неделе беременности. Они участвуют в развитии плаценты, секреции инсулина, функционировании β-клеток, метаболизме липидов и в регуляции сердечно-сосудистой системы. Наиболее очевидным клиническим применением исследования микроРНК в материнской крови является выявление биомаркеров для прогнозирования ГСД или его осложнений. Zhao et al. проведена валидация массива микроРНК с последующим проведением количественной полимеразной цепной реакции у женщин в ранние сроки беременности (16–19 недель), у некоторых из которых позднее (24–28 недель) развивался ГСД. В последнем случае уровни экспрессии трех микроРНК (miR-132, miR-29a и miR-222) были достоверно снижены по сравнению с контролем в аналогичные сроки гестации. В более современном сравнительном исследовании профилирование микроРНК посредством массивного секвенирования предложило другие предикторы ГСД, подлежащие оценке: miR-16-5p, miR-17-5p, miR-19a-3p, miR-19b-3p и miR-20a-5p [59]. Авторы исследования, опубликованного в 2019 г. в журнале European Journal of Endocrinology, идентифицировали две микроРНК (miR-223 и miR-23a), которые были повышены в плазме крови у пациенток с ГСД по сравнению с группой контроля [60]. Таким образом, циркулирующие микроРНК являются потенциальными биомаркерами ГСД в ранние сроки беременности.
Раннее вмешательство во время беременности может значительно снизить частоту ГСД, а также уменьшить гестационную прибавку массы тела и снизить неблагоприятные исходы беременности, включая гипертензивные расстройства, частоту кесарева сечения и макросомии [61]. В исследовании Sovio et al. показано, что до постановки диагноза ГСД имеет место ускоренный рост плода уже на 20-й неделе гестации [62].
Существуют контраверсии по методам и срокам диагностики ГСД. Исследования J. Brown, G. Ceysens, C.M. Scifres указывают на то, что ГСД является осложнением второй половины беременности, и скрининг в I триместре малоинформативен [63]. Напротив, в исследованиях J. Tieu et al. было показано, что лечение даже умеренного гликемического нарушения во время беременности полезно для предотвращения его клинических последствий [64], поэтому ранний скрининг может стать актуальным решением проблемы. Имеющиеся данные также свидетельствуют о том, что выявление и лечение гипергликемии на ранних сроках беременности имеет клиническое значение [65, 32].
После почти 60 лет исследований и огромных усилий по достижению консенсуса до сих пор не существует общепринятого глобального руководства относительно того, как и когда проводить скрининг и диагностику ГСД [9]. Споры о критериях скрининга и диагностики все еще продолжаются.
Заключение
Необходимы дальнейшие многоцентровые исследования для определения соответствующих порогов ПГТТ на ранних сроках беременности для диагностики ГСД, оценки влияния раннего лечения ГСД на перинатальные осложнения и долгосрочное здоровье потомства. Диагностические критерии, специфичные для первой половины беременности, необходимы для того, чтобы избежать гипердиагностики ГСД, приводящей к медикализации нормальной беременности, и улучшить раннее выявление клинически значимой непереносимости глюкозы, связанной с неблагоприятными исходами.



