Новорожденные во время пребывания в отделении реанимации и интенсивной терапии нередко подвергаются воздействию многочисленных болезненных процедур. Боль может привести к снижению оксигенации, нестабильности гемодинамики, а также повышению уровня гликемии, внутричерепного давления, особенно у глубоко недоношенных пациентов. Тяжелая или неоднократная боль у новорожденного ребенка вызывает развитие внутрижелудочковых кровоизлияний, ишемии и перивентрикулярной лейкомаляции, приводит к увеличению риска развития сепсиса, ДВС-синдрома, метаболического ацидоза, формирует состояние постоянного стресса или гипералгезии, когда любой раздражитель воспринимается ребенком как болевой, повышает неонатальную смертность.[1].
До настоящего времени не разработаны «золотые стандарты» по контролю боли. Используемые методы основаны не на оценке непосредственно боли, а на показателях, изменения которых вызваны болью: гемодинамика, лицевая активность, поведение, гормональный статус и др. [2–4]. Однако эти критерии часто неспецифичны. Поведенческие тесты не идеальны, зависят от субъективного мнения эксперта, часто трудоемки.
По мнению ряда исследователей, идеальный инструмент оценки боли (альгезиметр) должен обладать следующими свойствами: быть объективным, чувствительным и специфичным, иметь быструю реакцию, возможность непрерывно регистрировать показатели в режиме онлайн и быть удобным для использования в клинических ситуациях.
Монитор болевого стресса отличается высокой точностью и специфичностью, так как только индекс кожной проводимости напрямую коррелирует с уровнем норэпинефрина, мгновенно реагирует на ноцицептивные стимулы. Прибор отражает активность симпатической нервной системы, на которую влияют изменения эмоций, приводящие к высвобождению ацетилхолина. В свою очередь ацетилхолин воздействует на мускариновые рецепторы, приводя к выделению пота и вследствие этого к увеличению кожной проводимости [5–8]. Эта реакция регистрируется прибором мгновенно и не зависит от изменений в гемодинамике или от нейромускулярной блокады. Когда потовые железы активизируются, и выделяется пот, сопротивление кожи снижается, и влажная кожа позволяет слабому электрическому потоку проходить под измеряющим электродом. Когда пот испаряется, сопротивление кожи повышается и снова происходит снижение кожной проводимости [6, 9]. Эти изменения выражаются в волнах короткой продолжительности (пик кожной проводимости), которые возникают в течение 1–2 секунд после возбуждения [10, 11]. Число и амплитуда волн зависит от степени активности симпатической нервной системы [6, 7, 9]. Базовый уровень кожной проводимости обусловлен как особенностями симпатической нервной системы, так и свойствами кожи [6, 12]. У глубоко недоношенных новорожденных потовые железы на ладонных и подошвенных поверхностях анатомически развиваются в течение второго триместра беременности, получают симпатическую иннервацию, начиная с 18 недель постконцептуального возраста, и к 28 неделям полностью сформированы [12–14]. Однако функциональная активность остается сниженной до 36–37 недели беременности [15].
 Очевидно, что центральные анальгетики не могут быть использованы для обезболивания, связанного с редкими заборами крови. Поэтому очень важны простые, приемлемые и хорошо переносимые методы, чтобы уменьшить боль у новорожденных (сосание пустышки во время процедуры, использование раствора глюкозы или сахарозы через соску, кормление грудью, прослушивание музыки, пеленание, положение кенгуру, материнский контакт). Эти методы в свою очередь способствуют активации воротного контрольного механизма на уровне спинного мозга, выработке эндогенных опиоидов (эндорфины, энкефалины), активации нейропептидов (холецистокинин), созданию мощного доминантного положительного раздражения рецепторов полости рта [16, 17]. Кроме того, раннее знакомство с болью влияет на то, как младенцы реагируют на боль в дальнейшей жизни [18].
Очевидно, что центральные анальгетики не могут быть использованы для обезболивания, связанного с редкими заборами крови. Поэтому очень важны простые, приемлемые и хорошо переносимые методы, чтобы уменьшить боль у новорожденных (сосание пустышки во время процедуры, использование раствора глюкозы или сахарозы через соску, кормление грудью, прослушивание музыки, пеленание, положение кенгуру, материнский контакт). Эти методы в свою очередь способствуют активации воротного контрольного механизма на уровне спинного мозга, выработке эндогенных опиоидов (эндорфины, энкефалины), активации нейропептидов (холецистокинин), созданию мощного доминантного положительного раздражения рецепторов полости рта [16, 17]. Кроме того, раннее знакомство с болью влияет на то, как младенцы реагируют на боль в дальнейшей жизни [18].
По литературным данным, имеются ограничения по рутинному использованию раствора сахарозы при болезненных процедурах у глубоко недоношенных детей [19, 20].
В настоящее время хорошо известно, что практически любое критическое состояние, особенно развившееся остро, на определенном этапе сопровождается развитием инсулиновой резистентности, нарушением толерантности к глюкозе, гипергликемией. Достаточно часто это состояние в литературе называют «диабетом повреждения или травмы».
Считают, что склонность недоношенных новорожденных к гипергликемии обусловлена, с одной стороны, высоким уровнем контринсулярных веществ: катехоламинов, цитокинов, провоспалительных белков, а с другой – незрелостью клеток поджелудочной железы, не способной увеличивать выработку инсулина в ответ на углеводную нагрузку [21]. Контринсулярные гормоны обеспечивают регуляцию гомеостаза в норме и в условиях критического состояния. При этом необходимо учитывать, что длительная гипергликемия, подобно тому, как это происходит при гестационном сахарном диабете у женщин, может вызвать как снижение синтеза инсулина, так и снижение чувствительности тканей к нему [22]. Вышеперечисленное отчасти объясняет склонность детей с задержкой внутриутробного роста как к гипо-, так и гипергликемиям.
Среди недоношенных детей гипергликемия встречается в 45– 80%.[23]. Глюкоза крови является одним из компонентов внутренней среды организма, и концентрация ее в крови поддерживается на относительно постоянном уровне. Крайне важен точный мониторинг уровня глюкозы в крови, так как отклонения в гомеостазе глюкозы могут иметь серьезные последствия. Гипергликемия, особенно длительная, связана с повышенной заболеваемостью, в том числе возникновением внутрижелудочкового кровоизлияния и ретинопатии, а также смертностью, особенно у детей с очень низкой (ОНМТ) и экстремально низкой массой тела (ЭНМТ) [24].
Цель исследования: оценить гликемический статус у детей с ЭНМТ и ОНМТ при выполнении болезненных манипуляций (укол пальца) и применение нефармакологических методов обезболивания.
Материал и методы исследования
Обследованы 43 новорожденных (из них 22 ребенка с ЭНМТ, 21 ребенок с ОНМТ при рождении), находившиеся в отделении реанимации и интенсивной терапии ФГБУ НЦАГиП им. академика В.И. Кулакова. Гестационный возраст детей составил (M±SD (min-max)) 29,3±1,9 (26–33) недели, масса тела при рождении 1104,4±294,8 (450–1500) г. Всем детям определяли уровень гликемии во время взятия анализа крови из пальца на 3-й недели жизни (16,5±6,3 сутки жизни) (в момент проведения манипуляции и через 30 мин после нее). Определение уровня глюкозы в капиллярной крови проводили с помощью анализатора глюкозы крови, анализатора газов крови с опциями определения глюкозы в крови. Для количественной объективной оценки боли использовали аналгезиметр MedStorm. Кроме того, для оценки боли использовали пятибалльную шкалу Прехтла (Prechtl’s Five Point Scale) (табл. 1).
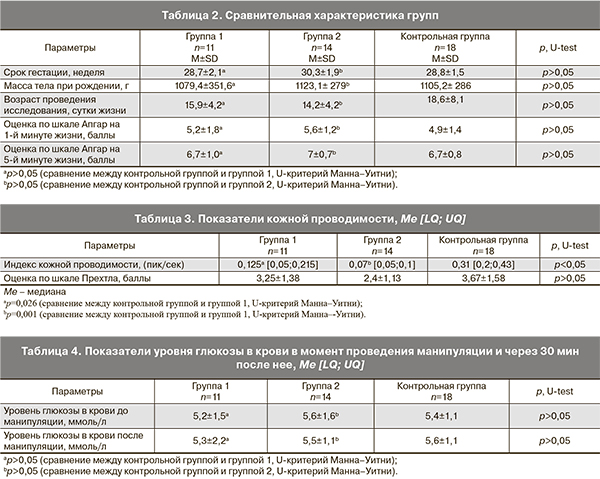
Все дети были поделены на три группы. 1-ю группу составили 11 детей, которым проводили обезболивание раствором глюкозы. За 2 минуты до болезненной процедуры ребенку через соску предлагали раствор 20% глюкозы 0,5 мл/кг. 2-ю группу составили 14 новорожденных, которым во время болезненной процедуры в качестве обезболивания использовали пустышку. Сравнение проводили с контрольной группой, которую составили 18 пациентов (без обезболивания). Группы были сравнимы по основным характеристикам. Показатели кожной проводимости оценивали через 1 минуту после болевого воздействия. Сравнительная характеристика групп приведена в табл. 2.
Статистическую обработку данных выполняли с использованием пакета прикладных программ IBM SPSS Statistics 21. Количественные признаки, имевшие нормальное распределение, описывали средними и среднеквадратическими отклонениями (М±SD); не имевшие нормального распределения описывали медианами и квартилями (Ме [LQ; UQ]). Для количественных признаков сравнение несвязанных групп проводили с использованием непараметрического теста Манна–Уитни (U-test). Различия считали статистически значимыми при достигнутом уровне значимости р<0,05.
Результаты исследования
Во время болевой процедуры у всех детей количество волн кожной проводимости и их амплитуда повышались, а после манипуляции возвращались к первоначальным значениям. Динамика этих показателей соответствовала изменению поведения ребенка во время болевой процедуры во всех группах (оценка по шкале Прехтла составила 3,26±1,5 балла). При исследовании кожной проводимости во время укола пальца получены различия в значениях пик/сек между контрольной группой и при применении 20% раствора глюкозы (Me=0,31 [0,2;0,43] Hz и Me=0,125 [0,05;0,215] Hz соответственно, р=0,026, U-критерий Манна–Уитни). Между контрольной группой и при применении пустышки (Me=0,31 [0,2;0,43] Hz и 0,07 [0,05;0,1] Hz соответственно, р=0,001, U-критерий Манна–Уитни). Количество пиков в секунду говорит о степени возбуждения симпатических нервов. Этот параметр увеличивается при повышении поведенческого статуса. В обеих группах уровень гликемии оставался в пределах нормативных значений как в момент проведения манипуляций, так и через 30 мин после болезненной процедуры (уровень гликемии в группе 1 – 5,2±1,5 ммоль/л до процедуры, после 5,3±2,2 ммоль/л; во группе 2 до процедуры – 5,6±1,6 ммоль/л, после – 5,5±1,1 ммоль/л; в контрольной группе соответственно до процедуры 5,4±1,1 ммоль/л, после – 5,6±1,1 ммоль/л).
Выводы
Мониторинг кожной проводимости (показатель пик/сек) показывает высокую чувствительность в выявлении острой боли у новорожденных во время манипуляций.
Применение пустышки и 20% раствора глюкозы через соску до и во время укола пальца оказывает одинаковый анальгетический эффект и эффективно по показателям кожной проводимости снижает стрессовую реакцию.
При использовании нефармакологических методов дети быстрее возвращаются к исходному состоянию по сравнению с новорожденными, у которых процедуры проводились без аналгезии.
Применение с целью обезболивания 20% раствора глюкозы перорально не сопровождается развитием гипергликемии у глубоко недоношенных детей.