Эндометриоз – эстроген-зависимое заболевание с локализацией ткани эндометрия за пределами полости матки. Наряду с наиболее распространенными наружным генитальным эндометриозом и аденомиозом, в 1–2% случаев гетеротопические очаги эндометрия обнаруживают на органах мочевыводящей системы, из них чаще всего (до 84% случаев) с поражением мочевого пузыря (МП) [1, 2].
Среди пациенток с глубоким инфильтративным эндометриозом частота поражения органов мочевыводящей системы составляет 19–53% случаев [3]. Имеется множество ретроспективных, но не сравнительных исследований по лечению эндометриоза мочевыводящей системы, поэтому консенсусы и практические рекомендации отсутствуют.
При эндометриозе МП эндометриальные железы и цитогенная строма с различной степенью клеточной инфильтрации локализуются в стенке органа, наиболее часто – в основании и верхушке. Гетеротопии МП почти в 90% случаев ассоциированы с другими очагами в малом тазу (поверхностные перитонеальные гетеротопии, овариальные эндометриомы, адгезии и глубокий экстравезикальный перитонеальный эндометриоз), свидетельствуя о том, что эндометриоз МП следует рассматривать не как независимую форму заболевания, а как проявления эндометриоидной болезни [4, 5].
Эндометриоз МП часто протекает как рецидивирующий цистит с ирритативными симптомами («нижнего мочевого тракта»), такими как поллакиурия, дизурия, гематурия и, менее часто, болевым симптомом и инконтиненцией [6], которые могут усиливаться во время менструации либо имеют нецикличный характер.
Хирургическое лечение эндометриоза МП – терапия первого выбора при наличии крупных и глубоких очагов (>5 мм) и у молодых женщин, поскольку гормонотерапия эндометриоза откладывает решение вопроса о рождении ребенка и в целом не улучшает фертильность [7].
Хирургическая тактика лечения эндометриоза МП определяется локализацией и размерами гетеротопии; поэтому возможна как послойная трансуретральная резекция очагов, так и секторальная резекция стенки органа лапароскопическим доступом. В случаях, когда гетеротопии превышают 5–10 мм, комбинированный цистоскопический и лапароскопический доступ является предпочтительным с целью минимизации резекции [8].
Представляем собственное клиническое наблюдение эндометриоза МП в аспекте современных данных о клинике и стратегиях медикаментозного и хирургического лечения данной патологии.
Пациентка Е., 39 лет, 27.02.2017 года поступила на плановое оперативное лечение с предоперационным диагнозом «экстрагенитальный эндометриоз: эндометриоидный инфильтрат мочевого пузыря» в урологическое отделение ГБУЗ Новосибирской области Государственная новосибирская областная клиническая больница, являющейся клинической базой кафедры урологии и кафедры акушерства и гинекологии Новосибирского государственного медицинского университета.
В соматическом анамнезе: вторичная реактивная перераспределительная трансфузия тромбоцитов между тканевыми и кровяными секторами без признаков тромбоцитопении, остаточные проявления наследственной тромбоцитарной дисфункции. Гемангиома печени. Хронический неатрофический гастрит с дискинетическим вариантом неязвенной диспепсии. Синдром раздраженной кишки с наклонностями к диарее. Полип прямой кишки 0,5 см. Хронический геморрой I стадии.
В аллергологическом анамнезе – поливалентная аллергия на антибактериальные препараты: аминогликозиды (отек Квинке) и пенициллиновую группу (аллергический дерматит).
Акушерско-гинекологический анамнез: менархе в 16 лет, нарушение овариально-менструального цикла по типу опсоменореи (длительность цикла 30–60 дней). В 2014 г. гистерорезектоскопия по поводу полипа эндометрия (гистология – эндометриальный полип, пролиферативный вариант). Беременностей не было.
Эндометриоидная болезнь пациентке верифицирована в 2006 г. В октябре 2006 г. проведено оперативное лечение в объеме лапаротомии, энуклеации эндометриомы левого яичника и миомэктомии без вскрытия полости матки. Послеоперационный диагноз: наружный генитальный эндометриоз II стадии: эндометриоидная киста левого яичника; интерстицио-субсерозная миома тела матки. Гистологическое заключение – эндометриоидная киста яичника, лейомиома тела матки.
После операции в течение 2 месяцев пациентка получала аналог гонадотропин-рилизинг-гормона – гозерелин, затем в течение 6 лет проводилась комбинированная терапия эстрогенами и прогестагенами (левоноргестрел+этинилэстрадиол).
В январе 2014 г. пациентке по поводу миомы тела матки выполнена эндоваскулярная эмболизация маточных артерий. В феврале того же года проведено оперативное лечение в объеме лапароскопии, миомэктомии без вскрытия полости матки, иссечения брюшины малого таза с очагами эндометриоза и эндометриоидного инфильтрата в области левой крестцово-маточной связки. Послеоперационный диагноз: интерстицио-субсерозная миома тела матки; наружный генитальный эндометриоз III стадии, инфильтративная форма: эндометриоз брюшины левой крестцово-маточной связки, ретроцервикальный эндометриоз. Гистологическое заключение: лейомиома тела матки, эндометриоз брюшины. Гормональное лечение после повторной операции не проводилось.
С января 2016 г. субъективно пациентка отмечала интенсивные периодические режущие боли внизу живота и учащенное мочеиспускание во время менструации. К урологу не обращалась.
В мае 2016 г. проведено инструментальное обследование. По данным ультразвукового исследования органов малого таза, подозрение на опухоль мочевого пузыря. С целью уточнения топографии и характеристик обнаруженного образования проведена магнитно-резонансная томография органов малого таза с внутривенным контрастированием, по данным которой выявлено (рис. 1, а–г): верхне-правая поверхность мочевого пузыря вдавлена и деформирована, стенка мочевого пузыря на 9–10 часах условного циферблата в аксиальной плоскости локально инфильтрирована с наличием неплотного образования (2,5×3×2 см), вдающегося в просвет органа: поверхность образования неровная; на T2-взвешенных изображениях преимущественно гипоинтенсивный сигнал, в структуре – мелкие геморрагические включения (характеристики сигнала образования наиболее характерны для эндометриоза); между стенкой мочевого пузыря на уровне образования и поверхностью правого яичника – признаки спаечного процесса; содержимое мочевого пузыря гомогенное, конкрементов не выявлено; тазовые отделы мочеточников не расширены; пузырная поверхность матки деформирована, в передней стенке матки, ближе к дну, трансмуральный миоматозный узел (2,7×2,5 см), убедительного накопления контрастного вещества в узле не выявлено.

Для верификации диагноза проведена цистоскопия (рис. 2) с биопсией слизистой оболочки мочевого пузыря: по задней стенке мочевого пузыря, больше справа, визуализировано ворсинчатое образование на широком основании с отеком слизистой оболочки и кровоизлияниями. Гистологическое заключение – хронический эрозивный буллезный цистит с очагами умеренной и тяжелой дисплазии слизистой оболочки. При повторном исследовании биоптата – инвертирующая переходно-клеточная папиллома с хроническим неспецифическим воспалением.
Рекомендовано оперативное лечение, от которого пациентка отказалась.
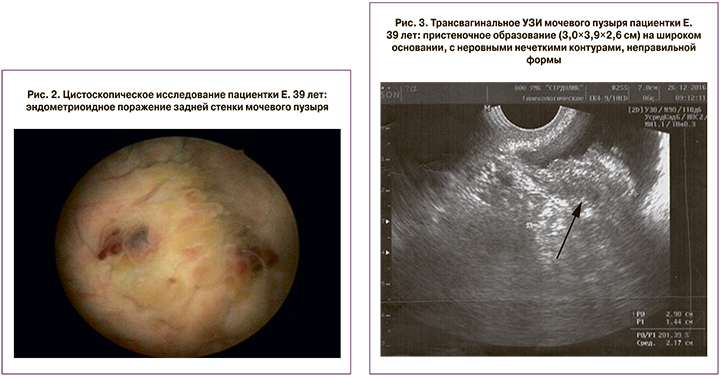
С сентября 2016 г. к вышеуказанным жалобам присоединилась макрогематурия во время менструации. По данным ультразвукового исследования мочевого пузыря в декабре 2016 г., выявлено очаговое пристеночное образование (3,0×3,9×2,6 см) на широком основании, с неровными нечеткими контурами, неправильной формы (рис. 3), с неоднородной внутренней структурой, анэхогенными внутренними мелкими включениями и низкорезистентным артериальным кровотоком в питающем сосуде при цветовом допплеровском картировании (отрицательная динамика от мая 2016 г.). Амбулаторно назначен агонист гонадотропин-рилизинг-гормона (трипторелин) с положительным эффектом – циклический болевой синдром и макрогематурия купированы.
В январе 2017 г. при контрольных ультразвуковом исследовании и магнитно-резонансной томографии органов малого таза выявлена положительная динамика – уменьшение размеров образования в стенке мочевого пузыря (2,0×2,5×1,5 см). Пациентка осмотрена гинекологом и урологом: выставлен диагноз – эндометриоидный инфильтрат мочевого пузыря и рекомендовано оперативное лечение.
28.02.2017 г. – лапаротомия по Пфанненштилю. При ревизии брюшной полости: в малом тазу выраженный спаечный процесс – произведено разъединение спаек. На передней стенке матки – интерстицио-субсерозная миома размером до 1,5 см. Произведена миомэктомия, ложе узла ушито узловыми викриловыми швами. Цистотомия задней стенки мочевого пузыря. При ревизии мочевого пузыря – в верхушке, с переходом на заднюю стенку – эндометриоидный инфильтрат диаметром до 3 см. Выполнена резекция мочевого пузыря в пределах здоровых тканей, целостность мочевого пузыря восстановлена двурядным викриловым швом. Экстраперитонизация. Дренирование паравезикального пространства справа. В мочевой пузырь введен катетер Фолея № 16 Ch.
Послеоперационный диагноз – экстрагенитальный эндометриоз: эндометриоидный инфильтрат мочевого пузыря. Интерстицио-субсерозная миома тела матки.
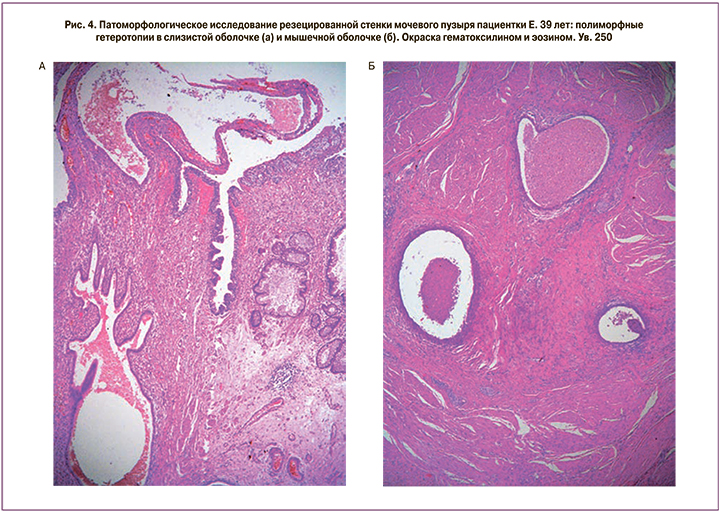
Данные гистологического исследования от 07.03.2017 г.: эндометриоз мочевого пузыря (рис. 4, а, б); лейомиома тела матки.
Послеоперационных осложнений согласно классификации Clavien-Dindo не было. Пациентка выписана в удовлетворительном состоянии. При динамической цистоскопии через 3 месяца: емкость мочевого пузыря 170 мл, слизистая оболочка бледно-розовая, устья в типичном месте, обычные, зона резекции белесоватая. Удалена пролабирующая инкрустированная легко распадающаяся нить до 3 мм. Патологических образований не выявлено.
Планируется динамический контроль и длительное гормональное лечение до возраста естественной менопаузы. Репродуктивных планов на момент курации у пациентки не было.
Обсуждение
Дисменорея, цикличная дизурия и надлобковая боль – наиболее частые симптомы, связанные с эндометриозом МП; из них у пациентки Е. дизурия и дисменорея были ведущими. Тот факт, что гетеротопии локализовались преимущественно в мышечной оболочке МП, и лишь часть из них проникала в слизистую оболочку, объясняет отсутствие гематурии в межменструальный период. Гетеротопии мочевого пузыря прогрессировали в стенке органа снаружи в направлении к слизистой оболочке, как в данном клиническом наблюдении.
Частичная цистэктомия для лечения эндометриоза МП является органосохраняющей операцией, которая может быть выполнена как лапаротомически, так и лапароскопически. Выбор лапаротомии обусловлен спаечным процессом в малом тазу по данным методов визуализации и с учетом анамнеза пациентки.
По данным U. Leone Roberti Maggiore и соавт. [8], частичная цистэктомия высокоэффективна, с хорошими долгосрочными результатами в отношении рецидивов. Единственным прогностическим фактором в отношении рецидива эндометриоза МП является объем хирургического вмешательства с необходимостью удаления дополнительных очагов, например, аденомиоза в передней стенке матки; и нет зависимости от возраста пациенток, предварительной хирургии эндометриоза, паритета и беременности после операции.
Даже при наличии благоприятных долгосрочных результатов у большинства женщин, важно учитывать сложность хирургии эндометриоза МП и риск послеоперационных осложнений: денервацию органа, пузырно-вагинальную или мочеточниковую фистулу [8]. Кроме того, хирургическое лечение эндометриоза МП может быть осложнено протечкой швов из-за непроходимости мочевого катетера в течение первой послеоперационной недели, поэтому перед удалением катетера необходима цистоскопия. Чтобы избежать такого осложнения и повторной операции, требуется длительная катетеризация мочевого пузыря.
В целом, наш опыт подтверждает предыдущие сообщения о том, что оперативное лечение эндометриоза МП может быть успешно выполнено с благоприятными долгосрочными результатами.
Заключение
Представленное клиническое наблюдение эндометриоза МП является достаточно редким, характеризуется неспецифическими симптомами, быстрым прогрессированием и мимикрией опухолевого процесса. Эндометриоз МП следует включать в круг дифференциальной диагностики у женщин с генитальным эндометриозом в анамнезе, а также с цикличным характером болевого симптома и макрогематурии, купируемыми анти-эстрогеновыми препаратами. Кооперация гинеколога и уролога позволила успешно провести хирургическое лечение эндометриоза МП.



