На современном этапе развития репродуктивной медицины эффективность программ экстракорпорального оплодотворения (ЭКО) может достигать 30–40%. Однако в ряде случаев использование вспомогательных репродуктивных технологий (ВРТ) сопровождается тяжелыми осложнениями, наиболее опасным из которых является синдром гиперстимуляции яичников (СГЯ). Тяжелые формы СГЯ характеризуются риском развития тромбозов, полифункциональными нарушениями, что может стать причиной летального исхода [1–3].
Поиск технологий ВРТ, наиболее сбалансированных с точки зрения эффективности стимуляции овуляции и минимального уровня риска СГЯ и низкой частоты многоплодной беременности, остается в фокусе внимания исследователей. Применение протоколов с антагонистами гонадотропин-рилизинг-гормона (ант-ГнРГ) для контролируемой стимуляции функции яичников позволяет значительно снизить риск СГЯ как за счет более щадящей стимуляции, так и прежде всего за счет возможности использования в качестве триггера овуляции агонистов ГнРГ (а-ГнРГ) [4–6]. Ранее нами был представлен анализ современного состояния научных исследований по использованию а-ГнРГ в качестве триггера овуляции [7]. M. Youssef с соавт., проанализировав результаты 11 контролируемых исследований, пришли к выводу, что использование а-ГнРГ в качестве триггера овуляции позволяет практически исключить риск СГЯ, однако клиническое его применение в «свежих» циклах приводило к значительному снижению частоты наступления беременности в результате недостаточности лютеиновой фазы [8]. В работах P. Humaidan с соавт. [9, 10] и B.S. Shapiro с соавт. [11] было показано, что за счет модифицированного ведения лютеиновой фазы с использованием а-ГнРГ в качестве триггера овуляции удается получить частоту наступления беременности, сравнимую с таковой при использовании классического триггера овуляции, избегая возникновения СГЯ.
Цель исследования: оценить влияние типа триггера овуляции на клинические и эмбриологические индикаторы эффективности программ ЭКО/ИКСИ у пациенток с нормальным ответом яичников на стимуляцию суперовуляции.
Материал и методы исследования
В исследование были включены 250 женщин в возрасте от 21 до 39 лет, которым проводили циклы ЭКО/ИКСИ в 1-м гинекологическом отделении ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. Для стимуляции яичников использовали протокол с ант-ГнРГ. Использовались препараты рекомбинантного ФСГ (фоллитропин-α и β) и/или очищенного человеческого менопаузального гонадотропина со 2–3-го дня менструального цикла в дозах 112,5–300 МЕ, подобранных индивидуально в зависимости от овариального резерва и предполагающих получение до 15 ооцитов. Ант-ГнРГ (цетрореликс в дозе 0,25 мг) назначали по гибкой схеме: с момента достижения лидирующими фолликулами диаметра 14–15 мм до дня введения триггера овуляции. Триггер овуляции вводился по достижении по меньшей мере 3 фолликулами диаметра 17–18 мм. В качестве триггера овуляции были использованы либо препараты хорионического гонадотропина человека (ХГЧ) (прегнил) в дозе 10 000 МЕ, либо а-ГнРГ (трипторелин 0,2 мг) однократно. Трансвагинальная пункция фолликулов (ТВП) производилась через 36–37 часов после введения триггера овуляции под внутривенной анестезией с использованием игл 19G (Swemed, Sweden). В случае использования в качестве триггера а-ГнРГ для поддержания нормальной функции желтых тел однократно в день ТВП вводился ХГЧ в дозе 1 500 МЕ. Поддержка посттрансферного периода проводилась с использованием микронизированного прогестерона (утрожестан) в дозе 600 мг интравагинально, в случае применения в качестве триггера овуляции а-ГнРГ – в сочетании с эстрадиола валератом (прогинова, 4 мг/сут.) со следующего дня после ТВП. Беременность устанавливалась путем определения β-субъединицы ХГЧ на 14-й день после ТВП. Оплодотворение ооцитов и культивирование эмбрионов до 3–5 суток проводилось с использованием последовательных сред компании Origio (Denmark). ИКСИ производилось при наличии соответствующих показаний.
Пациентки были разделены на 2 группы с учетом введенного триггера овуляции: I группу составили 125 пациенток, получивших в качестве триггера овуляции ХГЧ, II – 125 пациенток, получивших а-ГнРГ.
Результаты исследования оценивались по следующим показателям: частота наступления клинической беременности; кумулятивная частота наступления беременности, частота имплантации, эмбриологическим показателям, а также частота СГЯ. Факт клинической беременности устанавливался по данным ультразвукового исследования (наличие плодного яйца, с/б+) через 2–3 недели после положительного β-ХГЧ. В группах рассчитывались средние: число полученных ооцитов; доля зрелых ооцитов; частота оплодотворения. Качество развития эмбрионов оценивались по: частоте бластуляции; доле эмбрионов высокого качества; средней скорости их деления.
Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как среднее ± ошибка среднего (М±m). Значимость наблюдаемых отклонений оценивали с помощью t-критерия Стьюдента с использованием пакета статистического анализа StatSoftStatistica 10.0 и IBMSPSS Statistics, версия 22.
Статистически значимыми считали отличия при р<0,05.
Результаты и обсуждение
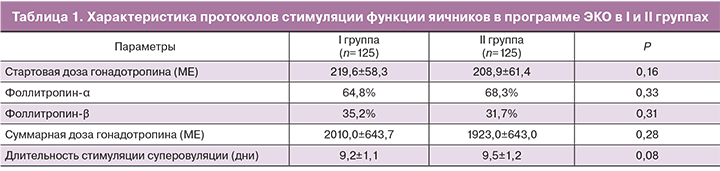
По демографическим показателям исследуемые группы не различались. Средний возраст женщин в I группе составил – 31,5±3,6 года, во II группе – 30,7±3,7 года (р>0,05). Средние показатели индекса массы тела в обеих группах составили 22,6±3,3 и 22,2±2,9 соответственно (р>0,05). Пациентки в исследуемых группах были сопоставимы по параметрам овариального резерва (уровень ФСГ 6,4±2,03 и 6,5±2,14 МЕ/л, АМГ 3,89±2,36 и 3,92±1,96 нг/мл, число антральных фолликулов 13,79±3,86 и 14,27±2,87 в I и II группах соответственно, р>0,05). Не имелось статистически значимых различий между I и II группами по продолжительности стимуляции (табл. 1).
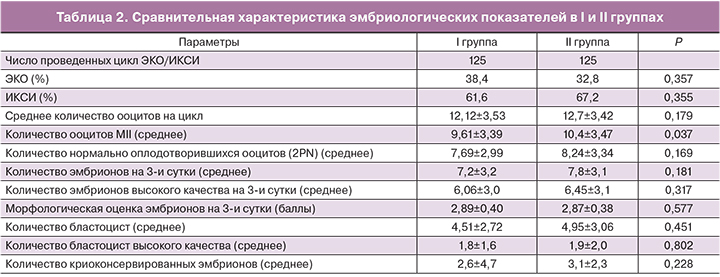
Среднее число полученных ооцитов в I и II группе составило 12,1±3,5 и 12,7±3,4 соответственно (p>0,05). Выявлена статистически значимая разница между группами по среднему количеству зрелых (MII) ооцитов – 9,6±3,4 и 10,4±3,5 (p=0,037) соответственно. Следующие параметры эмбриогенеза были сопоставимы в обеих группах: средняя частота оплодотворения – 80 и 79%, средняя частота дробления зиготы – 97,5 и 96,6%, частота образования бластоцист – 55,38 и 58,69% соответственно. Количество эмбрионов высокого качества на 3-и сутки составило 6,05±3,04 и 6,4±3,12, p>0,05.Частота имплантации эмбрионов была выше во II группе (33,75%) в сравнении с I группой (25,62%). Исходя из полученных нами данных, можно сделать вывод, что замена триггера овуляции на а-ГнРГ не оказывает негативного влияния на эмбриологический этап программы ЭКО, что согласуется с данными Acevedo (2006) и Imbar (2012) [12, 13].
В I и II группах частота наступления беременности на перенос составила 48,78 и 48,71% соответственно. Клинические беременности в I группе регистрировались у 41,46%, во II группе у 42,73% пациенток. Частота прерывания беременности в группе с а-ГнРГ (20%) в сравнении с группой с ХГЧ (17%) достоверно не различались. Частота многоплодной беременности составила 9,8 и 12%, частота родов 28,45 и 28,20% в I и II группах соответственно. Как и в исследованиях P. Humaidan [9, 10], в нашей работе не выявлено статистической разницы в эффективности программ ЭКО; это свидетельствует о том, что при модифицированной поддержке лютеиновой фазы замена триггера овуляции не снижает частоту наступления беременности в циклах ЭКО.
Было выявлено статистически значимое различие по частоте развития СГЯ легкой степени (p<0,02): в I группе она составила 16/,9% (n=22), во II – 6,5% (n=9) соответственно. Статистически значимых различий при сравнении частоты СГЯ средней степени тяжести в исследуемых группах не было: в I группе – 5,4% (n=7), во II группе – 4,3% (n=6). У 2 пациенток в I группе развился СГЯ тяжелой степени, что потребовало госпитализации пациенток для проведения стационарного лечения. Не было зарегистрировано ни одного случая развития тяжелого СГЯ в группе с применением а-ГнРГ. По результатам нашего исследования было доказано, что частота развития СГЯ в группе пациентов с нормальным овариальным ответом снижается при введении а-ГнРГ, что свидетельствует об эффективности использования замены триггера овуляции в целях профилактики развития СГЯ.
Заключение
Использование а-ГнРГ для финального созревания яйцеклеток в настоящее время может быть хорошей альтернативой ХГЧ у пациенток с нормальным ответом яичников на стимуляцию суперовуляции. Использование а-ГнРГ в качестве триггера овуляции в протоколах с ант-ГнРГ дает возможность добиться частоты наступления беременности при модификации лютеиновой фазы аналогичной таковой при назначении ХГЧ. При этом частота развития СГЯ средней и тяжелой степени сводится к минимуму.



