Проблема выбора тактики ведения беременности при наличии онкогематологического заболевания является предметом пристального внимания как акушеров-гинекологов, так и гематологов.
Наиболее распространенным типом онкогематологических новообразований из встречающихся во время беременности являются лимфомы (1 на 1000–6000 беременностей) [1]. Лимфома Ходжкина (ЛХ) встречается у молодых женщин значительно чаще, чем неходжкинские лимфомы (НХЛ). ЛХ диагностируется преимущественно у молодых женщин репродуктивного возраста (15–34 года), и при своевременно начатом лечении заболевание имеет благоприятный прогноз [2]. НХЛ возникают, как правило, у женщин в более позднем возрасте (после 30 лет), отличаются агрессивным течением и в большинстве случаев требуют своевременного начала противоопухолевой терапии [2]. Согласно данным [3], опубликованным международным обществом «Рак и беременность», современные программы лечения дают возможность существенно увеличить число сохраненных беременностей среди пациенток с онкологическими заболеваниями, а также увеличить на 20% частоту применения химиотерапии (ХТ) во время беременности.
В данной работе проведен анализ эволюции подходов к ведению беременности в результате 31-летнего наблюдения женщин с различными видами лимфом, диагностированных во время беременности. Изучены особенности течения беременности и проанализированы материнские и перинатальные исходы у пациенток с лимфомами в зависимости от проводимого противоопухолевого лечения во время беременности. Выявлены основные факторы, влияющие на здоровье детей, рожденных у матерей с лимфомами. Проанализированы результаты долгосрочного наблюдения за состоянием здоровья матери и ребенка.
Материалы и методы
В ходе исследования проведена оценка тактики ведения беременности, здоровья новорожденных, а также для 70 женщин дан прогноз заболевания, которое было выявлено во время настоящей беременности. ЛХ диагностирована у 46 женщин, а НХЛ – у 24. Мы выделили 3 группы беременных в зависимости от времени и тактики их наблюдения: с 1987 по 2000 гг. (1-я группа) – ретроспективная, когда лечение лимфом во время беременности не проводилось (n=7, из них с ЛХ – 7, с НХЛ – 0); с 2001 по 2013 гг. (2-я группа) – проспективная, во время беременности проводилось противоопухолевое лечение, и пациенток в основном досрочно родоразрешали на 34–35 неделе (n=26, из них с ЛХ – 15, с НХЛ – 11); с 2014 по сентябрь 2018 гг. (3-я группа) – проспективная, пациенткам проводилась ХТ во время беременности, родоразрешение предпочтительно в доношенном сроке (n=37, из них с ЛХ – 24, с НХЛ –13).
Клинический диагноз был установлен на основании стандартных методов диагностики лимфом. У всех пациенток проводилось гистологическое и иммуногистохимическое исследование биоптата лимфатических узлов. Стадию заболевания устанавливали в соответствии с классификацией Ann-Arbor (1971 г.) и с дополнениями к ней, предложенными в Cotswolds (1989 г.). Стадирование заболевания определялось на основании ультразвукового и рентгенографического исследований. При рентгенографии легких для защиты плода использовался специальный свинцовый фартук. В случае необходимости для уточнения стадии заболевания проводилась билатеральная трепанобиопсия подвздошной кости. Магнитно-резонансная томография (МРТ) проводилось при наличии у пациентки синдрома сдавления верхней полой вены или признаков компрессии воздухоносных путей и пищевода. У всех беременных женщин были проведены клинический анализ крови, биохимический анализ крови и оценено состояние системы гемостаза.
На протяжении всей беременности проводилось динамическое наблюдение за состоянием здоровья плода при помощи ультразвукового исследования (УЗИ), допплерометрии и кардиотокографии.
С целью определения общей и безрецидивной выживаемости женщин с онкогематологическими заболеваниями и изучения отдаленных результатов здоровья их детей нами был проведен однократный опрос пациенток (диапазон времени опроса от 6 месяцев до 16 лет после родоразрешения).
Статистический анализ. Статистическая обработка данных выполнялась при помощи программного пакета IBM SPSS Statistics 21. Количественные данные, при условии нормального распределения признаков, были представлены в виде средних значений со стандартным отклонением (t-тест), при ненормальном распределении признаков – в виде медианы (тест Манна–Уитни). Качественные показатели представлены как в абсолютных, так и в относительных величинах. Для сравнения категориальных данных в 2 группах, а также для оценки значимых различий между ними использовали тест Фишера при помощи таблиц сопряжения.
Результаты
Средний возраст пациенток при постановке диагноза злокачественного заболевания у беременных с ЛХ составил 26,2 (4,1) года, а с НХЛ – 30,9 (4,2) года. Первобеременных было 39, повторнобеременных – 31, из них 47 – первородящих, 23 – повторнородящие. Из повторнородящих у 21 женщины были вторые, а у двух – третьи и четвертые роды.
В I триместре беременности заболевание вне зависимости от типа лимфомы было диагностировано у 8 (11,5%) пациенток, во II триместре – у 53 (75,7%) пациенток и в III триместре – у 7 (10%) пациенток. Средний срок беременности, при котором была диагностирована лимфома, составил 19,3 (6,4) недели (19,7 (6,6) и 18,5 (6,0) недели при ЛХ и НХЛ соответственно, p=0,44). В группе пациенток с ЛХ было по 1 случаю наступления беременности на фоне проведения лучевой терапии (1,4%) и ХТ (1,4%). У 4 пациенток во время беременности выявлен рецидив ЛХ, у одной из них через 10 лет после окончания ХТ, у остальных – через 2–3 года.
Необходимо отметить, что при ЛХ встречались менее агрессивные гистологические варианты, чем при НХЛ. У беременных с ЛХ превалировал гистологический вариант опухоли – нодулярный склероз I и II типа (86,9%). При НХЛ наиболее распространенными были: диффузная В-крупноклеточная лимфома (41,6%) и первичная медиастинальная В-крупноклеточная лимфома (33,3%). Относительно небольшую группу пациенток с НХЛ составляли беременные женщины с фолликулярной лимфомой (8,3%), В-клеточной лимфомой из клеток маргинальной зоны селезенки (4,2%), анапластической крупноклеточной лимфомой (ALK-позитивная) (4,2%), лимфомой Беркитта (4,2%) и волосатоклеточным лейкозом (4,2%).
В 1-й группе (n=7) прерывание беременности по медицинским показаниям (заключение онкогематолога) было произведено в I и II триместрах беременности 4 пациенткам (57,1%) с ЛХ.
Во 2-й группе (n=26) прерывание беременности произведено в 2 (7,7%) случаях: в 1-м случае – прерывание в I триместре беременности по желанию пациентки; во 2-м случае – прерывание беременности в 16 недель у пациентки с НХЛ в связи с развитием тяжелой дыхательной недостаточности (многодетная мать: 3 живых детей). В 1 (3,8%) случае у пациентки с ЛХ и врожденной тромбофилией высокого риска (гетерозиготные мутации Лейдена и протромбина), которой не проводилась ХТ, произошел поздний выкидыш на сроке 24 недели (до 2012 г. к поздним выкидышам относились случаи прерывания беременности до 28 недели).
В 3-й группе (n=37) 1 (2,7%) пациентке с НХЛ, получившей 1 курс ХТ по схеме R-CHOP, в 6 недель беременности было произведено ее прерывание в связи с известной тератогенностью ХТ в I триместре.
В группах наблюдения ХТ была проведена 35 (50%) беременным. В 1-й группе лечение получала лишь одна пациентка с ЛХ (14,3%). Во 2-й группе лечение проводилось 10 (38,5%) пациенткам. В 3-й группе ХТ была проведена 24 (64,9%) беременным.
Лечение было отложено до послеродового периода у 27 (38,6%) беременных из трех групп: у 21 (45,6% всех пациенток с ЛХ) пациентки с ЛХ и почти в 2 раза реже – при НХЛ – 6 (25% всех пациенток с НХЛ).
Таким образом, за 31-летний период отмечены значительное снижение частоты искусственного прерывания беременности с 57,1 до 2,7% и увеличение частоты использования ХТ с 14,3 до 64,9%.
У 35 пациенток средний срок гестации при начале проведения ХТ составлял 24 (5,4) недели (от 15 до 35 недель). Программы лечения опухолевого заболевания подбирались онкогематологами в зависимости от гистологического типа опухоли, стадии и степени агрессивности заболевания. Дозы препаратов рассчитывались, исходя из фактической массы тела беременной пациентки. Беременным с ЛХ проводили лечение по программе ABVD в 9 (25,7%) случаях, по программе BEACOPP-14 – 3 (8,6%) пациенткам, по 1 (2,8%) случаю – по программам СОРР и ABVD+винбластин и 5 (14,3%) пациенткам была проведена монотерапия (винбластин). При НХЛ назначали более агрессивные схемы лечения: VACOP-B в 3 (8,6%) случаях, R-CHOP – в 4 (11,5%), R-EPOCH и EPOCH/DA-EPOCH – в 3 (8,6%) и 5 (14,3%) случаях соответственно, непрерывный прием интерферона-альфа – в 1 (2,8%) случае.
Основным осложнением течения беременности у женщин с лимфомами была анемия различной степени тяжести. Различия в частоте анемии в группах пациенток, получавших ХТ и без лечения, были статистически значимы: анемия наблюдалась в 71,4% случаев в группе с ХТ, а среди пациенток без лечения – в 44,4% случаев (p=0,03). Угроза прерывания беременности (угрожающий ранний/поздний выкидыш; угрожающие преждевременные роды) наблюдалась одинаково часто как у пациенток, получавших лечение (37,1%), так и у пациенток, не получавших лечение (44,4%), p=0,6. Плацентарная недостаточность с задержкой развития плода у беременных, получавших ХТ, встречалась у 8,6% пациенток, а у беременных, не получавших лечение, – у 3,7% (p=0,62). У одной из пациенток (3,7%) без лечения во время беременности развилась поздняя умеренная преэклампсия. У 2 (5,7%) женщин во время проведения ХТ беременность осложнилась пневмоцистной пневмонией и в 1 (2,8%) случае – развитием грамотрицательного сепсиса. Следует отметить, что у 6 (37,5%) женщин при НХЛ и у 1 (5,3%) при ЛХ на фоне проведения ХТ беременность осложнилась тромбозами вен различной локализации (яремной, полой, бедренной и подвздошной) в месте постановки внутривенного катетера при проведении ХТ, несмотря на антикоагулянтную терапию во время противоопухолевого лечения.
Таким образом, основным осложнением ХТ во время беременности были: анемия различной степени тяжести и катетер-ассоциированные венозные тромбозы (в большинстве случаев у пациенток с НХЛ, получавших ХТ). Частота остальных осложнений беременности не зависела от проведения ХТ.
Средний срок родоразрешения 62 пациенток составил 36,5 (2,7) недель (от 26 до 40 недель). Своевременными родами завершились 59,7% беременностей. Преждевременные роды произошли в 40,3% случаев. Родоразрешение на сроках от 26 до 34 недель было произведено у 8 женщин (в 12,9%), а от 34 до 37 недель – у 17 женщин (27,4% пациенток). Преждевременные роды при ЛХ наблюдались в 30% случаев. При НХЛ преждевременные роды были статистически значимо чаще – у 59,1% пациенток (p=0,03). Путем операции кесарева сечения были родоразрешены 58,1% пациенток, из них 21 – с ЛХ (52,5% от числа беременных с ЛХ) и 15 – с НХЛ (68,2% числа беременных с НХЛ), p=0,28. Метод родоразрешения не зависел от того, проводилось ли противоопухолевое лечение во время беременности (p=0,79). Досрочное оперативное родоразрешение в 80% случаев было связано с необходимостью начала/продолжения противоопухолевого лечения. Следует отметить, что сравнительный анализ частоты преждевременных родов 1-й и 2-й групп с 3-й группой показал статистически значимое снижение их с 57,7 до 27,8% в группах наблюдения (p=0,02), что было обусловлено пересмотром тактики ведения пациенток.
За период наблюдения родились 64 живых ребенка (в том числе 2 двойни). Средний вес детей при рождении составил 2751,2 (780,4) г (диапазон от 490 г до 4450 г). Вес новорожденных детей, матери которых во время беременности получали ХТ, не отличался от веса детей, рожденных у матерей без лечения (2623,8 (833,9) г против 2950,8 (656,3) г соответственно, p=0,11).
В группе наблюдения у женщин, получавших ХТ, родились 36 детей (в том числе 1 двойня). Из них 44,4% детей были недоношенными. У женщин, не получавших лечение, родились 28 детей (в том числе 1 двойня). В этом случае недоношенными были 39,3% детей. Отметим, что в 1-й и 2-й группах количество недоношенных детей почти в 2 раза выше, чем в 3-й группе.
Из 64 новорожденных 13 (50%) детей из 1-й и 2-й групп наблюдения и 8 (21,1%) детей из 3-й группы в связи с недоношенностью проходили лечение в отделении реанимации и интенсивной терапии новорожденных (ОРИТН). Срок нахождения в этом отделении составил в среднем 6,8 (3,6) дня (от 1 до 13 дней). Частота пребывания в ОРИТН новорожденных, матери которых получали во время беременности ХТ, не отличалась от частоты таковой у детей, рожденных у матерей без лечения (36,1% против 28,6%, p=0,59). Однако при сопоставлении групп женщин с ЛХ и НХЛ были выявлены статистически значимые различия по пребыванию новорожденных в ОРИТН. Так, детям, рожденным у пациенток с НХЛ, почти в 3 раза чаще требовалось лечение в условиях ОРИТН, чем детям пациенток с ЛХ (56,5 и 19,5% соответственно, p=0,01). На втором этапе выхаживания дети были переведены в отделение патологии новорожденных. Структура заболеваемости новорожденных приведена в таблице.
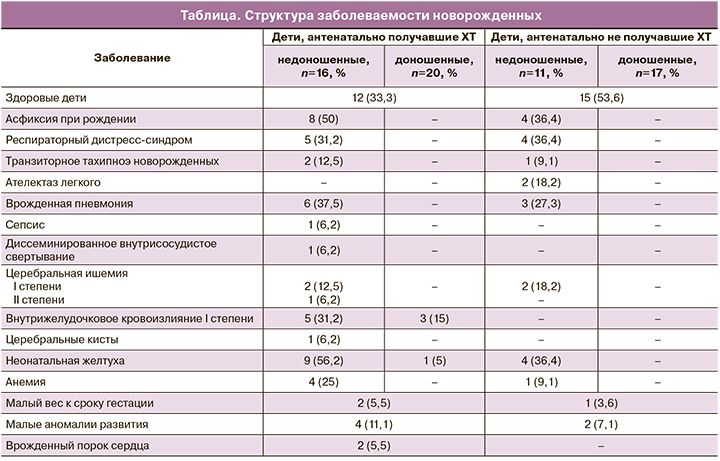
Ранняя неонатальная смертность наблюдалась в одном случае. У пациентки с привычным невынашиванием беременности в анамнезе (2 выкидыша) с ЛХ, с вовлечением внутригрудных лимфоузлов, легких, легочного ствола (статус больной по ECOG 2 балла), которой было выполнено 5 курсов ХТ (с 18 по 26 неделю) по схеме BEACOPP-14, течение беременности осложнилось развитием плацентарной недостаточности, задержкой роста плода, выраженным маловодием и анемией тяжелой степени (производилась трансфузия эритроцитарной массы). В связи с ухудшением состояния плода на сроке 26 недель произведена экстренная операция кесарева сечения. Родился мальчик массой 490 г с врожденной пневмонией, диссеминированным внутрисосудистым свертыванием, желудочно-кишечным кровотечением, легочным кровотечением, сепсисом. Ребенок умер на 2-е сутки жизни. Смерть мальчика была обусловлена его глубокой недоношенностью, задержкой в развитии, дыхательными расстройствами и инфекционными осложнениями.
У 36 детей, рожденных у матерей, получавших ХТ во время беременности, малые аномалии развития были выявлены в 11,1% случаев: по 1 случаю головчатой гипоспадии, двусторонней пиелоэктазии, врожденного стридора и врожденной мышечной косолапости, у 2 (5,5%) детей – врожденный порок сердца – дефект межжелудочковой перегородки. В группе детей, матери которых не получали ХТ (28 детей), были выявлены 2 (7,1%) случая пиелоэктазии.
Нами проведено проспективное наблюдение за 43 детьми, которые были рождены у матерей с онкологическими заболеваниями во время беременности. Период наблюдения – от 6 месяцев до 16 лет, среди основных вопросов были: перенесенные заболевания, проведение профилактических прививок, оценка физического и психического развития, использование антибактериальной и иммунотерапии и т.д. Недоношенные дети к концу первого года жизни соответствовали в физическом и умственном развитии своим ровесникам, не наблюдалось отклонений в состоянии сердечно-сосудистой системы.
Из 70 пациенток удалось проследить катамнез 43 женщин, у которых во время беременности была диагностирована лимфома (период наблюдения от 6 месяцев до 16 лет), не были отмечены случаи рецидива заболевания, и на момент написания статьи пациентки находятся в стойкой ремиссии.
Обсуждение
Сведения о тактике ведения беременности и лечении женщин с онкологическими заболеваниями, опубликованные в современной медицинской литературе, немногочисленны. Накопленный опыт позволяет выделить 3 варианта ведения беременности у пациенток с лимфопролиферативными заболеваниями: прерывание беременности, пролонгирование беременности с проведением лечения во II–III триместре, пролонгирование беременности с отсрочкой лечения до послеродового периода.
В 2013 г. в «Европейском журнале акушерства и гинекологии» были опубликованы результаты опроса практикующих врачей акушеров-гинекологов и онкогинекологов об их отношении к возможности лечения пациентов с онкологическими заболеваниями во время беременности [4]. По данным публикации, достаточно большая группа врачей (37%) рекомендовала полностью отказаться от проведения химио- или лучевой терапии во время беременности. За прерывание беременности в случае выявления онкологического заболевания в I или в начале II триместра беременности высказались 44% специалистов. В случае выявления онкологического заболевания во II и III триместрах 58% опрошенных отдали предпочтение проведению индукции преждевременных родов с последующим лечением в послеродовом периоде. По данным другого европейского исследования, 88% преждевременных родов были обусловлены требованием акушеров-гинекологов и онкологов родоразрешать пациентку и затем – лечить [3]. Поэтому до сих пор среди практикующих врачей отсутствует консенсус относительно вопросов, связанных с выбором варианта ведения беременности и срока родоразрешения.
Выбор программы ХТ для лечения беременных пациенток должен удовлетворять как минимум двум условиям: эффективно воздействовать на опухоль и не оказывать тератогенного влияния на плод. По мнению ряда исследователей [5, 6], при ЛХ локальной стадии предпочтительной программой лечения является схема ХТ ABVD (доксорубицин, блеомицин, винбластин и дакарбазин). В качестве разумной альтернативы применению ABVD в I триместре или при необходимости купировать симптомы болезни при выявлении заболевания на поздних сроках беременности и создать более благоприятные условия для родоразрешения ряд авторов рекомендуют монотерапию винбластином («мостиковая терапия») [7, 8]. В большинстве исследований винбластин демонстрирует более 75% ответа опухоли на лечение и минимальную токсичность для плода [7]. Однако после родоразрешения и полноценного обследования матери в обязательном порядке должен быть выполнен полноценный объем терапии, предоставляющий женщине наиболее высокие шансы на выздоровление.
В современной научной литературе нет публикаций, посвященных исследованию влияния на плод ХТ, проведенной беременной пациентке по программе BEACOPP-14 (блеомицин, этопозид, доксорубицин, циклофосфамид, винкристин, прокарбазин и преднизолон). Так, ряд авторов [1, 9] отмечают, что в данной программе используется высокая доза прокарбазина, который относится к группе алкилирующих соединений, и поэтому применение BEACOPP-14 нежелательно во время беременности. Однако при недостаточном эффекте программы ABVD во II и III триместрах беременности возможна интенсификация терапии до ВЕАСОРР-14 с заменой прокарбазина на дакарбазин.
Для лечения беременных пациенток с В-клеточной НХЛ используются более агрессивные схемы терапии (CHOP и EPOCH) в сочетании с моноклональными анти-CD20 антителами (ритуксимаб) [1, 10]. Aviles и соавт. [5] провели изучение отдаленных результатов здоровья детей, рожденных от матерей, получавших во время беременности лечение по программе CHOP (доксорубицин, циклофосфамид, винкристин и преднизолон), и не выявили у них неврологических отклонений и нарушений фертильности.
Ритуксимаб может проникать через плаценту и оказывать токсическое воздействие на В-клеточный иммунитет плода [11, 12]. В литературе описаны случаи применения препарата для лечения беременных пациенток (в том числе и в I триместре беременности). В работе E.F. Chakravarty и соавт. [12] выявлена высокая частота репродуктивных потерь (до 40%) при использовании препарата для лечения беременных женщин, а также было зарегистрировано 2 случая врожденных пороков развития у плода. В исследовании E.F. Chakravarty и соавт. [12] установлено, что при использовании ритуксимаба увеличивается риск истощения пула В-клеток у новорожденных, что приводит к иммунологическим нарушениям. Из 90 живорожденных детей 11 имели гематологические нарушения: у 5 было истощение пула В-клеток, у трех – тромбоцитопения, у трех – лейкопения. В нашем исследовании при использовании в программах лечения пациенток ритуксимаба (6 случаев) у детей не наблюдалось гематологических нарушений и пороков развития.
По мнению большинства исследователей, во время беременности при лечении лимфом следует избегать назначения антиметаболитов (метотрексат и др.), так как они проникают через плацентарный барьер и приводят к развитию грубых пороков развития плода (аминоптериновый синдром) [1].
В недавней работе F. Amant и соавт. [3] опубликовали данные о состоянии здоровья 895 детей, рожденных у матерей, имевших онкологическое заболевание во время беременности. Было организовано наблюдение за двумя группами детей: 1-я группа – рожденные у матерей, получавших во время беременности противоопухолевую терапию, 2-я группа – рожденные у матерей, не получавших во время беременности лечение. Авторы не обнаружили у детей различий в состоянии нейрокогнитивных функций и деятельности сердечно-сосудистой системы. F. Amant и соавт. подчеркивают, что заболевание детей в обеих группах в основном обусловлено их недоношенностью, а не противоопухолевым лечением. По данным авторов этой работы [3], 167 (21%) из 796 детей были маловесными. Причем частота рождения маловесных детей в 1-й группе была выше, чем во 2-й. Частота аномалий развития у новорожденных в обеих группах не отличалась от таковой у детей в общей популяции.
По данным нашей работы, за последние 5 лет отмечено увеличение числа пациентов (на 24,7%), получавших ХТ во время беременности, что соответствует общемировой тенденции. В нашем исследовании беременным женщинам ХТ проводилась во II и III триместрах. У 2 пациенток на фоне проведения программы BEACOPP-14 развилась плацентарная недостаточность с задержкой роста плода. Программа BEACOPP-14 применялась для лечения только у 3 пациенток с большим объемом опухоли, с выраженной опухолевой интоксикацией и анемией, которые сами по себе крайне неблагоприятны для плода. Поэтому нельзя уверенно говорить о наличии причинно-следственной связи между развитием у пациентки плацентарной недостаточности и примененной для лечения опухолевого заболевания схемой ХТ.
Не была обнаружена связь и между определенной схемой противоопухолевой терапии и количеством проведенных курсов и состоянием здоровья новорожденных детей. Частота врожденных пороков развития (5,5%) в группе наблюдения не отличалась от их частоты в общей популяции (4–6%) [13].
Беременность и послеродовой период являются гиперкоагуляционными состояниями с повышенным риском развития венозных тромбоэмболических осложнений (ВТЭО) [14, 15]. Риск развития ВТЭО у беременных женщин в 5 раз выше, чем у небеременных. После родов риск развития ВТЭО увеличивается сразу в 50 раз. Онкологическое заболевание увеличивает риск развития ВТЭО в 4 раза, а проведение ХТ – в 7 раз [16, 17]. До настоящего времени нет достоверных данных о частоте развития ВТЭО при сочетании вышеперечисленных факторов.
Гиперкоагуляционное состояние при сочетании различных факторов риска ВТЭО в определенных условиях может привести к тромбозу плаценты, задержке роста плода, повышенному риску тромбоза глубоких вен и эмболии легочной артерии [18]. Состояние повышенной активности свертывающей системы крови у пациенток с онкологическими заболеваниями в период гестации связано с образованием воспалительных цитокинов, адгезией опухолевых клеток к эндотелию и индуцированной беременностью прокоагулянтной активностью фагоцитов. Недавние исследования показали, что к гиперкоагуляционному состоянию приводит также высокая экспрессия гепариназы плацентой и опухолевыми клетками [19].
Для профилактики ВТЭО у беременных пациенток применяются низкомолекулярные гепарины (НМГ), которые являются безопасными препаратами во время беременности и не проходят через плаценту [20]. Всем пациенткам из группы нашего наблюдения назначались профилактические или высокие профилактические дозы НМГ.
В нашем исследовании у 37,5% пациенток с НХЛ, получавших ХТ во время беременности, был диагностирован тромбоз вен различной локализации. Лишь у 1 (5,3%) пациентки с ЛХ на фоне проведения ХТ был зафиксирован тромбоз внутренней яремной вены в месте установки внутривенного катетера. Как известно, при НХЛ вне беременности ВТЭО встречаются так же часто, как и при солидных опухолях, а при ЛХ тромбозы во всех ситуациях крайне редки. Таким образом, частота тромбозов больше связана с характером болезни, чем с видом лечения. Поэтому мы рекомендуем назначать высокие профилактические дозы НМГ всем беременным с НХЛ при наличии синдрома сдавления верхней полой вены, дополнительных факторов тромбофилии, при проведении ХТ, содержащей глюкокортикоиды, под контролем показателей гемостаза и количества тромбоцитов.
Van Calsteren и соавт. [21] в своем исследовании 2010 г. установили, что у 54% беременных женщин при наличии онкологического заболевания происходят преждевременные роды. Вероятность преждевременных родов увеличивается на 11,8% в случае проведения пациенткам противоопухолевого лечения.
Частота преждевременных родов среди 62 пациенток в нашей работе составила 40,3%. Не было установлено существенных различий между частотой преждевременных родов у беременных пациенток, получавших ХТ и не получавших лечение (42,8% против 37%, p=0,79). Отметим, что частота преждевременных родов среди пациенток с НХЛ была в 2 раза выше, чем среди пациенток с ЛХ. По нашему мнению, это обусловлено тем, что НХЛ является более агрессивным заболеванием, чем ЛХ, и его течение гораздо чаще создает предпосылки к досрочному родоразрешению в связи с необходимостью начала лечения тератогенными препаратами. Так, в нашем исследовании в 80% случаев пациентки были досрочно родоразрешены именно в связи с такой необходимостью.
Следует отметить, что тактика родоразрешения (сроки и метод) кардинально поменялась за последние 5 лет. Так, если раньше предпочтительными сроками родоразрешения были 34–35 недель, а методом – кесарево сечение, то в настоящее время, если позволяет клиническая ситуация, предпочтительнее родоразрешение в доношенном сроке и через естественные родовые пути. Такой подход позволил существенно снизить частоту преждевременных родов (с 57,7 до 27,8%, p=0,02), что способствовало снижению заболеваемости новорожденных.
Результаты нашего исследования указывают на то, что преждевременное родоразрешение оказывает существенное влияние на состояние здоровья детей. Заболеваемость недоношенных детей в нашем исследовании была в основном обусловлена дыхательными расстройствами, внутричерепными кровоизлияниями и асфиксией (см. таблицу), возникшими вследствие преждевременного родоразрешения. На первом этапе почти 2/3 (77,8%) недоношенных детей находились после рождения в ОРИТН. Дыхательная поддержка потребовалась каждому второму из них.
В исследованиях [22, 23] было установлено, что у детей, рожденных досрочно, нарушение когнитивных функций и физического развития в основном наблюдается вплоть до конца первого года жизни. Результаты нашей работы говорят об отсутствии влиянии ХТ на более отдаленные (после первого года жизни) результаты физического, нервно-психического развития и деятельности сердечно-сосудистой системы у детей.
Заключение
Результаты проведенного анализа беременностей у пациенток с лимфомами свидетельствуют о том, что ХТ может безопасно применяться во время беременности, не приводить к увеличению числа неблагоприятных исходов и тем самым способствовать пролонгированию беременности до доношенного срока.
По результатам нашей работы выявлено, что анемия – это наиболее частое осложнение беременности у женщин с лимфомами, особенно при проведении ХТ (p=0,03). Одной из основных проблем при лечении НХЛ является высокая частота катетер-ассоциированных венозных тромбозов (37,5%), в связи с чем таким пациенткам рекомендуются высокие профилактические дозы НМГ в течение всей беременности и минимум 6 недель после родов.
В нашем исследовании не было выявлено взаимосвязи между состоянием здоровья новорожденного и проведенной ХТ; заболеваемость детей при рождении была обусловлена в основном их недоношенностью. Досрочное родоразрешение в 80% случаев связано с необходимостью начать/продолжить противоопухолевое лечение сразу после родов. Кардинальное изменение тактики ведения пациенток за последние 5 лет позволило в 2 раза снизить частоту преждевременных родов (p=0,02), что способствовало улучшению перинатальных исходов.
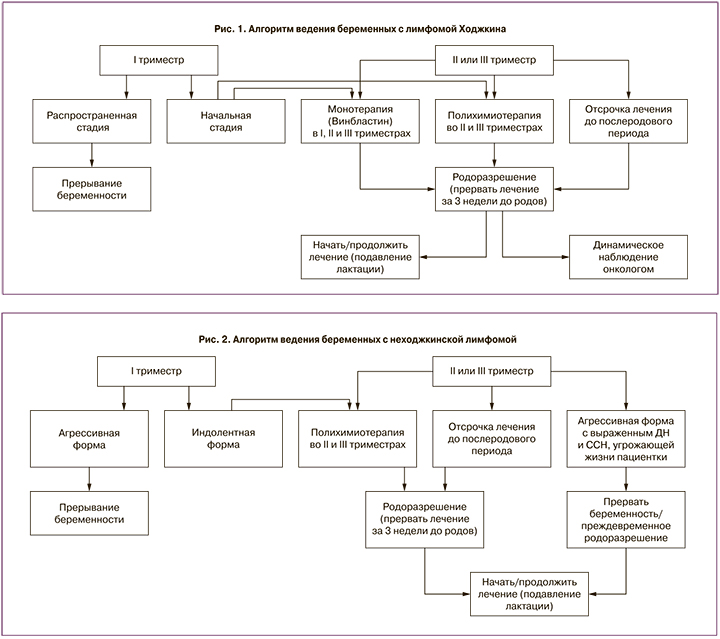
Многолетнее наблюдение и дальнейший анализ позволили оптимизировать алгоритмы (рис. 1–2) ведения беременности у пациенток с лимфомами, что дало возможность женщинам реализовать репродуктивную функцию, с одной стороны, и не ухудшить прогноз онкологического заболевания – с другой.



