Под термином «фетальная макросомия», или «крупный плод», большинство авторов понимают рождение ребенка массой более 4000 г [1]. В том случае, когда вес новорожденного рассчитывается по перцентильной шкале и составляет более 90 перцентиля для данного срока беременности, применяется термин «крупновесный к сроку гестации» [2].
В последнее время отмечается тенденция к рождению крупных детей, которую в известной степени связывают с заболеваемостью диабетом среди беременных [3, 4]. Распространенность фетальной макросомии встречается в 10% всех беременностей; в то же время около 15–45% случаев приходится на долю женщин с диабетом [5]. Согласно разработанной классификации фетальной макросомии, все крупные новорожденные делятся на 3 категории в зависимости от массы тела при рождении и увеличения риска материнских и перинатальных осложнений. К первой категории относят новорожденных массой тела от 4000 до 4499 г, ко второй – от 4500 до 4999 г, к третьей – более 5000 г. По результатам анализа крупного масштабного исследования США (анализ 8,3 млн родов) было показано, что при достижении массы новорожденного более 4000 г возрастала частота кесарева сечения, выполненного по причине клинически узкого таза и аномалий родовой деятельности; значимо чаще новорожденным оказывалась реанимационная помощь, и оценка по шкале Апгар составляла менее 4 баллов на 1-й минуте жизни. Случаи младенческой смертности приходились на детей, рожденных с массой тела более 4500 г и существенно увеличивались при достижении массы тела более 5000 г [5, 6].
Помимо массы тела, немаловажное значение имеют соответствие массы тела росту и соотношение частей тела плода. Одной из причин дисгармоничного и диспропорционального телосложения плода является наличие диабета у беременной. При плохом гликемическом контроле и несоблюдении диетотерапии у таких женщин возрастает риск развития диабетической фетопатии с избыточным отложением жировой ткани у плода в верхней части туловища и межлопаточной областях, что способствует увеличению окружности плечевого пояса, затрудненному прохождению плода через родовые пути, развитию дистоции плечиков, асфиксии и даже гибели плода [7, 8].
В соответствии с этим, согласно современным клиническим рекомендациям мировых сообществ акушеров-гинекологов (Американского колледжа акушеров-гинекологов (ACOG), Королевского колледжа акушеров-гинекологов (RCOG), Национального института здоровья и клинического совершенствования (NICE), Общества акушеров-гинекологов Канады (SOGC), Всемирной организации здравоохранения (ВОЗ)), при выборе акушерской тактики у пациенток с фетальной макросомией основной акцент делается на предполагаемую массу плода, наличие сахарного диабета с уточнением степени компенсации. В зависимости от наличия или отсутствия данных факторов акушерская тактика варьируется от выжидательной, плановой индукции родов до планового кесарева сечения в доношенном сроке беременности.
Отсутствие общепринятой тактики ведения пациенток с фетальной макросомией послужило поводом для определения цели нашей работы, а именно поиска оптимальной акушерской тактики и систематизации имеющихся знаний по выбору метода родоразрешения у данной категории пациенток.
Плановое кесарево сечение при фетальной макросомии
Предполагаемая фетальная макросомия в качестве основного показания для планового родоразрешения неоднозначно рассматривается акушерами-гинекологами. Хотя более ранние исследования показали снижение частоты родовых травм у новорожденных при выполнении планового кесарева сечения у пациенток без диабета с фетальной макросомией [9–11]. В то же время было показано, что для профилактики 1 случая паралича плечевого сплетения у детей, рожденных массой тела более 4500 г, необходимо выполнить 3695 кесаревых сечений женщинам без диабета [5]. В этой связи ACOG (2020) и RCOG (2017) рекомендуют проводить плановое кесарево сечение беременным только при наличии диабета и предполагаемой массы плода более 4500 г [12, 13], а массу плода более 5000 г считать абсолютным показанием к кесареву сечению вне зависимости от нарушений углеводного обмена, учитывая высокий риск перинатальной смертности [5]. По данным российских клинических рекомендаций, показанием к проведению планового кесарева сечения является предполагаемая масса плода ≥4500 г у первородящих пациенток вне зависимости от наличия или отсутствия у них диабета [14, 15].
При рассмотрении планового кесарева сечения в качестве оптимального метода родоразрешения при фетальной макросомии необходимо также учитывать, что риск респираторных нарушений выше у детей, рожденных путем кесарева сечения до начала родовой деятельности. Однако снижение риска возникновения дыхательных нарушений наблюдается после 39 недель беременности. В связи с этим плановое кесарево сечение не рекомендуется проводить по относительным показаниям в более ранние сроки беременности [16].
При выборе акушерской тактики немаловажным вопросом являются также анамнестические особенности пациенток, когда имеются сведения о дистоции плечиков в предыдущих родах, приведшей к развитию неблагоприятных исходов для матери (повреждение лонного сочленения) и плода (мертворождение, тяжелая гипоксия, энцефалопатия, переломы трубчатых костей, паралич плечевого сплетения). В этой связи с целью предотвращения повторной дистоции плечиков пациенткам с предполагаемой массой плода, равной или большей, чем в предыдущую беременность, многие авторы рекомендуют проведение планового кесарева сечения [14, 17–20].
Плановая индукция родов при фетальной макросомии
Важной задачей, которую предстоит решить акушеру-гинекологу при планировании родов через естественные родовые пути у беременных с фетальной макросомией, является оценка риска осложнений, связанных с преиндукцией/индукцией родов. Существуют достаточно противоречивые данные относительно влияния данного вида вмешательства на риск кесарева сечения и родового травматизма новорожденного, а также срока беременности для начала подготовки шейки матки к родам. По результатам четырех рандомизированных исследований, вошедших в Кокрановский обзор, индукция родов, по сравнению с выжидательной тактикой у женщин с фетальной макросомией при доношенном сроке беременности, не оказывала влияния на риск кесарева сечения (ОР 0,91; 95% ДИ 0,76–1,09) и инструментального родоразрешения (ОР 0,86; 95% ДИ 0,65–1,13), но способствовала снижению частоты дистоции плечиков (ОР 0,60; 95% ДИ 0,37–0,98) и переломов трубчатых костей (ОР 0,20; 95% ДИ 0,05–0,79) у новорожденных. При этом авторы отметили, что индукцию родов следует проводить при достаточной уверенности в точности оцениваемой массы плода, предотвратив случаи необоснованного вмешательства [21].
Также немаловажное место занимает вопрос об оптимальном сроке проведения индукции родов. Ранее считалось, что неонатальные исходы у женщин, родивших в сроки 37–42 недели беременности, сопоставимы по частоте осложнений. Однако исследования последних лет показали взаимосвязь между сроком родов и частотой неблагоприятных исходов у новорожденных [22, 23]. В этой связи в конце 2012 г. произошел пересмотр термина «доношенный срок беременности» на следующие понятия: ранний срок родов (early term) – 370–386 недель беременности, доношенный срок родов (full term) – 390–406, поздний срок родов (late term) – 410–416 и запоздалый срок родов (postterm) – после 42-й недели беременности [24]. Обоснованием данного пересмотра послужило крупномасштабное исследование ВОЗ, согласно которому риск неонатальной смертности и мертворождения были значимо выше у женщин, родивших в сроки 370–386 недель беременности, по сравнению с теми, чьи роды произошли в 390–406 недель беременности (ОШ 1,21 (95% ДИ 1,03–1,41) и ОШ 1,31 (95% ДИ 1,09–1,58)) [25]. По данным рекомендаций ACOG и Общества медицины матери и плода, плановая индукция родов не рекомендована до 390/7 недель беременности всем женщинам при отсутствии медицинских показаний [26]. Стоит заметить, что исключительно фетальная макросомия в большинстве случаев не является показанием к ранней индукции родов. Аргументом такого заключения послужило исследование Reddy U.M. et al. (2009), в котором более высокие показатели неонатальной смертности наблюдались среди детей, рожденных от матерей в 37 недель беременности (OP 2,3; 95% ДИ 2,1–2,6) и в 38 недель беременности (ОР 1,4; 95% ДИ 1,3–1,5), по сравнению с детьми, родившимися на 39-й неделе беременности [27]. Помимо этого, в исследовании Dueker G. et al. (2016) было показано, что у детей, рожденных в сроки 370–386 недель беременности, отмечаются более низкие показатели успеваемости в будущем по сравнению с детьми, рожденными в 390–406 недель беременности [28].
Тем не менее, по мнению ряда авторов, ранняя индукции родов у женщин с фетальной макросомией является определенной альтернативой снижению массы тела при рождении и, как следствие, риску кесарева сечения и возникновения дистоции плечиков [29, 30]. В исследовании Boulvian M. et al. (2015) проведение индукции родов у женщин в сроки 370–386 недель беременности при предполагаемой массе плода более 95 перцентиля снижало риск возникновения клинически значимой дистоции плечиков с 4% до 1% (ОР 0,89; 95% ДИ 0,12–0,85). При этом авторы отметили увеличение случаев гипербилирубинемии у детей, рожденных до 38-й недели беременности [31]. В систематическом обзоре и метаанализе Magro-Malosso E.R. et al. (2017) было показано, что индукция родов после 38 недель беременности у женщин без диабета с предполагаемой фетальной макросомией не влияла на частоту кесарева сечения, оперативного влагалищного родоразрешения, дистоции плечиков, внутричерепных кровоизлияний, паралича плечевого сплетения, низкой оценки по шкале Апгар и ацидоза у новорожденных (pH<7). Однако в группе индукции родов отмечалось уменьшение частоты родового травматизма у новорожденных (перелом костей, обычно ключиц) (ОР 0,7; 95% ДИ 0,03–0,79), реже рождались дети массой тела более 4000 г (ОР 0,50; 95% ДИ 0,42–0,59) и более 4500 г (ОР 0,21; 95% ДИ 0,11–0,39) [32]. Данное исследование послужило основанием для российских клинических рекомендаций (2021), в которых предусмотрено проведение плановой преиндукции/индукции родов у женщин с предполагаемой фетальной макросомией после 38 недель беременности [33]. Между тем эксперты ACOG посчитали доказательную базу проведенного метаанализа недостаточной, чтобы сделать выводы о преимуществе той или иной тактики, а также о предпочтительных сроках проведения индукции родов. Вместе с тем результаты крупного ретроспективного исследования показали увеличение риска кесарева сечения у первородящих с предполагаемой массой плода более 90 перцентиля в группе индукции родов в 38 недель беременности по сравнению с женщинами из группы выжидательной тактики в сроки 39–42 недели беременности (ОШ 1,44; 95% ДИ 1,20–1,72) [34]. В ретроспективном исследовании Cheng Y.W. et al. (2012) плановая индукция родов у первородящих с массой плода более 4000 г при исключенном диабете в 39 недель беременности способствовала снижению риска кесарева сечения по сравнению с пациентками из группы выжидательной тактики в 40 (OШ 1,25; 95% ДИ 1,23–1,40) и 41 неделю беременности (OШ 1,16; 95% ДИ 1,06–1,28) [29].
По всей видимости, срок 39 недель беременности является относительно безопасным для начала преиндукции/индукции родов. Однако в последних рекомендациях ACOG (2019) фетальная макросомия или крупновесный к сроку гестации плод не являются показанием для индукции родов до 40 недель беременности. По мнению ACOG, это связано с недостаточным количеством доказательств о влиянии ранней индукции родов на риск развития материнских и перинатальных осложнений при родоразрешении женщин с предполагаемой фетальной макросомией [5]. В настоящее время показано лишь преимущественное влияние ранней индукции родов на снижение риска дистоции плечиков. Более того, по данным рекомендаций RCOG (2017), ранняя индукция родов не способствует профилактике дистоции плечиков у женщин без диабета и фетальной макросомии [13]. Согласно недавнему исследованию отечественных авторов, выжидательная тактика у первородящих без диабета и фетальной макросомией до 400-6 недель беременности позволяет снизить частоту кесарева сечения, не способствуя увеличению частоты неблагоприятных материнских (травмы промежности, гипотоническое кровотечение, эндометрит) и перинатальных (перелом ключицы, кефалогематома, неонатальная желтуха) исходов [35].
Следует признать, что неточность определения массы плода ограничивает многих акушеров-гинекологов в проведении преиндукции/индукции родов с 39 недель беременности у женщин с фетальной макросомией. Метаанализ 29 исследований показал, что чувствительность и специфичность ультразвукового метода (2D) при прогнозировании фетальной макросомии (массе плода >4000 г) составляют 56 и 92%, соответственно [36]. Результаты других исследований показали снижение точности ультразвуковой диагностики при увеличении веса плода более 4000 г [37, 38]. В этой связи NICE (2013) не рекомендует приступать к индукции родов при диагностике фетальной макросомии (массе плода <4500 г) у женщин с неосложненным течением беременности до 410 недели беременности [39].
При выборе акушерской тактики у беременных без диабета ВОЗ [40] и SOGС [41, 42] рекомендуют проводить индукцию родов не ранее 41 недели беременности и не ориентироваться на массу плода. Аргументом такого заключения для SOGС послужил ряд исследований [30, 43, 44], в которых было показано, что индукция родов при фетальной макросомии увеличивает риск кесарева сечения в 2 раза, не снижая частоту дистоции плечиков. В свою очередь, ВОЗ не может рекомендовать проводить индукцию родов беременным с макросомией плода по причине недостатка ресурсов и ультразвукового оборудования.
Преиндукция/индукция родов у пациенток с диабетом
При решении вопроса о сроке преиндукции/индукции родов у пациенток с диабетом в первую очередь оцениваются не масса плода, а тип диабета и его компенсация. В таком случае фетальная макросомия при диабете у женщин рассматривается как один из признаков диабетической фетопатии, свидетельствующий о нарушении контроля за уровнем гликемии.
Для пациенток с компенсируемым гестационным сахарным диабетом (ГСД), как правило, применяется выжидательная тактика [45, 46]. В рандомизированном исследовании Alberico S. et al. (2017) не было выявлено значимых различий в частоте кесарева сечения между пациентками с ГСД из группы индукции родов в 38 недель беременности и группы выжидательной тактики в 39 недель беременности (12,6% против 11,8%, p=0,81). Более того, увеличение случаев гипербилирубинемии у новорожденных было отмечено в группе индукции родов по сравнению с группой выжидательной тактики (10,0% против 4,1%, p=0,03) [47]. Ссылаясь на данное исследование, АCOG рекомендует начинать индукцию родов с 39 недель беременности и придерживаться выжидательной тактики до 406 недель беременности в случае контролируемого ГСД (диетой и физическими упражнениями) [48]. Подобные рекомендации поддерживает NICE [49]. Российское общество акушеров-гинекологов рекомендует проводить подготовку шейки матки пациенткам при контролируемом ГСД не позднее 40 недель беременности при условии, если предполагаемая масса плода соответствует сроку беременности [33]. Индукция родов в данном случае позволяет снизить частоту кесарева сечения, родовой травмы и перинатального поражения центральной нервной системы плода и новорожденного.
Для женщин с ГСД, находящихся на инсулинотерапии, согласно ACOG (2018), рекомендуемые сроки индукции родов составляют 390–400 недель беременности [48]. В то же время, по данным последних российских рекомендаций, допускается более раннее начало подготовки шейки матки к родам у таких пациенток. В случае сочетания ГСД с массой плода более 90 перцентиля или другими признаками диабетической фетопатии преиндукция/индукция родов возможна с 370 недель беременности [33].
ВОЗ не рекомендует проводить индукцию родов до 41 недели беременности пациенткам с ГСД при отсутствии других осложнений беременности и заболеваний. Индукция родов может быть оправдана ранее установленного срока беременности при плохом гликемическом контроле и плацентарной недостаточности [50].
Для пациенток с манифестным СД сроки родоразрешения могут варьировать от 36 до 40 недель беременности в зависимости от риска антенатальной гибели плода, преждевременных родов, особенно у пациенток с отягощенным соматическим анамнезом (васкуло- и нефропатиями), при мертворождении в анамнезе и плохом гликемическом контроле [51]. Напротив, для пациенток с хорошо контролируемым диабетом, не имеющих других сопутствующих заболеваний, допускается выжидательная тактика до 390–400 недель беременности при условии проведения тщательного антенатального мониторирования [45]. Преиндукция/индукция родов в указанные сроки беременности возможна для пациенток с манифестным СД в случае, когда масса плода не превышает 4500 г. В противном случае расширяются показания для оперативного абдоминального родоразрешения.
Заключение
На основании проанализированных данных установлено, что тактика ведения беременности и родоразрешения пациенток с фетальной макросомией во всем мире неоднозначная и требует дальнейшего изучения проблемы. Будущие исследования должны быть направлены на уточнение оптимального срока преиндукции/индукции родов и метода родоразрешения для женщин без диабета с фетальной макросомией, учитывая паритет и анамнестические особенности. Повышение точности диагностики предполагаемой массы плода остается одной из приоритетных задач для акушера-гинеколога, решение которой приведет к уменьшению частоты планового кесарева сечения и нецелесообразной индукции родов.
Разработка российских клинических рекомендаций по ведению пациенток с фетальной макросомией позволит расширить спектр альтернатив и будет служить незаменимым инструментом при выборе акушерской тактики.
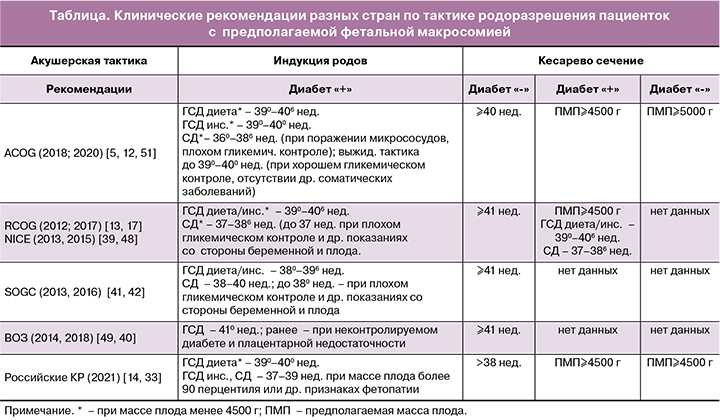
Суммируя вышесказанное, в таблице представлены клинические рекомендации разных стран по ведению пациенток с фетальной макросомией.



