Преэклампсия (ПЭ) – мультисистемное патологическое состояние, возникающее во второй половине беременности, характеризующееся артериальной гипертензией, протеинурией (>0,3 г/л в суточной моче), отеками и проявлением полиорганной недостаточности [1, 2].
В патогенезе развития ПЭ первостепенное значение имеет нарушение взаимодействия между децидуальными иммунными клетками и отцовскими антигенами, экспрессируемыми клетками трофобласта. Предполагается, что при физиологическом течении беременности после распознавании антигенов трофобласта стимулированные децидуальные натуральные киллеры и Т-лимфоциты вырабатывают цитокины и факторы роста, которые способствуют плацентации. Нарушение этого процесса связано с недостаточностью трансформации спиральных артерий и развитием состояния ишемии в тканях децидуальной оболочки, состояния гипоксии децидуальных клеток и, как следствие, манифестации окислительного стресса. Сниженная окислительная активность является неотъемлемой частью нормального воспалительного ответа, в котором сохраняется баланс про - и антиокислительных реакций. Однако при ПЭ интенсивная окислительная активность преобладает над антиоксидантной защитой. В результате этого возникает окислительный стресс, что вызывает биохимические нарушения внутри клеток и в межклеточном пространстве. Связь между различными компонентами системного воспалительного ответа осуществляется большим количеством секретируемых белков, таких как цитокины, хемокины и ростовые факторы [3].
Одним из таких факторов является трансформирующий фактор роста β (TGF-β), представляющий собой многофункциональный цитокин, участвующий в регуляции пролиферации, инвазии и дифференцировки клеток трофобласта. TGF-β вырабатывают многие типы клеток, преимущественно макрофаги, в неактивной форме, в которой он соединен с двумя другими полипептидами - латентным TGF-β-связывающим белком (LTBP) и лейцинаминопептидазой (LAP) [4].
Известны три изоформы TGF-β: TGF-β1, TGF-β2 и TGF-β3. [5]. Имеются данные об антиинвазивном действии TGF (в основном изоформы TGF-β1) на различные системы клеток и тканей, например, при раке толстой кишки и щитовидной железы [6, 7, 8]. Имеются данные, что именно изоформа TGF-β3 играет особо важную роль в дифференцировке трофобластов, и ее избыточная экспрессия может быть обнаружена в плаценте женщин с ПЭ [9]. Однако роль отдельных изоформ TGF-β в патогенезе ПЭ недостаточно изучена.
Целью исследования явилось изучение содержания изоформ TGF-β (TGF-β1, TGF-β2, TGF-β3) в плазме крови женщин с ПЭ и женщин с физиологическим течением беременности.
Материал и методы исследования
В исследование были включены 50 беременных в сроках от 27 до 41 недели, поступивших и родоразрешенных в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава РФ в период с сентября 2016 года по сентябрь 2018 года. Клинико-лабораторное обследование пациенток проводилось в полном объеме согласно приказу Минздрава РФ от 01.11.2012 N 572н. Пациентки, включенные в исследование, были разделены на 2 группы: первую группу составили 30 пациенток с ПЭ, вторую группу – 20 условно здоровых беременных с неотягощенным акушерско-гинекологическим анамнезом и физиологическим течением данной беременности.
Группы обследуемых беременных были сопоставимы по возрасту, паритету, клинической характеристике. Были собраны анамнестические данные, включавшие возраст, перенесенные и сопутствующие гинекологические и соматические заболевания, перенесенные оперативные вмешательства, состояние менструальной и репродуктивной функций, течение и исход данной беременности, проводимое лечение в основной группе, перинатальные исходы.
Все пациентки подписали информированное согласие на участие в данном исследовании, которое было одобрено локальным этическим комитетом ФГБУ «НМИЦ АГП им В.И. Кулакова» Минздрава РФ. Критериями включения в группах являлись: одноплодная беременность, родоразрешение на сроке гестации с 27 недель до 40 недель и 6 дней, наличие ПЭ в основной группе. Критериями исключения: тяжелая экстрагенитальная патология, многоплодная беременность, наступление беременности с помощью вспомогательных репродуктивных технологий, несовместимые с жизнью пороки развития плода, генетические и острые инфекционно-воспалительные заболевания матери.
Для определения концентрации изоформ TGF-β (TGF-β1, TGF-β2, TGF‑β3) были использованы образцы периферической венозной крови женщин перед родоразрешением. Забор крови осуществлялся в вакутейнеры с этилендиаминтетрауксусной кислотой (ЭДТА).
Определение концентрации изоформ TGF-β (TGF-β1, TGF-β2, TGF-β3) в плазме периферической крови (ЭДТА) проводилось мультиплексным методом с использованием стандартной 3-плексной тест-системы Bio-Plex Pro TGF-β Panel 3-Plex (Bio-Rad, США) на проточном лазерном иммуноанализаторе Bio-Plex 200 System (Bio-Rad, США) и с последующей обработкой полученных результатов с использованием приложения Bio-Plex Manager 6,0 Properties (Bio-Rad, США). Согласно инструкции производителя, тест-системы компании Bio-Rad для приготовления образцов плазмы (ЭДТА) использовалось двукратное центрифугирование образцов периферической крови при 1000g в течение 15 минут при 40С и 10 000g в течение 10 минут при 40С для полного удаления тромбоцитов и осадков. Образцы плазмы замораживали и хранили до проведения анализа при температуре -80° С.
Результаты исследования представлены в виде средних значений и стандартного отклонения M(SD). Проверка нормальности распределения проводилась методом Шапиро и Уилка. При сравнении средних значений использовали t-критерий Стьюдента, при сравнении частот использовали критерий Хи-квадрат Пирсона. Значимыми считались результаты при p<0,05. Для определения диагностической информативности исследуемой модели использовался ROC-анализ. Данные ROC-анализа представлены в виде площади под кривой с 95% доверительным интервалом. Для статистической обработки результатов и построения графиков использовались программы Attestat (Россия) и OriginPro 8.5 (USA).
Результаты исследования и их обсуждение
Результаты изучения анамнеза соматических и гинекологических заболеваний женщин представлены в таблице 1.
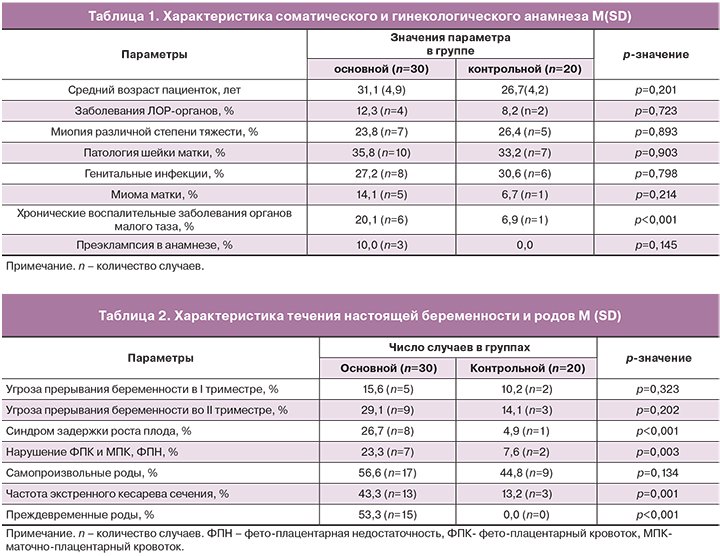
Как следует из данных таблицы 1, пациентки обеих групп были сопоставимы по возрасту, заболеваниям ЛОР-органов, по выявляемой патологии шейки матки, миоме матки и генитальным инфекциям, однако в основной группе в 3 раза чаще наблюдались хронические воспалительные заболевания органов малого таза и в 10% случаев (n=3) предыдущая беременность осложнилась развитием ПЭ, при этом в двух наблюдениях-тяжелой.
Характеристика течения данной беременности представлена в таблице 2.
Как следует из представленных данных, течение беременности у пациенток с ПЭ в 1,5 раза чаще осложнялось угрозой прерывания беременности во II триместре, в 6,5 раз чаще осложнялась синдромом задержки роста плода, в 3 раза чаще выявлялись нарушения фето-плацентарного и маточно-плацентарного кровотока по данным ультразвукового исследования и допплерометрии. Большая часть пациенток (n=15) основной группы была родоразрешена при сроке беременности менее 37 недель, что было обусловлено нарастанием степени тяжести ПЭ, при этом оперативное родоразрешение в экстренном порядке осуществлялось в 4 раза чаще.
Изучение послеродового периода в группах не выявило значимых различий. Медиана оценки новорожденного по шкале Апгар на 1-й минуте в основной группе составила 8[7:8] баллов, а в контрольной группе – 8[8:8] баллов, медиана оценки на 5-й минуте жизни составила 8[8:9] и 9[9:9] баллов соответственно. Масса новорожденного в группе контроля составила 3404(317,83) г, что было в 1,5 раза больше, чем в основной группе (2501(463,18) г, p=0,001).
Результаты изучения содержания изоформ TGF-β в плазме периферической крови исследуемых групп пациенток представлены в таблице 3.
Результаты показали, что в крови женщин с ПЭ концентрация TGF-β3 ниже, по сравнению с группой контроля (p=0,034), а уровни TGF-β1 и TGF-β2 не отличались от соответствующего уровня в контрольной группе.

ROC-анализ уровня TGF-β3 (рис. 1) показал высокую диагностическую ценность определения TGF-β3 женщин с ПЭ (чувствительность 78%, специфичность 66,67%, AUC=0,80). Это дает возможность предполагать, что именно изоформа TGF-β3 играет значимую роль в патогенезе ПЭ и может являться предиктором развития заболевания.
Согласно общепринятым критериям [10], основная группа была разделена на две подгруппы: Ia – с ранней ПЭ (n=19), развивающейся до 34 недели гестации, Ib – с поздней ПЭ (n=11). При исследовании концентрации трех изоформ TGF-β в выделенных подгруппах было показано, что содержание TGF-β3 в подгруппе Ia, по сравнению с контрольной было значимо ниже (табл. 4). Других статистических различий выявлено не было.
Использование ROC-анализа показало высокую диагностическую ценность (чувствительность 94%, специфичность 60%, AUC=0,81) определения уровня TGF-β3 для раннего прогноза развития ПЭ (рис. 2).
До настоящего времени не проводилось аналогичных исследований, включающих оценку в периферической крови всех трех изоформ TGF-β[11–14]. Есть единичные работы по изучению содержания изоформы TGF-β3 при ПЭ и при физиологической беременности. В работе Ganigia et al. [15] при изучении плацентарной ткани показана динамика образования TGF-β3 при физиологически протекающей беременности, которая заключается в росте его экспрессии клетками плаценты примерно до 7–8 недели беременности с постепенным дальнейшим снижением. Также высока в течение первых 7 недель экспрессия мРНК TGF-β3 в хорионических ворсинах, которая затем уменьшается примерно к 10 неделе. Согласно опубликованным экспериментальным данным, изоформа TGF-β3 принимает участие в ингибировании способности трофобласта к инвазии [16]. Обнаруженные изменения в содержании изоформы TGF-β3 при физиологически протекающей беременности могут отражать ее участие в контроле степени инвазии трофобласта.
При изучении содержания различных изоформ TGF-β в культурах эксплантов плацент женщин с ПЭ, родоразрешенных на 30–32 неделе гестации, плацент женщин с физиологически протекающей беременностью и абортивного материала в сроке 5–13 недель гестации показано, что только TGF-β3 ингибирует дифференцировку трофобластов в отношении инвазивного фенотипа в плацентарных эксплантах первого триместра.
Клетки плацентарной ткани женщин с ПЭ сверхэкспрессируют TGF-β3 и проявляют гипоинвазивный фенотип in vitro. Дифференцировка инвазивного фенотипа может быть восстановлена в этих эксплантатах с помощью антител к TGF-β3. В клетках хорионических ворсинок плацент женщин с физиологической беременностью наблюдался низкий уровень иммунореактивности TGF-β3, а в образцах плацентарной ткани женщин с ПЭ того же срока гестации - высокий. Ингибирование экспрессии TGF-β3 в плацентах женщин с ПЭ восстанавливает инвазивную способность трофобластов, а обработка образцов плацентарной ткани женщин с ПЭ антителами к TGF-β1 или TGF-β2 не оказывало никакого влияния на формирование инвазивной способности трофобласта. Авторы делают вывод о том, что именно изоформа TGF-β3 является регулятором дифференциации трофобластов человека в отношении инвазивного фенотипа, что необходимо для адекватной инвазии и ремоделирования спиральных артерий [15].
Некоторые авторы говорят о роли других изоформ TGF-β в патогенезе ПЭ. Например, в клетках трофобласта у женщин с ПЭ, по сравнению со здоровыми беременными была обнаружена повышенная экспрессия и активность циклооксигеназы-2 (СОХ-2). TGF-β1 увеличивает экспрессию COX-2, активируя сигнальные пути SMAD2/3-SMAD4, а увеличение уровня СОХ-2 впоследствии способствует подавлению инвазии клеток трофобласта человека с помощью TGF-β1 [17]. Таким образом, было показано, что применение ингибитора рецептора TGF-β1 отменяет его стимулирующие эффекты на экспрессию COX-2.
Заключение
В нашей работе мы не получили значимых различий в содержании изоформ TGF-β1 и TGF-β2 в плазме крови исследуемых групп пациенток. Полученные нами результаты, указывающие на снижение уровня TGF-β3 в плазме женщин с ПЭ могут отражать накопление этой изоформы в плацентарной ткани и свидетельствовать о ее возможной роли в патогенезе развития данного осложнения беременности, что согласуется с данными Caniggia et al. [15]. В связи с вышесказанным, перспективным представляется определение экспрессии TGF-β3 в качестве прогностического маркера ПЭ уже на ранних сроках беременности.



