Частота выявления онкологических заболеваний во время беременности неуклонно растет: в настоящее время в развитых странах данный показатель составляет 1:1000 [1]. Наиболее распространенными злокачественными заболеваниями, сопряженными с беременностью, являются: рак молочной железы (РМЖ), гематологические болезни, рак шейки матки, рак яичника, рак щитовидной железы. Первое место по частоте выявления занимают РМЖ (10–30:100000) и гемобластозы (10–60:100000 беременных женщин) [2]. Принимая во внимание тот факт, что формирование эффективного противоопухолевого иммунного ответа происходит на Th1-фоне [3], а успешное пролонгирование беременности возможно при условии сдерживания цитотоксического иммунного ответа и поляризации иммунного ответа по Th2-пути [4], оценка баланса провоспалительных и противовоспалительных цитокинов в периферической крови беременных женщин с онкологическими заболеваниями представляет несомненный интерес.
В настоящее время большое внимание уделяется возможности применения противоопухолевых химиопрепаратов у женщин с онкологическими заболеваниями в течение беременности [5–7]. Противоопухолевые средства способны оказывать выраженное стимулирующее влияние на цитокин-продуцирующую активность иммунных клеток как напрямую, так и за счет активирующего влияния антигенов, появляющихся вследствие разрушения опухолевых клеток [8]. Доказано, что избыточный провоспалительный фон у женщин с РМЖ может оказывать существенное негативное влияние на их когнитивные функции после противоопухолевого лечения [9]. Спектр применяемых во время беременности химиопрепаратов ограничен, поскольку многие из них имеют малую молекулярную массу, липидорастворимы и неионизированы, что благоприятствует их пассивному прохождению через плацентарный барьер. Тем не менее, концентрация их в крови плода находится на низком уровне, что объясняется снижением всасывания препаратов в желудочно-кишечном тракте матери, изменением их фармакокинетики вследствие формирования особого гормонального фона, особенностями гемодинамики (увеличение объема жидкости в организме беременной женщины, приводящее к снижению концентрации препарата и увеличению периода его полувыведения), а также наличием плацентарных белков, регулирующих содержание лекарственных веществ в крови плода [5]. Применение химиопрепаратов в I триместре беременности оказывает наиболее выраженный тератогенный эффект: возможно повреждение сердца, нервной трубки, органов слуха и зрения у плода [10]. В то же время, во II и III триместре основные этапы органогенеза завершены, и риск развития пороков у плода минимален [5]. Однако вопрос о влиянии противоопухолевых лекарственных средств на иммунную систему плода и новорожденного изучен недостаточно.
Цель исследования: определить содержание цитокинов, хемокинов, ростовых факторов в периферической крови женщин с онкологическими заболеваниями, принимавших противоопухолевую химиотерапию во время беременности, и в крови их новорожденных.
Материал и методы исследования
В проспективное когортное исследование включены 10 беременных женщин с онкологическими заболеваниями, получавших химиотерапию во время беременности, и их новорожденные дети. Группу сравнения составили 9 женщин с физиологическим течением беременности и их новорожденные. Осуществляли забор периферической венозной крови у женщин перед родоразрешением, крови из вены пуповины и периферической крови новорожденных в возрасте 3 суток и 1 месяца жизни. Содержание цитокинов в плазме определяли мультиплексным методом на анализаторе Bioplex 200 (Bio-Rad, USA) с применением коммерческого набора (Bio-Rad, USA). Оценивали уровень провоспалительных (интерферон (IFN)γ, фактор некроза опухоли (TNF)α, интерлейкины (IL)-1b, IL-2, IL-6, IL-9, IL-12, IL-15, IL-17) и противовоспалительных (IL-4, IL-5, IL-10, IL-13, антагонист рецептора IL-1 (IL-1Ra)) цитокинов, хемокинов (IL-8, моноцитарный (MCP-1) и эозинофильный (Eotaxin) хемотаксические факторы, макрофагальные белки воспаления (MIP-1α, MIP-1β), хемокин, экспрессируемый и секретируемый Т-клетками при активации (RANTES), индуцируемый интерфероном-γ белок (IP-10)) и ростовых факторов (васкуло-эндотелиальный (VEGF) и тромбоцитарный (PDGF bb) факторы роста, основной фактор роста фибробластов (FGF-b), колониестимулирующие факторы (G-CSF, GM-CSF), IL-7).
Статистическую обработку проводили методами вариационной статистики с использованием пакета программ MedCalc (Бельгия). Проверку нормальности распределения оценивали с помощью критерия Шапиро–Уилка. Данные, подчиняющиеся нормальному распределению, представлены как среднее значение ± стандартное отклонение (M±SD). В случае, когда распределение данных в выборке отличалось от нормального, результаты представлены как медиана (25–75-й процентили). Различия считали достоверными при уровне значимости P<0,05.
Результаты исследования и обсуждение
Средний возраст женщин из основной группы составил 27±4,8 года, женщин из группы сравнения – 33±5,5 года (Р=0,046). Среди онкологических заболеваний у пациенток из основной группы выявлены: лимфома Ходжкина у 4 пациенток, РМЖ – у 3, хронический миелолейкоз – у 2 и рак яичника – у 1 женщины. У 5 беременных заболевание впервые выявлено в I триместре, у 5 – во II. Женщины с РМЖ получали полихимиотерапию (ПХТ) по следующим схемам: АС (доксорубицин и циклофосфамид) и EC (эпирубицин и доксорубицин), беременным с гемобластозами назначали ПХТ по схемам BEACOPP (блеомицин, этопозид, доксорубицин, винкристин, прокарбазин, преднизолон) и ABVD (доксорубицин, блеомицин, винбластин, дакарбазин), также использовалась терапия иматинибом.
Родоразрешение в основной группе произошло через естественные родовые пути в 4 случаях, путем кесарева сечения – в 5 случаях, в 1 случае применили вакуум-экстракцию плода. Четыре пациентки из основной группы родоразрешены на сроке 34–36 недель беременности в связи с необходимостью проведения агрессивной терапии заболевания. Среди показаний к оперативному родоразрешению выделяли преждевременный разрыв плодных оболочек в 1 случае, наличие рубца на матке после предыдущих операций кесарева сечения у 3 женщин, ухудшение состояния плода по данным кардиотокографии в 1 случае. В группе сравнения через естественные родовые пути родоразрешены 6 женщин, 3 пациенткам выполнена операция кесарева сечения в связи с наличием рубца на матке после предыдущего оперативного родоразрешения.
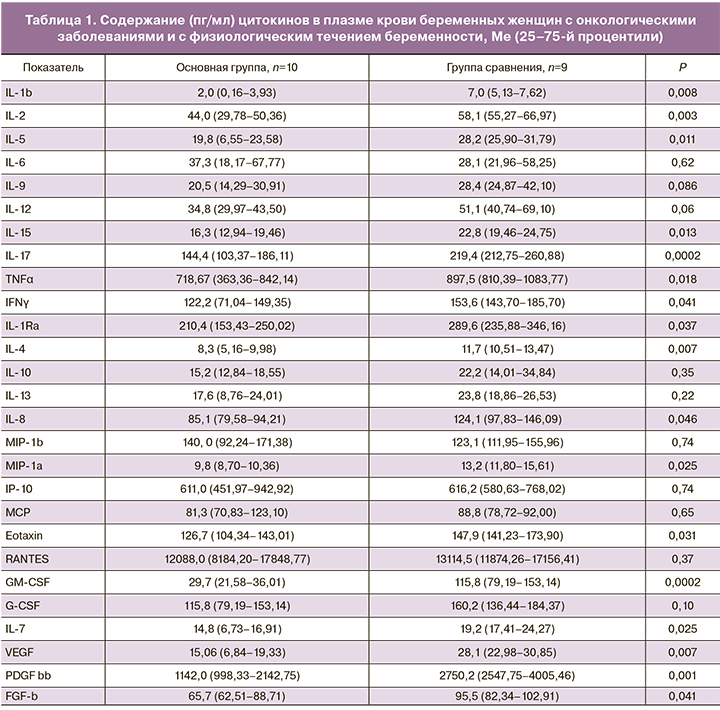
Результаты исследования уровня цитокинов в периферической женской крови представлены в табл. 1.
Ранее нами было показано, что для беременных с онкологическими заболеваниями на фоне иммуносупрессивной терапии характерны некоторые признаки дисбаланса в клеточном звене иммунитета, которые проявлялись снижением иммунорегуляторного индекса и количества В-лимфоцитов, увеличением содержания активированных Т-лимфоцитов и лимфоцитов, готовых к апоптозу [11]. Данные, представленные в табл. 1, свидетельствуют о том, что в плазме крови женщин с онкологическими заболеваниями, принимавших противоопухолевые химиопрепараты во время беременности, снижено содержание ряда провоспалительных (IL-1b, IL-2, IL-15, IL-17, TNFα, IFNγ) и противовоспалительных (IL-1Ra, IL-4, IL-5) цитокинов, хемокинов (IL-8, MIP-1α, Eotaxin) и ростовых факторов (GM-CSF, IL-7, VEGF, PDGF bb, FGF-b) по сравнению со здоровыми беременными женщинами. Обращает на себя внимание, что содержание гранулоцитарно-макрофагального колониестимулирующего фактора снижено в 3,9 раза относительно группы сравнения. Направление поляризации иммунного ответа, определенное нами как отношение провоспалительного IFNγ к противовоспалительному IL-4, статистически значимо не различалось в исследуемых группах: 13,2 (12,83–14,74) в группе сравнения и 15,1 (13,73–16,80) – в основной группе (Р=0,10), что может свидетельствовать об отсутствии существенного воздействия применяемой терапии на баланс про- и противовоспалительных цитокинов у женщин с онкологическими заболеваниями.
 Анализ состояния обследованных новорожденных показал, что дети от матерей с онкологическими заболеваниями имели более низкие массу и длину тела при рождении относительно группы сравнения: 2923,7±687,2 г против 3627,3±384,7 г (Р=0,015) и 48,8±3,6 см против 52,9±1,90 см (Р=0,008). 9 из 10 детей от матерей с онкологическими заболеваниями наблюдались после рождения в физиологическом отделении новорожденных, 1 ребенок поступил в отделение реанимации и интенсивной терапии в связи с недоношенностью (34 недели гестации) и наличием дыхательных нарушений. Следует отметить, что длительность пребывания новорожденных в стационаре статистически значимо не различалась: 4 (4,0–5,0) дня в основной группе и 4 (3,8–5,3) дня в группе сравнения (Р=0,55).
Анализ состояния обследованных новорожденных показал, что дети от матерей с онкологическими заболеваниями имели более низкие массу и длину тела при рождении относительно группы сравнения: 2923,7±687,2 г против 3627,3±384,7 г (Р=0,015) и 48,8±3,6 см против 52,9±1,90 см (Р=0,008). 9 из 10 детей от матерей с онкологическими заболеваниями наблюдались после рождения в физиологическом отделении новорожденных, 1 ребенок поступил в отделение реанимации и интенсивной терапии в связи с недоношенностью (34 недели гестации) и наличием дыхательных нарушений. Следует отметить, что длительность пребывания новорожденных в стационаре статистически значимо не различалась: 4 (4,0–5,0) дня в основной группе и 4 (3,8–5,3) дня в группе сравнения (Р=0,55).
Согласно имеющимся данным, «основная патология новорожденных детей у матерей с РМЖ, как с лечением, так и без него во время беременности связана с досрочным родоразрешением, морфофункциональной незрелостью, недоношенностью, а не с проведением противоопухолевой терапии во время беременности» [12]. Авторами другой статьи было показано, что большинство детей от женщин с лимфомой Ходжкина «родились здоровыми, в последующем их физическое и психическое состояние, частота и структура заболеваемости не отличались от таковых в общей популяции» [13]. Среди новорожденных из основной группы, включенных в данное исследование, у 4 отмечалось стойкое фетальное кровообращение (открытый артериальный проток, открытое овальное окно, межпредсердное сообщение), у 2 детей диагностировано антенатальное внутрижелудочковое кровоизлияние 1-й степени, у 1 – врожденная пневмония, гипербилирубинемия, анемия, 3 детей родились здоровыми. При дальнейшем наблюдении за новорожденными из данной группы отмечено, что их развитие не отличалось от такового у детей из группы сравнения.
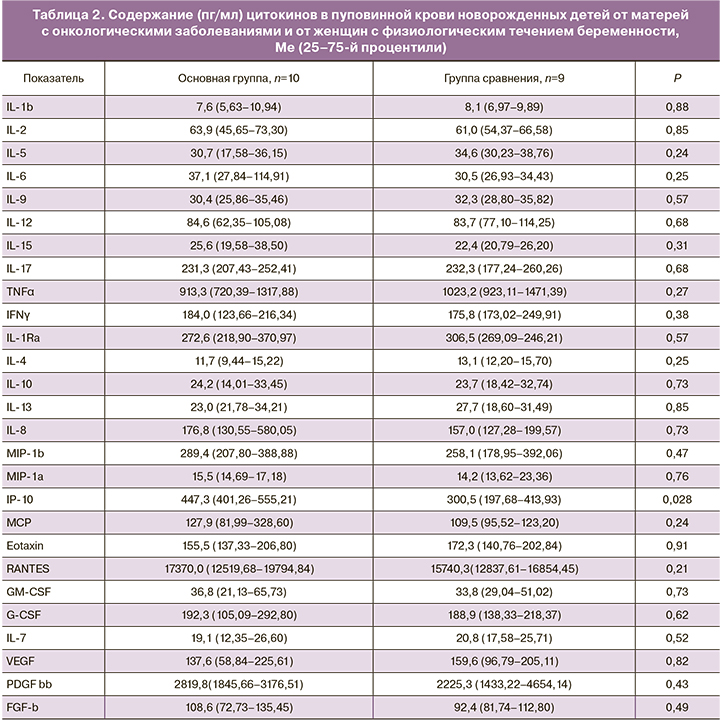
Ранее мы показали, что субпопуляционный состав лимфоцитов в пуповинной крови новорожденных детей от матерей с онкологическими заболеваниями, получавших химиотерапию во время беременности, статистически значимо не отличается от соответствующих показателей в пуповинной крови здоровых доношенных новорожденных от матерей с физиологическим течением беременности [11]. Мы проанализировали содержание растворимых факторов в плазме пуповинной крови обследованных детей (табл. 2).
Отмечено, что в пуповинной крови новорожденных от матерей с онкологическими заболеваниями, получавших ПХТ во время беременности повышено содержание индуцируемого IFNγ белка (IP-10) относительно группы сравнения. Данный хемокин секретируется в ответ на повышение концентрации IFNγ и необходим для привлечения моноцитов, Т-, NK- и дендритных клеток. Показано, что гиперпродукция IP-10 наблюдается при воспалительных состояниях, обусловленных Th1-иммунным ответом. IP-10 обладает ангиостатическими свойствами, в том числе при онкологических заболеваниях [14]. Уровень остальных исследуемых факторов статистически значимо не различался (P>0,05), что может свидетельствовать об отсутствии существенного воздействия на плод применяемой терапии.
Парное сравнение уровней цитокинов в пуповинной крови новорожденных и периферической крови их матерей выявило достоверно более высокое содержание IL-5, ростового фактора VEGF и хемокина MIP-1b в пуповинной крови новорожденных обеих групп по сравнению с периферической кровью их матерей (Р<0,01 во всех случаях).
В группе сравнения в пуповинной крови концентрация IFNγ, MCP-1 также выше, чем у матерей (Р<0,01). Напротив, содержание хемокина IP-10 в пуповинной крови было в 2,1 раза ниже, чем в женской (Р=0,0078).
В отличие от группы сравнения, в основной группе содержание IFNγ, MCP-1 и IP-10 у детей и женщин не различалось. В то же время уровень провоспалительных цитокинов IL-1b, IL-12, IL-15, хемокина IL-8 и тромбоцитарного ростового фактора PDGF bb, участвующего в регуляции сосудистого гомеостаза и ангиогенеза, статистически значимо выше в пуповинной крови, чем в периферической женской (Р<0,05 во всех случаях).
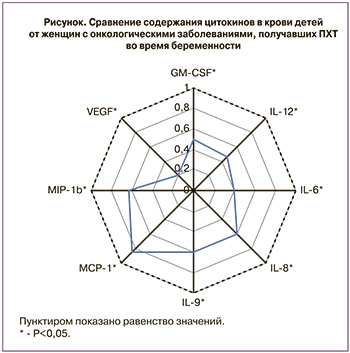
Принимая во внимание недостаток сведений об отсроченном эффекте ПХТ на состояние здоровья детей, мы оценили содержание цитокинов в плазме крови одних и тех же новорожденных из основной группы при рождении, на 3-и сутки жизни и спустя 1 месяц после рождения. Обнаружено статистически значимое снижение концентрации ряда цитокинов, хемокинов и ростовых факторов в плазме крови детей через месяц после рождения по сравнению с соответствующими показателями на 3-и сутки жизни (рисунок).
Показано отношение уровня исследуемых факторов в плазме крови детей в возрасте 1 месяца к их содержанию в крови новорожденных 3-х суток жизни.
Уменьшение концентрации исследуемых цитокинов может быть связано с их расходованием в связи с миграцией и активацией эффекторных клеток иммунной системы, вызванными адаптацией новорожденных к условиям внеутробного существования и заселением органов и тканей иммунными клетками. В то же время мы не выявили статистически значимых различий при сравнении концентрации анализируемых факторов в пуповинной и венозной крови новорожденных 3-х суток жизни, а также в крови детей при рождении и спустя 1 месяц (P>0,05). Обращает на себя внимание, что в периферической крови детей в возрасте 1 месяца содержание VEGF по-прежнему остается выше, чем в крови их матерей: 105,3 (49,66–155,55) пг/мл и 9,6 (4,87–15,87) пг/мл, Р=0,031. Данный факт может быть обусловлен продолжающимися постнатально процессами ангиогенеза.
Заключение
Таким образом, в результате проведенного исследования установлено, что цитокин-продуцирующая способность иммунных клеток у беременных с онкологическими заболеваниями, принимавших противоопухолевые химиопрепараты, снижена относительно здоровых беременных женщин. Применяемые матерью лекарственные средства не оказали существенного влияния на уровень цитокинов в пуповинной крови новорожденных. Физическое и психическое развитие детей от женщин из данной группы происходит в соответствии с возрастными нормами. К концу неонатального периода содержание цитокинов в крови новорожденных снижалось относительно соответствующих показателей в возрасте 3 суток жизни.



