Гипотензивная терапия пациенток с гипертензивными расстройствами во время беременности ограничена небольшим спектром лекарственных средств (ЛС), которые не обладают тератогенным эффектом. Наиболее часто применяемыми гипотензивными препаратами при беременности являются: препарат центрального действия, альфа2-адреномиметик, оказывающий тормозящий эффект на симпатическую импульсацию, Допегит (действующее вещество – метилдопа) и пролонгированный селективный блокатор кальциевых каналов Кордафлекс (действующее вещество – нифедипин). Допегит составляет первую линию гипотензивной терапии, при неэффективности которой дополнительно назначается Кордафлекс [1]. Их эффективность при преэклампсии (ПЭ) определяется клиническим фенотипом. При ПЭ ранней манифестации (рПЭ) гипотензивная терапия практически неэффективна и пролонгирование беременности весьма непродолжительно. При ПЭ поздней манифестации (пПЭ), патогенез которой обусловливается материнским фактором, связанным с предсуществующей эндотелиальной дисфункцией и ее усугублением вследствие развития стерильного воспаления в тканях плаценты [2], гипотензивная терапия более эффективна. Оба препарата вызывают вазодилатацию, снижая общее периферическое сопротивление сосудов за счет разных механизмов. Но влияние этих препаратов на вазоактивные медиаторы эндотелиальной дисфункции при ПЭ исследовано недостаточно. Имеются данные, главным образом in vitro исследований, демонстрирующие влияние метилдопы [3, 4] и нифедипина [5, 6] на продукцию эндогенного оксида азота (NO).
Наши предыдущие исследования, посвященные расширению понимания механизмов действия Допегита и Кордафлекса на сердечно-сосудистую систему при беременности, выявили значимое влияние этих препаратов на материнскую гемодинамику [7]. Было установлено, что провоспалительный фон и степень деструкции эндотелиального гликокаликса (эГК) системы кровообращения выражены в разной степени при рПЭ и пПЭ на фоне применения Допегита и Допегита в комбинации с Кордафлексом [8, 9]. Провоспалительные стимулы являются фактором деструкции эГК – структуры, участвующей в механотрансдукции, процессе, в результате которого происходят активация эндотелиальной синтазы NO (eNOS) и синтез эндогенного вазодилататора – NO [10, 11]. Также эГК служит в качестве «депо» для вазоактивных факторов и факторов, регулирующих сосудистый гемостаз. Учитывая результаты наших предыдущих исследований, выявивших связь между деструкцией эГК и нарушениями гемодинамики [12], и различный гликокаликс-протективный эффект гипотензивной терапии при разных клинических фенотипах ПЭ [7–9], нами было высказано предположение о нарушении баланса вазоконстрикторов/вазодилататоров у пациенток с ПЭ. Для его подтверждения проведено изучение «вазоактивного статуса» беременных с рПЭ на фоне назначения Допегита и его комбинации с Кордафлексом. Вазоактивный статус, под которым мы понимаем характеристику эндотелия и сосудов по количественным и функциональным показателям (включая показатели гемодинамики и показатели, отражающие способность эндотелия к продукции вазоактивных факторов), определяемым с помощью стандартных клинических и лабораторных методов, свидетельствовал о неэффективности гипотензивной терапии при рПЭ при обеих схемах лечения [13].
Целью данного исследования явилась характеристика вазоактивного статуса беременных с пПЭ, получающих различные схемы гипотензивной терапии: однокомпонентную терапию препаратом «Допегит» и двухкомпонентную терапию препаратами «Допегит»+«Кордафлекс».
Материалы и методы
Дизайн и критерии отбора исследования
Нерандомизированное контролируемое исследование, организованное по принципам Хельсинкской декларации Всемирной медицинской ассоциации, проводилось на базе ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России (далее Центр) в период с 10.01.2021 г. по 31.06.2023 г. Локальный этический комитет Центра одобрил план исследования и форму информированного согласия (протокол № 5 от 27 мая 2021 г.). В исследование включались 47 беременных на сроках, соответствующих срокам манифестации ПЭ с поздним началом (после 34 недель). Группу сравнения составили 18 беременных с физиологическим течением беременности. В основную группу были включены 29 беременных с ПЭ: на поздних сроках однокомпонентную гипотензивную терапию получали 15 (основная группа 1), двухкомпонентную – 14 беременных (основная группа 2). Критерии включения в обе группы, а также критерии невключения описаны в [13], поскольку данное исследование было частью цитируемого выше. Отбор беременных в исследование осуществлялся методом подбора пар на основании возраста, индекса массы тела (ИМТ) и срока беременности.
Схемы гипотензивной терапии
Все пациентки основной группы получали гипотензивную терапию, которая назначалась при АД≥140/90 мм рт. ст. согласно клиническим рекомендациями Минздрава РФ [1]. Беременным проводили суточное мониторирование артериального давления (СМАД, прибор BPLab, «Петр Телегин», Нижний Новгород, Россия), по данным которого осуществляли коррекцию дозы препаратов. Основным гипотензивным лекарственным средством для однокомпонентной гипотензивной терапии была метилдопа (Допегит): начальная доза составляла 750 мг/сут, с повышением при устойчивой гипертензии до 2000 мг/сут (средняя суточная доза 1500 мг). Двухкомпонентная гипотензивная терапия назначалась при стойком подъеме АД, неснижаемом приемом Допегита: в дополнение к Допегиту в дозе 2000 мг/сут назначался нифедипин (Кордафлекс) с начальной дозы 20 мг/сут, с повышением до 40 мг/сут при устойчивой гипертензии.
Оценка гемодинамического профиля матери
Оценивалась эффективность и проводилась коррекция гипотензивной терапии по данным СМАД. Анализ осциллограмм, полученных с прибора, выполняли с помощью программного обеспечения Vasotens (Россия). Перечень регистрируемых показателей гемодинамики и анализ осциллограмм аналогичен ранее представленному [7]. Анализировали: максимальное аортальное диастолическое АД (макс ДАДао); максимальное аортальное систолическое АД (макс САДао); минимальное аортальное диастолическое АД (мин ДАДао); минимальное аортальное систолическое АД (мин САДао); среднее аортальное диастолическое АД (ср ДАДао); среднее аортальное систолическое АД (ср САДао); время распространения отраженной волны по участку аорты (Reflected Wave Transit Time, RWTT); оценочную скорость пульсовой волны в аорте (Aortic Pulse Wave Velocity, PWVao); индекс аугментации (AIx); индекс ригидности артерий (Ambulatory Arterial Stiffness Index, АASI) – вычисляется как АASI=1-(наклон ДАД-САД); максимальную скорость нарастания давления (maximal rate of rise of arterial pressure, (dP/dt)max); амплификацию пульсового давления (Pulse pressure amplification, PPA); длительность периода изгнания (Ejection Duration, ED); индекс эффективности субэндокардиального кровотока (Subendocardial viability ratio, SEVR) [7, 12].
Оценка маточно-плацентарного и фетоплацентарного кровотоков
Ультразвуковое допплеровское исследование маточно-плацентарного и плодово-плацентарного кровотоков производилось на аппаратах экспертного класса (GE Voluson E8, США), аналогично ранее описанному [13]. Регистрировались следующие показатели: UtA-PI – пульсационный индекс (ПИ) в маточных, UmA-PI – пуповинной, MCA-PI – среднемозговой артериях, венозном протоке и церебро-плацентарное отношение (ЦПО).
Определение в крови факторов для оценки вазоактивного статуса
Материалом служила сыворотка периферической крови беременных, обработанная и депонированная в Биобанке Центра. Исследование проводилось методом иммуноферментного анализа на коммерческих наборах, перечень которых представлен в таблице 1. Определение общего NO на основании анализа нитратов/нитритов проводилось в соответствии с рекомендациями фирмы R&D systems для набора KGE001 с ультрафильтрацией сыворотки крови с использованием пробирок с фильтрами Amicon Ultra 0,5ML 10K 96PK (Millipore) и выделением низкомолекулярной фракции (менее 10 000 кДа), в которой проводилось определение нитратов/нитритов.
Статистический анализ
Для статистического анализа использовалась программа MedCalc версии 16.4 (MedCalc, Бельгия). Нормальность распределения данных проверяли по критерию Шапиро–Уилка. Количественные данные представлены в виде медианы (Ме) и максимального и минимального значения (Q0 – 0-й процентиль; Q4 – 100-й процентиль). Межгрупповые различия при сравнении трех и более групп по количественному показателю, распределение которого отличалось от нормального, рассчитывались с помощью критерия Краскела–Уоллиса с поправкой Бонферрони при р<0,025. Для апостериорных сравнений использовали U-критерий Манна–Уитни, при р<0,050. Нулевая гипотеза отвергалась при значении p-критерия менее 0,050. Корреляционный анализ проводился с вычислением коэффициента ранговой корреляции Спирмена; различия считали значимыми при р<0,050.
Результаты
По таким параметрам, как возраст, ИМТ и срок гестации на момент забора крови, все пациентки были сопоставимы, и основные вмешивающиеся факторы были устранены. Развитие ПЭ у пациенток основной группы обусловило значимо высокие показатели АД (табл. 2). Новорожденные в основной группе демонстрировали более низкую массу тела: значимая разница с группой сравнения выявлена только для новорожденных, родившихся от матерей, принимавших двухкомпонентную гипотензивную терапию (табл. 2), однако 0-й процентиль массы новорожденных в основной группе 1 был более низким, чем в основной группе 2. Срок родоразрешения был значимо ниже у беременных с ПЭ в обеих группах по сравнению с нормой, но у пациенток, принимающих двухкомпонентную терапию, значение медианы показателя было выше, чем у принимающих однокомпонентную терапию (табл. 2).
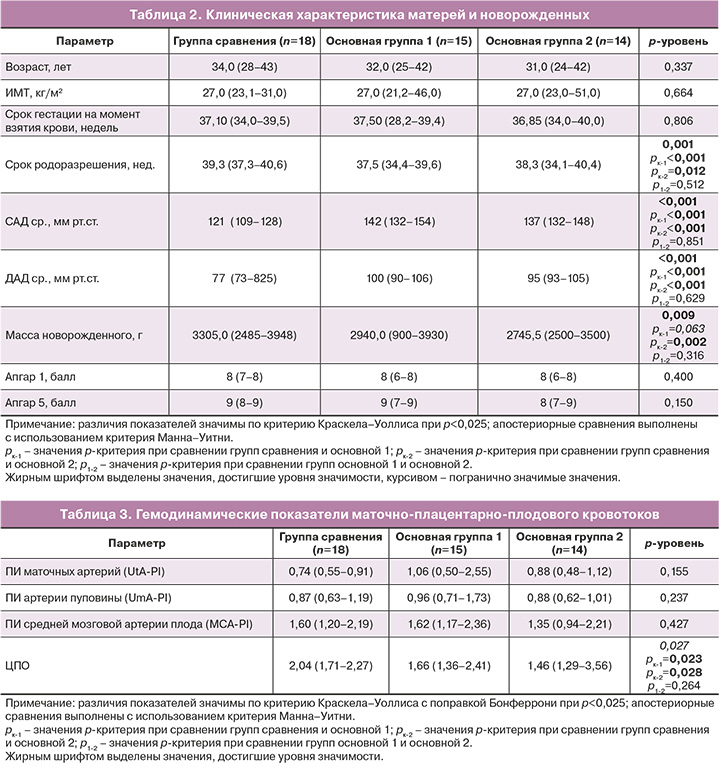
Анализ данных гемодинамики в системе мать-плацента-плод свидетельствует о сниженном ЦПО у пациенток с ПЭ, принимающих как моно-, так и двухкомпонентную гипотензивную терапию (табл. 3).
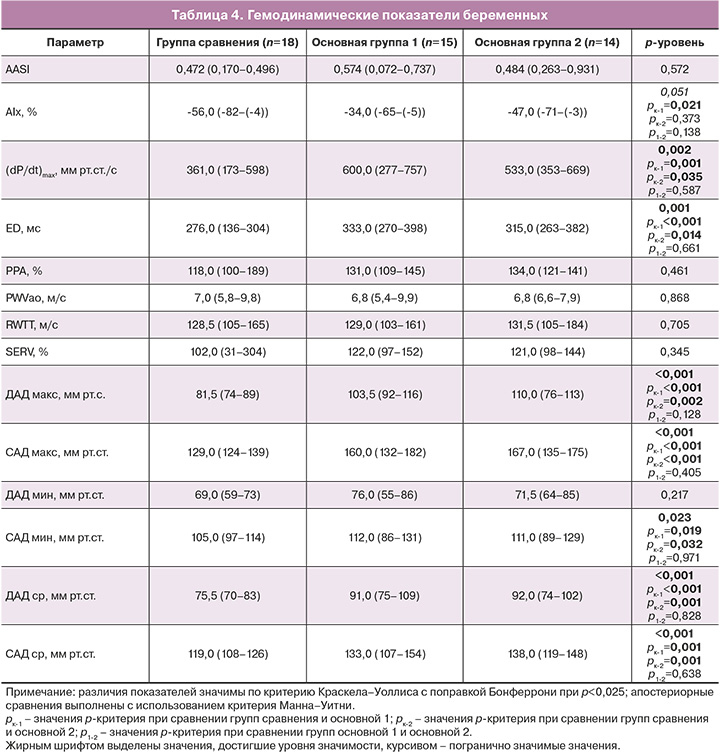
Анализ гемодинамического статуса беременных показал, что в основной группе выявляется погранично значимое увеличение индекса аугментации (AIx) – основного клинического параметра, отражающего ригидность артерий. При апостериорном анализе значимое повышение AIx установлено только у пациенток с монотерапией. У беременных с ПЭ, получающих обе схемы гипотензивной терапии, выявлено значимое повышение показателя (dP/dt)max, отражающего сократимость миокарда, суммарную жесткость магистральных артерий и динамическую нагрузку, а также показателя (ED), характеризующего относительную длительность периода изгнания левого желудочка. При этом более высокие значения показателя отмечались у беременных, получающих монотерапию. Суточные тренды АД демонстрировали значимо высокие значения САД и ДАД в основной группе (табл. 4).
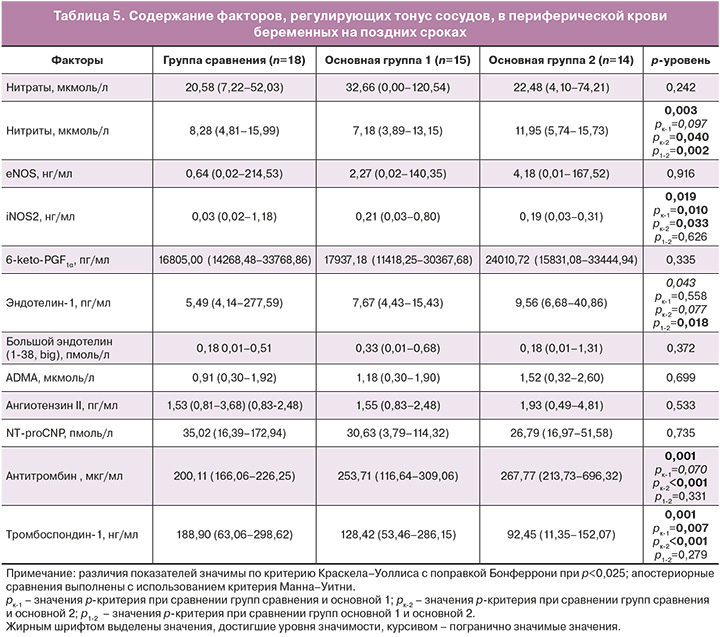
Профиль вазоактивных факторов, идентифицированных в крови беременных, свидетельствует об относительной компенсации содержания основных ферментов, синтезирующих вазоактивные молекулы, и стабильных метаболитов NO и простациклина у беременных основной группы. Так, содержание метаболитов NO нитратов не отличалось от группы сравнения, а содержание нитритов – основных метаболитов, которые более точно отражают изменение эндогенного NO [14], демонстрировало тенденцию к снижению у беременных, получавших однокомпонентную терапию, и, напротив, было значимо выше у принимающих двухкомпонентную терапию. Содержание ключевого фермента, ответственного за продукцию эндогенного NO, – eNOS значимо не отличалось между сравниваемыми группами. Напротив, уровень индуцибельной синтазы NO (iNOS2) был значительно (в 6–7 раз) выше в крови беременных с ПЭ на фоне обеих схем терапии, чем в группе сравнения (табл. 5). Содержание 6-keto-PGF1α – стабильного метаболита простациклина значимо не различалось в обследованных группах. Факторы с вазоконстрикторным эффектом (эндотелин-1, большой эндотелин-1, ADMA и ангиотензин II) демонстрировали некоторое повышение содержания в основных группах, однако заданный уровень значимости достигнут не был. Пограничный уровень значимости установлен при повышении содержания эндотелина-1 у беременных с двухкомпонентной терапией; вместе с тем по содержанию этого фактора беременные с одно- и двухкомпонентной гипотензивной терапией значимо различались между собой (табл. 5). При межгрупповом анализе выявлены значимые различия в содержании антитромбина: апостериорный анализ продемонстрировал его значимое повышение у беременных с двухкомпонентной терапией; при однокомпонентной – повышение также выявлено, но с пограничным уровнем значимости. Значимое снижение содержания в крови тромбоспондина-1 выявлено при обеих схемах лечения, более выраженное в группе 2, что подтверждено при апостериорном анализе (табл. 5).
Обсуждение
Эффекты, вызванные увеличением объема циркулирующей крови и, соответственно, возрастанием сердечного выброса во время физиологически протекающей беременности, компенсируются за счет развития NO-индуцированной системной дилатации сосудов [15], что обеспечивает адаптацию сердечно-сосудистой системы беременной к нагрузке и позволяет осуществлять контроль АД [14]. Увеличивающийся со сроком беременности синтез NO [16, 17] обеспечивает снижение периферического сосудистого сопротивления и увеличение маточно-плацентарного кровотока [14, 17].
Синтез NO в эндотелии сосудов осуществляет eNOS, которая в присутствии кислорода инициирует превращение L-аргинина в L-цитруллин с выделением NO. Активация эндотелия с переходом в эндотелиальную дисфункцию вызывает постепенное снижение экспрессии и активности eNOS, что ведет к снижению продукции и биодоступности NO. На снижение продукции NO также влияет избыток ADMA (асимметричного диметиларгинина), являющегося конкурентным ингибитором связывания L-аргинина с еNOS [18, 19]. Развитие патологических процессов в сосудах, сопровождающихся провоспалительными изменениями и генерацией активных форм кислорода, стимулирует экспрессию iNOS, активностью которой опосредуется патологический синтез NO. В патогенезе артериальной гипертензии, в том числе развившейся при беременности, недостаточная продукция eNOS/NO с нарушением NO-связанных сигнальных путей, наряду с нехваткой субстрата фермента, избытком его конкурентного ингибитора и стимуляцией продукции факторов с вазоконстрикторным действием, является ключевым этапом [20, 21], который должен подвергаться фармакологической коррекции.
В данном исследовании были рассмотрены ведущие факторы, участвующие в регуляции сосудистого тонуса, в том числе стабильные метаболиты основных вазодилататоров: простациклина и NO. Поскольку в крови NO быстро окисляется до нитрита и нитрата [22] и уровень нитрита отражает уровень эндогенного NO (около 70% нитритов крови образуются в результате ферментативной активности eNOS) [14], уровень этих стабильных метаболитов, измеренный в крови беременных, принимался как основа для интерпретации различного содержания эндогенного NO в группах исследования. У беременных с однокомпонентной терапией уровни в крови eNOS, эндогенного NO и 6-keto-PGF1α были сопоставимы с группой сравнения. При двухкомпонентной терапии уровни 6-keto-PGF1α и eNOS не отличались от группы сравнения, а содержание нитритов в крови было в 1,5 раза значимо выше, чем в норме. У беременных, пролеченных по обеим схемам гипотензивной терапии, содержание iNOS, напротив, значительно превышало значения этого фактора в группе сравнения. По-видимому, терапия способствует восстановлению адекватного функционирования биосинтетического аппарата клеток, т.к. при монотерапии уровень содержания в крови взаимосвязанных факторов NO/eNOS сопоставим с нормой. Гиперпродукция NO, выявляемая у беременных, принимающих двухкомпонентную терапию, может быть обусловлена двумя факторами или их сочетанием: 1) эффектом за счет стимуляции экспрессии eNOS (уровень экспрессии eNOS, не достигая заданного уровня значимости, был самым высоким у этих пациенток); 2) высоким уровнем продукции iNOS (однако содержание фермента было сопоставимо с выявленным в группе с монотерапией, где гиперпродукции не обнаружено). Оба фактора нельзя исключить, поскольку для доказательства первого может быть недостаточно мощности исследования вследствие небольшого числа беременных в группе. Однако в пользу этого эффекта свидетельствуют низкие значения содержания тромбоспондина-1 у беременных основной группы, особенно при двухкомпонентной терапии. Поскольку тромбоспондин 1 является антагонистом NO, устраняя его расслабляющий эффект на клетки гладкой мускулатуры сосудов [23], подавление его продукции у беременных основной группы, что, возможно, опосредуется терапией, должно благоприятно влиять на продукцию NO и тонус сосудов. Второй фактор косвенно подтвержден в нашем предыдущем исследовании [8], где было установлено, что у беременных с пПЭ, пролеченных по аналогичным схемам с использованием Допегита и Кордафлекса (часть пациентов вошли в данное исследование), на фоне приема препаратов выявлена провоспалительная активация, проявляющаяся в высоком уровне продукции фактора некроза опухоли-α, интерлейкина-18 и интерлейкина-6, что более выражено у беременных, принимающих двухкомпонентную терапию [8]. Поскольку одним из факторов продукции iNOS является провоспалительная стимуляция, высокий уровень нитритов крови у беременных с двухкомпонентной терапией может быть обусловлен NO-продуцирующей активностью iNOS.
Необходимо также отметить отсутствие значимых различий между сравниваемыми группами по содержанию факторов, способствующих вазоконстрикции: эндотелина-1, его предшественника – большого эндотелина, ангиотензина II и ADMA (табл. 5), что может быть свидетельством контроля продукции вазоконстрикторов у пациенток основных групп на фоне обеих схем терапии. Несмотря на то что исходный вазоактивный статус у беременных до назначения терапии не был определен, дисбаланс, проявляющийся в снижении продукции вазодилататоров и возрастании вазоконстрикторов, отмечен при ПЭ в многочисленных исследованиях [15, 20, 24]. Вследствие этого можно сделать вывод, что гипотензивная терапия обеспечивает контроль гуморальной регуляции сосудистого тонуса и способствует балансу между вазоконстрикторами и вазодилататорами при ПЭ на поздних сроках беременности. Несмотря на то что у матерей выявлялись гемодинамические изменения на фоне обеих схем терапии (более выраженные изменения проявлялись у беременных при двухкомпонентной терапии, табл. 4), это не являлось неблагоприятным фактором, воздействующим на перинатальные исходы и гемодинамику в системе мать-плацента-плод (табл. 2, 3). Напротив, на фоне двухкомпонентной гипотензивной терапии отмечено более высокое значение медианы срока родоразрешения, что является положительной тенденцией, поскольку при тяжелой ПЭ отмечаются более раннее родоразрешение [25], высокая частота и тяжесть гемодинамических осложнений у матери [26]. В аналогичном исследовании, проведенном нами у пациенток с рПЭ [13], несмотря на применение тех же гипотензивных препаратов и схем лечения, эффекта от терапии установлено не было, что оценивалось по измененному гуморальному профилю факторов, регулирующих сосудистый тонус (низким значениям показателей содержания нитритов, eNOS и высоким – iNOS, большого эндотелина и ангиотензина II), выраженным изменениям показателей допплерометрии и показателей гемодинамики матери, ранним неблагоприятным перинатальным исходам у пациенток с рПЭ на фоне обеих схем терапии. Обращает на себя внимание факт, что в цитируемом выше исследовании были выявлены корреляционные связи, предполагающие влияние, оказываемое NO на гемодинамику матери, фетоплацентарной системы и продукцию ангиотензина II, iNOS и тромбоспондина-1 на ранних сроках беременности [13]. В данном исследовании таких связей и, соответственно, их влияния установлено не было. Как один из аспектов изменений, выявляемых на фоне гипотензивной терапии у беременных основных групп, можно отметить повышенный уровень антитромбина, который, являясь естественным антикоагулянтом, улучшает реологию крови, что очень важно у беременных с ПЭ. Этот эффект был отмечен и в исследовании [13], который был интерпретирован как предрасположенность к кровотечениям.
Заключение
Исследование вазоактивного статуса беременных с пПЭ позволило установить наличие баланса вазоконстрикторов/вазодилататоров в крови пациенток на фоне терапии, что можно отнести за счет эффективности и адекватности гипотензивной терапии. Дополнительное назначение Кордафлекса всегда обосновывается неэффективностью монотерапии Допегитом, и статус беременных с двухкомпонентной терапией признается более тяжелым. Однако представленные данные свидетельствуют, что вазоактивный статус и гемодинамический профиль «более тяжелых» беременных с двухкомпонентной терапией были более скомпенсированными, чем при однокомпонентной терапии. По-видимому, применение двух гипотензивных препаратов с разными механизмами действия более благоприятно действует на сердечно-сосудистую систему беременных и адекватно регулирует синтетическую функцию эндотелиальных клеток. Важным аспектом данного исследования также является выявленная тенденция к более длительному пролонгированию беременности у пациенток с двухкомпонентной терапией. Эти данные обосновывают преимущественное использование двухкомпонентной гипотензивной терапии у беременных с пПЭ и тем самым смену парадигмы фармакотерапии c переходом к обоснованному использованию лекарственных средств с разными механизмами действия на эндотелий и сосуды.



