Преэклампсия (ПЭ), занимая лидирующие позиции в структуре патологии беременности, в настоящее время остается одной из наиболее актуальных проблем современного акушерства. ПЭ возникает в 2–8% беременностей и является ведущей причиной материнской и перинатальной заболеваемости и смертности, особенно в случае ее возникновения до 34 недель беременности [1–6]. Имеются подтверждения того, что данное состояние является следствием недостаточной инвазии трофобласта в материнские спиральные артерии [7]. Применение допплерометрии для оценки сопротивления току крови в маточных артериях может выявлять беременности, протекающие с нарушением процесса инвазии трофобласта. Скрининговые исследования в 20–24 недели показали, что выявляемость беременностей с последующим развитием ПЭ, требующей раннего родоразрешения, составляет 50–70% при 5% частоте ложноположительных результатов [8]. Однако такая поздняя выявляемость группы высокого риска может приводить к неудачам от терапевтических мероприятий, таких как профилактическое назначение аспирина, направленных на снижение риска ПЭ. В то же время существуют данные о том, что назначение аспирина в первом триместре может значимо снижать риск последующего развития ПЭ, требующего раннего родоразрешения [9]. В этой связи представляется важным разработка метода эффективного выявления группы беременных высокого риска на ранних сроках беременности. Несмотря на то, что существует возможность прогнозирования ранней ПЭ с помощью допплерометрии маточных артерий в первом триместре, подобный скрининг сопряжен с высокой частотой ложноположительных результатов [10, 11].
Плацентарный фактор роста (PlGF), гликозилированный димерный гликопротеин, является членом подсемейства сосудистого эндотелиального фактора роста (VEGF), имеет четыре изоформы, способен связываться с рецептором растворимой тирозинкиназы 1 типа (sFlt1) [12]. В процессе раннего эмбриогенеза PlGF, наряду с VEGF, контролирует васкуляризацию децидуальной ткани, рост и развитие клеток трофобласта. PlGF синтезируется в ворсинчатом и вневорсинчатом цитотрофобласте и выполняет как васкулогенную, так и ангиогенную функции. Предполагается, что его ангиогенные способности играют роль в нормальном течении беременности, а изменение уровней PlGF или ингибирование рецепторов его связывания задействованы в развитии ПЭ [12, 13]. ПЭ ассоциирована со снижением продукции PlGF и в ряде исследований сообщается о том, что во время клинической манифестации ПЭ концентрации PlGF в материнской сыворотке снижаются. Снижение сывороточных уровней PlGF предшествует клинической манифестации заболевания, и это находит свое подтверждение в исследованиях, проведенных в первом и во втором триместрах беременности [14–18].
Целью данного исследования было изучение прогностической ценности определения в первом триместре беременности материнского сывороточного PlGF для прогнозирования ранней ПЭ, требующей родоразрешения до 34 недель беременности, в комбинации с данными ультразвуковой допплерометрии маточных артерий.
Материал и методы исследования
Объектом проспективного исследования случай-контроль по методу вложенной выборки (nested case-control study) явились беременные, обратившиеся в клинику ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России в сроки с 11+0 до 13+6 недель для проведения комбинированного скрининга на предмет определения индивидуального риска хромосомных аномалий (синдром Дауна и др.) и диагностики грубых пороков развития плода. Критериями включения для всех участников исследования являлись I триместр беременности (интервал от первого дня последней менструации до момента включения в исследования 11+0 нед – 13+6 нед), копчико-теменной размер (КТР) ≤84 мм); одноплодная беременность; возраст беременных от 18 до 50 лет; подписанное информированное согласие на участие в исследовании, одобренное Этическим комитетом Центра. Критериями исключения из исследования были грубые хромосомные или структурные аномалии плода; неразвивающаяся беременность или самопроизвольный выкидыш до 22 недель беременности; пузырный занос; прерывание беременности по социальным показаниям.
Концентрация PlGF в сыворотке матери определялась без получения информации об исходах беременности. Оценка уровней PlGF проводилась методом иммунофлуоресценции на оборудовании DELFIA Xpress и реактивах DELFIA kits (Perkin-Elmer Life and Analytical Sciences, Turku, Finland). По степени флуоресценции оценивалась концентрация маркера, диапазон измерения концентраций для PlGF составлял 7 – 4000 пг/мл. Сыворотка крови хранилась при температуре -80°С для возможного последующего биохимического анализа.
Определение пульсационного индекса маточных артерий проводилось при значении КТР плода от 45 до 84 мм. В каждом случае при эхографичеcком исследовании после визуализации канала шейки матки и внутреннего зева в саггитальном срезе ультразвуковой датчик аккуратно смещался из стороны в сторону для идентификации правой и левой маточных артерий с использованием режима цветового картирования. Исследование всей ширины сосуда достигалось при помощи импульсного допплеровского режима с контрольным объемом 2 мм и углом инсонации не более 30°. После получения трех одинаковых волн кривой скорости кровотока в маточной артерии измерялся пульсационный индекс (UtA PI) и рассчитывалось среднее значение PI в левой и правой маточной артериях [19].
Данные об исходах беременностей собирались в ходе анализа историй родов пациенток, родоразрешенных в акушерской клинике Центра, а также путем телефонного интервьюирования пациенток по истечении срока родов. Выяснялись срок и место родоразрешения, масса и рост ребенка при рождении, наличие осложнений беременности и родов у матери и плода/новорожденного, наличие повышенного артериального давления и протеинурии во второй половине беременности. На основе полученной информации были сформированы следующие две группы: группа контроля (физиологическая беременность без развития гипертензивных расстройств во время беременности и задержки роста плода) и группа ранней ПЭ (наличие протеинурии и артериальной гипертензии, потребовавших родоразрешения до 34 недель беременности). Диагноз ПЭ ставился на основании рекомендаций Международного общества по изучению гипертензии при беременности (International Society for the Study of Hypertension in Pregnancy) [1, 20].
Статистический анализ
Для сравнения качественных данных и установления значимых различий между ними использовался тест χ2 Пирсона, для вычисления которого прибегали к построению таблиц сопряженности. Для сравнения непрерывных переменных применялся U-тест Манна–Уитни. Различия между величинами считали статистически значимыми при уровне достоверности p<0,05.
Измеренные значения PlGF, PI маточных артерий, среднего артериального давления выражались в относительных единицах, кратных значениям медиан (multiple of median, MoM) для данного срока беременности в группе контроля с нормально протекающими беременностями. Сравнения MoM между основной группой и контрольной выполнялось с помощью теста ранговых сумм Вилкоксона.
Статистическое моделирование выполнялось с целью определения скринингового потенциала комбинированной оценки PI маточных артерий (UtA PI) и сывороточного PlGF. Оно включало в себя оценку отношения правдоподобия (ОП) в виде шанса развития у женщины ПЭ, требующей родоразрешения до 34 недель, полученного исходя из уровня маркера, отнесенного к шансу нормального исхода. Изучение значений MoM показало, что ни один из маркеров не имел Гаусовское распределение, как до трансформации, так и после логистической трансформации. Таким образом, логистическая регрессия применялась для моделирования отношений правдоподобия, полагая, что оба маркера являются независимыми факторами риска. Логистическая регрессия позволяла получить отношение шансов (ОШ) для ранней ПЭ, показывая значимость маркера для женщины. Затем проводились вычисления ОП маркер = ОШ маркер/Р, где P – шанс развития ПЭ, требующей раннего родоразрешения, который составлял 1:120 в популяции, из которой были отобраны случаи и контроли. Комбинированное ОП при условии независимости переменных вычислялось по формуле: ОП комбинированное = ОП PlGF x ОП PI = ОШ PlGF x ОШ PI/P2.
 Чтобы избежать эффекта «переобучения», когда построенная модель хорошо объясняет примеры из обучающей выборки, но относительно плохо работает на примерах, не участвовавших в обучении, ОШ PlGF и ОШ PI рассчитывались для каждого пациента с помощью уравнения логистической регрессии и оценивались в условиях моделирования.
Чтобы избежать эффекта «переобучения», когда построенная модель хорошо объясняет примеры из обучающей выборки, но относительно плохо работает на примерах, не участвовавших в обучении, ОШ PlGF и ОШ PI рассчитывались для каждого пациента с помощью уравнения логистической регрессии и оценивались в условиях моделирования.
Точность скрининга оценивалась с помощью методологии анализа характеристической кривой (receiver-operating characteristics, ROC) для отношений правдоподобия. Общая точность определялась областью под ROC-кривой и соответствующим 95% доверительным интервалом. Частота истинно-положительных результатов принималась за 90%, частота ложно-положительных результатов рассчитывалась для скрининга с PlGF и PI как по отдельности, так и вместе.
Анализ данных выполнялся с помощью электронных таблиц Microsoft Excel, пaкета статистических программ SPSS 22.0 (IBM SPSS Software, США), Medcalc for Windows 9.6.2.0 (MedCalc Software, Mariakerke, Belgium).
Результаты исследования
Эпидемиологические и клинические характеристика группы ранней ПЭ (требовавшей родоразрешения до 34 недель) и группы контроля (неосложненного течения беременности) приведена в табл. 1.
Как видно из представленных данных, различия в количестве нерожавших беременных в контрольной группе и группе беременных с развившейся впоследствии ранней ПЭ были незначимыми. Интересно, что каждая десятая беременность в контрольной группе (10,1%) была достигнута в результате вспомогательных репродуктивных технологий (ВРТ), однако статистически значимых различий в группах по данному фактору выявлено не было (p=0,976). Также статистически незначимо было различие в частоте ПЭ в анамнезе пациенток обеих групп (15,4 и 2,5% соответственно, p=1,166).
В группе контроля значения медиан UtA PI составили для 11, 12 и 13 недель 1,49, 1,62 и 1,41; медиана PlGF (интерквартильный размах) – 38,2 (25,8–47,4), 32,9 (24,4–55,8) и 31,8 (20,3–39,8) пг/мл соответственно. Значения 25-й, 50-й и 75-й квартили в MoM составили для PI 0,76, 0,95 и 1,11, для PlGF 0,74, 0,94 и 1,19 соответственно. Не было выявлено значимых связей между PlGF и PI в MoM (r=0,03). Ни PlGF, ни PI значимо не ассоциировались с возрастом матери, паритетом или весом, в связи с чем не было необходимости вводить поправку для данных переменных.
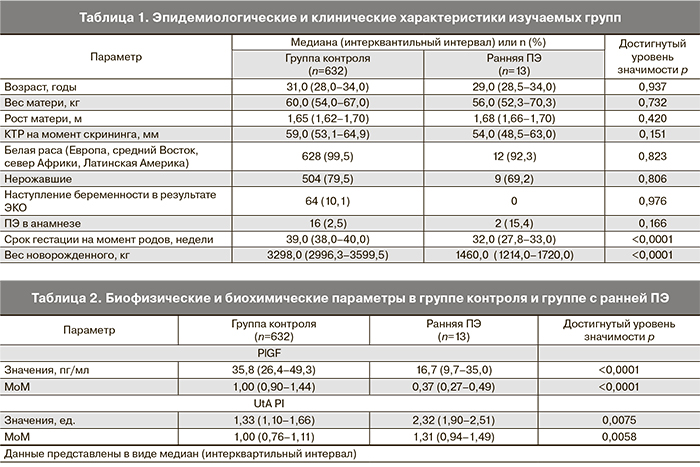
В случаях развития ПЭ, потребовавшей родоразрешения до 34 недель, в сравнении с группой неосложненных беременностей медиана PI маточных артерий были выше (1,31 MoM; p<0,05), медиана уровня сывороточного PlGF была ниже (0,60 MoM; p<0,001) (рис. 1, табл. 2). Сывороточные уровни PlGF были ниже чувствительности метода в 4 (30%) случаях ранней ПЭ и в 6 (1%) случаях группы контроля.
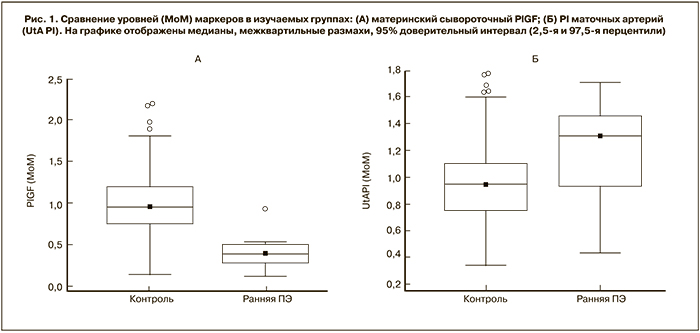
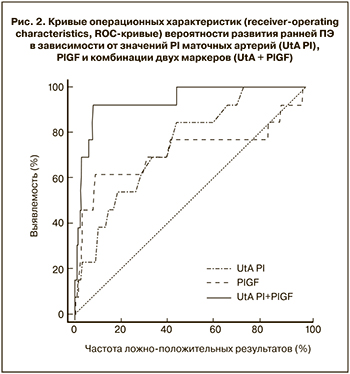
На рис. 2 показаны ROC-кривые прогностической модели для рисков на основе соответствующих уравнений. Для 90% частоты выявляемости ранней ПЭ частота ложноположительных результатов скрининга с PlGF составила 12% (95% ДИ: 9–15%), с PI маточных артерий – 67% (95% ДИ: 31–70%) и при комбинации двух методов – 9% (95% ДИ: 6–12%). Для 10% частоты ложноположительных результатов выявляемость составила для PlGF 61% (95% ДИ: 31–85%), для PI 38% (95% ДИ: 16–69%) и для комбинации двух маркеров – 92% (95% ДИ: 60–100%).
Обсуждение
Результаты нашего исследования показывают, что у женщин с последующим развитием ПЭ, требующей родоразрешения до 34 недель, концентрация материнского сывороточного PlGF в 11+0 – 13+6 недель беременности значимо ниже, чем при нормально протекающих беременностях. Исследование продемонстировало, что измерение материнского сывороточного PlGF в ранние сроки беременности в комбинации с ультразвуковой допплерометрической оценкой сопротивления кровотоку в маточных артериях может являться эффективным скрининговым методом для подобного осложнения беременности. Для 10% частоты ложноположительных результатов выявляемость ранней ПЭ составила для материнского сывороточного PlGF в качестве прогностического маркера 61%, для PI маточных артерий 38% и для комбинации двух маркеров 92%.
Полученные данные согласуются с наблюдениями о том, что ранняя ПЭ ассоциируется с нарушением плацентации, связанной со снижением проангиогенных факторов, одним из которых является PlGF [21]. Poon и соавт. (2009) описали множественную логистическую регрессионную модель скрининга на ПЭ в 11-13+6 недель беременности [22]. Эта модель определяла риск для всех женщин на основе изучения демографических факторов риска, среднего артериального давления, пульсационного индекса (PI) при допплерометрии маточных артерий и биохимических маркеров PAPP-A и PlGF. Данная модель была наиболее эффективной при скрининге на ПЭ, которая требовала родоразрешения в сроки беременности <34 недель («ранняя» ПЭ) с чувствительностью >90% при специфичности 95%. Модель была менее эффективной при выявлении женщин с поздней ПЭ или с риском последующего развития гестационной гипертензии. Это является существенным фактом, поскольку ранняя тяжелая форма ПЭ развивается менее, чем у 20% женщин, несмотря на то, что является причиной большинства случаев материнской и перинатальной смертности и заболеваемости. В этой связи эффективная терапия, снижающая частоту трансформации ранней ПЭ в тяжелую форму была бы оправданным и важным воздействием.
В настоящее время всем беременным женщинам предлагается скрининг на хромосомные анеуплоидии (трисомия 21 и др.) путем комбинированной оценки материнских сывороточных PAPP-A и свободной субъединицы β-hCG, а также оценки толщины воротникового пространства в 11+0 – 13+6 недель. Учитывая данные мировой литературы и результаты собственных исследований, представляется вполне оправданным рассмотрение вопроса о расширении панели биохимического скрининга за счет добавления к уже имеющимся двум маркерам материнского сывороточного PlGF. Аргументом для этого служат также данные о том, что наряду с возможностью скрининга на ПЭ [23] добавление PlGF повышает эффективность скрининга хромосомных анеуплоидий за счет снижения частоты ложноположительных результатов, минимизации частоты инвазивных процедур [24–26]. Биохимическое тестирование может осуществляться во всех ведущих лабораториях, регулярно проводящих аудит качества. Допплерометрическая оценка маточных артерий должна выполняться в ходе скрининга в первом триместре обученными данной методике и получившими сертификат врача пренатальной диагностики специалистами.
Нами был продемонстрирован подход по расчету индивидуального риска по развитию ранней ПЭ. Подобный подход, повсеместно используемый для оценки риска на трисомию 21, полезен как для эпидемиологов в оценке эффективности скрининга, так и для пациентов и их докторов в определении тактики дальнейшего ведения беременности. Существующие в настоящее время стратегии профилактики ПЭ являются предметом активного обсуждения. Имеются доказательства в поддержку профилактического назначения аспирина в низких дозировках с первого триместра беременности, что может снижать частоту тяжелых форм заболевания [9, 27, 28]. Проведенное исследование направлено на поиск оптимального пути выявления беременных высокого риска по развитию ранней ПЭ с последующей возможностью терапевтических воздействий для отобранной группы пациенток с целью снижения риска развития тяжелых форм заболевания.
Заключение
Данное исследование подтверждает значимость проведения скрининга на наиболее тяжелую раннюю форму ПЭ, требующую родоразрешения до 34 недель беременности, уже в первом триместре путем комбинированной оценки PlGF в материнской сыворотке и PI в маточных артериях в ходе допплерометрии. Требуют дальнейшего подтверждения и уточнения в крупных многоцентровых исследованиях данные о возможности прогнозирования ПЭ на основе комбинированной оценки биофизических и биохимических маркеров, материнского анамнеза, а также об эффективности назначения терапевтических вмешательств в группе высокого риска по развитию ПЭ с целью снижения частоты тяжелых форм заболевания.



