Метаболомная болезнь, к которой относится гестационный сахарный диабет (ГСД), занимает одно из ведущих мест в классификаторах ВОЗ [1–4]. В динамике последних 20 лет отмечается его значительный прирост во всех странах мира с 3–4% до 8–22% [5–9], в связи с чем изучению механизмов формирования ГСД придается большое значение. ГСД относится к заболеваниям, которые проявляются в виде гипергликемии, обнаруженной впервые во время гестации. Из всех случаев беременностей, сопровождающихся сахарным диабетом, ГСД обнаруживается в 90% случаев [5, 10–13].
Известно, что формированию нарушений углеводного обмена способствует выраженная гормонпродуцирующая функция синцитиотрофобласта, децидуальных структур и плаценты, которые обладают выраженной гормонпродуцирующей функцией [14, 15]. Одной из ведущих функций этих структур является синтез контринсулярных гормонов, что приводит к инсулинорезистентности [15, 16], которая совместно с гиперинсулинизмом опосредует формирование нарушений практически всех видов обмена и гормональных отклонений, опосредующих системное воспаление, эндотелиопатию, нарушения в балансе про- и антикоагулянтного звеньев гемостаза и т.д. [17, 18]. В связи с этим ГСД многими авторами признается генетически детерминированным проявлением дезадаптации материнского организма к гестационной перестройке [2, 5, 11, 19, 20], являющимся предиктором целого ряда акушерских осложнений, перинатальной заболеваемости и смертности [10, 14, 21–23]. В свою очередь, дезадаптация материнского организма может потенцироваться спецификой отношений между материнским и плодовым организмами, обусловленной целым рядом их фено- и генотипических признаков [4].
Традиционно при изучении гестационных осложнений механизмы плодо-материнского взаимодействия принято рассматривать в рамках системного подхода, воплощенного в концепцию о функциональной системе «мать-плацента-плод» (ФСМПП) [20, 24]. Однако данная концепция не учитывает важного признака, характерного для подсистемы «плод», его половой принадлежности. Уже появились исследования, свидетельствующие о модулирующей роли пола плода в формировании плодо-материнского «сигналинга», опосредующего характер акушерских осложнений [24–26]. Официально FIGO признала мужской пол плода фактором риска преждевременных родов [4, 27]. Этот же вариант полового диморфизма влияет на повышение риска возникновения плацентарной дисфункции вследствие нарушения процессов инвазии трофобласта [28–30]. Что касается женского пола плода, то для него характерна большая частота преэклампсии, однако тяжелые ее формы чаще наблюдаются при мужском поле плода [24, 29]. Согласно данным Т.Л. Боташевой и соавт. (2020), установлена большая частота ГСД при мужском поле плода [29], однако в литературе практически отсутствуют данные, объясняющие взаимосвязь частоты ГСД и, возникающих на его фоне акушерских осложнений с полом вынашиваемого плода.
Цель исследования: изучение механизмов формирования ГСД и акушерских осложнений, развивающихся на его фоне в зависимости от пола плода.
Материалы и методы
Исследование включало в себя ретроспективный и проспективный подходы при формировании клинических групп. Для изучения частоты возникновения ГСД и акушерских осложнений, развивающихся на его фоне, ретроспективно из 3780 первородящих женщин с одноплодной беременностью, проходивших обследование в отделении патологии беременности НИИАП ФГБОУ ВО «РостГМУ» Минздрава России в период с 2018 по 2021 гг., путем рандомизации с использованием программы Excel пакета MS Office (функция «Случмежду») были отобраны 2048 пациентки «0» группы (из которых 1114 – беременные плодами мужского пола и 943 – беременные плодами женского пола).
В рамках проспективного фрагмента исследования для изучения особенностей гормонального профиля при помощи критериев включения и исключения из пациенток поликлинического отделения были выбраны 642 женщины в возрастном диапазоне от 18 до 28 лет со спонтанно наступившей одноплодной беременностью, которые составили 2 основные клинические группы. В I клиническую группу вошли 328 пациенток с ГСД: из них 152 – с плодами мужского пола (Iа группа) и 176 – с плодами женского пола (Iб группа). II клиническую (контрольную) группу составили 314 женщин с физиологической беременностью (ФБ): из них 158 – с плодами мужского пола (IIа группа) и 156 – с плодами женского пола (IIб группа).
Критериями включения в I клиническую группу явились: любая гипергликемия натощак и после глюкозотолерантного теста, впервые обнаруженная на любом сроке беременности (специальные критерии ВОЗ, 2013) (5,1–7,1 ммоль/л), показатель гликированного гемоглобина (HbA1c) (≥6,5%) (сертифицированный в соответствии с National Glycohemoglobin Standartization Program (NGSP) и референсными значениями Diabetes Controland Complications Study (DCCT)), отсутствие использования любых видов инсулинотерапии и гормонотерапии. Беременные I клинической группы с ГСД не имели тяжелой акушерской патологии.
Критериями включения во II клиническую группу явились: первая одноплодная спонтанная беременность; отсутствие акушерских осложнений по итогам клинических, гормональных, биохимических, ультразвуковых и допплерометрических исследований.
К критериям исключения были отнесены: сахарный диабет 1-го и 2-го типа; повторные беременности и роды; врожденные пороки развития и хромосомные аномалии у плода; программы вспомогательных репродуктивных технологий; декомпенсированные формы экстрагенитальной патологии; врожденные пороки развития, в том числе аномалии строения мочеполовой системы женщин; отказ женщины от участия в исследовании, использование инсулинотерапии.
Определение уровней гормонов (кортизола, адренокортикотропного гормона (АКТГ), прогестерона, свободного эстриола, плацентарного лактогена) осуществлялось методом иммуноферментного анализа. Обсчет результатов проводился на фотометре TECAN SUNRISE (Австрия). Продукцию мелатонина определяли по уровню экскреции с утренней мочой 6-сульфатоксимелатонина (6-СОМТ) (его основного метаболита) – набор ELISA (BUHLMANN 6-Sulfatoxymelatonin ELISA, Германия).
При проведении исследований четко соблюдались условия кратности, последовательности и времени их проведения; забор проб крови у беременных осуществлялся до проведения лечебных мероприятий. У всех беременных получено информированное согласие на участие в исследовании. Данное исследование было одобрено локальным Этическим комитетом ФГБОУ ВО «РостГМУ» Минздрава России.
Статистический анализ
В процессе обработки данных оценивались значения медианы (Мe) и интерквартильного размаха (25%, 75%); статистическая значимость результатов рассчитывалась при доверительной вероятности 95%; для сравнения межгрупповых различий использовался непараметрический критерий Манна–Уитни (при уровне значимости 0,05), для сравнения трех зависимых групп (табл. 1, 2) при отсутствии нормального распределения применялся непараметрический метод Фридмена. Для выявленных статистически значимых различий проводится апостериорный анализ с помощью критерия Вилкоксона с поправкой Бонферрони; степень выраженности связей между изучаемыми факторами определяли при помощи непараметрического корреляционного анализа по Спирмену (рассматривались коэффициенты корреляции при уровне значимости 0,05); для определения иерархии значимости изучаемых признаков использовался многофакторный анализ «Деревья решений». Сравнивались относительные показатели (частоты, доли, проценты) между группами с помощью критерия хи-квадрат (χ2) или точного критерия Фишера. Статистическая обработка данных велась с использованием пакетов прикладных программ Statistica версии 10.01, Excel 2010, IBM SPSS 24.0.
Результаты
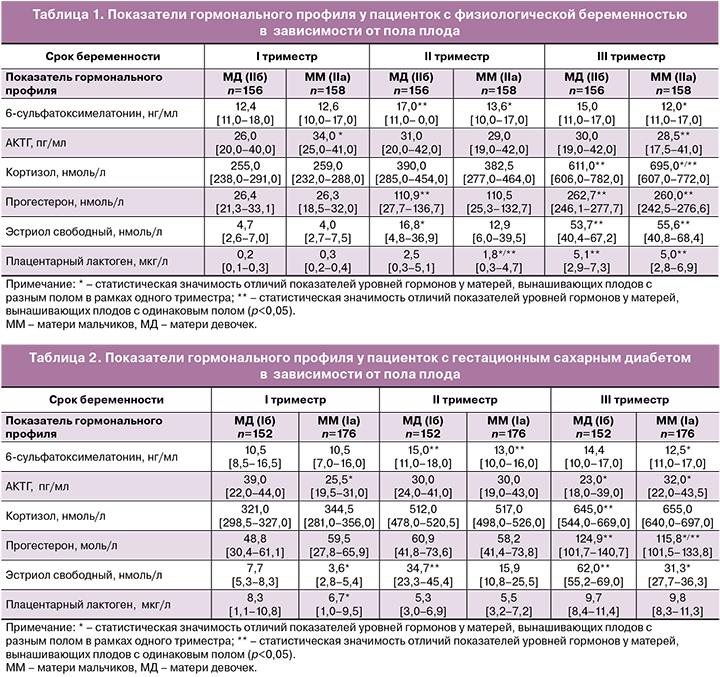
Гормональная система во время гестационной перестройки претерпевает значительные трансформации, поэтому именно этой системе в рамках проводимых исследований было уделено наибольшее внимание. В процесс изучения особенностей гормонального профиля у беременных с учетом пола плода были включены прогестерон, свободный эстриол, плацентарный лактоген, АКТГ, кортизол и 6-сульфатоксимелатонин (табл. 1).
При анализе показателей 6-СОМТ в утренней порции мочи у женщин с ФБ статистически значимых отличий у матерей мальчиков (ММ) и матерей девочек (МД) выявлено не было. Более высокий его уровень во II и III триместрах беременности отмечался у МД (17,0 в сравнении с 13,6 у ММ, р=0,03 во II триместре и 15,0 в сравнении с 12,0, р=0,04 в III триместре).
Известно, что в процессе беременности отмечается совместная продукция стресс-гормонов надпочечниками женщины совместно с плацентой, печенью плода и его надпочечниками, которые необходимы для обеспечения оптимума метаболизма в материнском организме, в связи с чем были проанализированы уровни АКТГ и кортизола у беременных с ФБ и ГСД в зависимости от пола плода. Абсолютные уровни АКТГ в I триместре при ФБ были значимо выше у ММ (34,0 в сравнении с 26,0 у МД, р=0,04). Уровень кортизола в I и II триместрах в зависимости от пола плода значимо не отличался, тогда как в III триместре он был значимо выше у ММ (696,0 в сравнении с 611,0 у МД, р=0,04). В процессе анализа уровня прогестерона при ФБ статистически значимых отличий в подгруппах с разным полом плода выявлено не было (р>0,05). Уровень свободного эстриола был выше во II триместре у МД (16,8 в сравнении с 12,9 у ММ, р=0,02). Аналогичное распределение данных отмечалось и при оценке уровней плацентарного лактогена: его значения были выше во II триместре беременности у МД (2,6 в сравнении с 1,8 у ММ, р=0,02).
При изучении особенностей гормонального профиля у беременных с ГСД было обнаружено, что, как и в случае с ФБ, абсолютные уровни 6-СОМТ во II и III триместрах были выше у МД (15,0 в сравнении с 13,0 у ММ, р=0,04, во II триместре и 14,4 в сравнении с 12,5 у ММ, р=0,03, в III триместре) (табл. 2).
В отличие от ФБ, при ГСД уровень АКТГ в I триместре был значимо выше у МД (39,0 в сравнении с 25,5 у ММ, р=0,01), тогда как в III триместре – у ММ (32,0 в сравнении с 23,0 у МД, р=0,01). Уровни кортизола в подгруппах беременных с разным полом плода в динамике всей беременности значимо не отличались (р>0,05).
Анализ стероидных гормонов свидетельствовал о значимо более высоких показателях прогестерона в III триместре беременности у МД (124,9 в сравнении с 115,8 у ММ, р=0,04), так же как и уровень эстриола (62,0 в сравнении с 31,3 у ММ, р=0,01).
Уровень плацентарного лактогена уже в I триместре беременности был значимо выше у МД (8,3 в сравнении с 6,7 у ММ, р=0,02).
Таким образом, выявлены значимые отличия в абсолютных уровнях некоторых гормонов гормонального профиля при вынашивании плодов разного пола, свидетельствующие о существовании различных программ гестационной перестройки в ФСМПП при вынашивании плодов мужского и женского пола.
На следующем этапе исследования с целью изучения характера интегративных процессов в гормональной системе женщин, вынашивающих плодов с разным полом, был проведен непараметрический корреляционный анализ.
Поскольку манифестация ГСД чаще всего происходит во II триместре беременности, наибольший интерес представляли результаты анализа корреляционных матриц гормонального профиля женщин на предшествующем этапе – в I триметре.
У МД в корреляционных матрицах имелись значимые положительные корреляции средней силы между кортизолом и мелатонином (r=0,7), свободным эстриолом и мелатонином (r=0,7), свободным эстриолом и кортизолом (r=0,8), плацентарным лактогеном и мелатонином (r=0,6) (табл. 3).
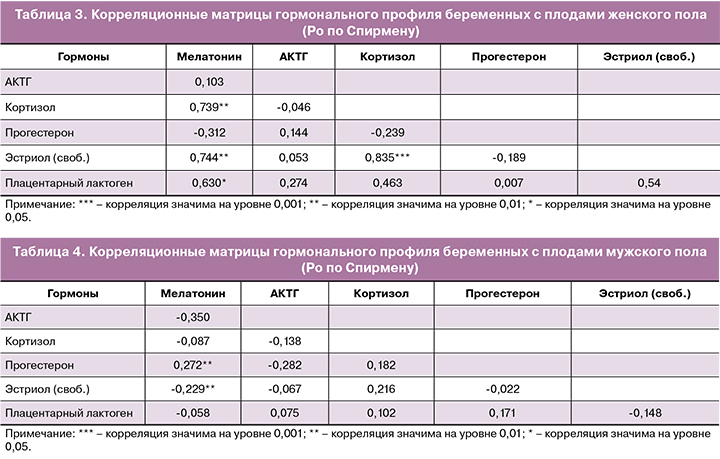
Полученные при проведении корреляционного анализа результаты были подтверждены и детализированы в процессе многофакторного анализа «Деревья решений» методом CRT («Деревья классификации и регрессии», где зависимая переменная – «группа ГСД»; независимые переменные – «мелатонин, АКТГ, кортизол, прогестерон, эстриол свободный, плацентарный лактоген»). Согласно его результатам, определена иерархия участия гормональных подсистем в поддержании гестационных процессов у матерей, вынашивающих плоды различного пола.
В результате многофакторного анализа «Деревья решений» для беременных, вынашивающих плоды женского пола (I триместр), было получено следующее «Правило»:
Если уровень плацентарного лактогена >0,44 и уровень кортизола ≤374,5, то прогнозируют ГСД [относительный риск – 52,25 (доверительный интервал (ДИ) 9,76–639,03); отношение шансов – 616 (ДИ 35,77–10608,67); чувствительность – 91,7% (ДИ 67,1–99,3); специфичность – 98,2% (ДИ 93,2–99,8)].
В результате многофакторного анализа «Деревья решений» для беременных, вынашивающих плоды мужского пола (I триместр), было получено следующее «Правило»:
1. если уровень мелатонина >19,5, то прогнозируют ГСД;
2. если уровень мелатонина ≤19,5 и уровень плацентарного лактогена >0,405, а уровень прогестерона ≤98,1, то прогнозируют ГСД [относительный риск – 15,74 (ДИ 3,7–180,57); отношение шансов – 900,00 (ДИ 53,17–15,235); чувствительность – 98,4% (ДИ 93,4–99,9); специфичность – 93,8% (ДИ 74,8–99,4)].
Таким образом, в процессах гестационной гормональной перестройки в I триместре беременности, предшествующем манифестации ГСД (II триместр), у пациенток с плодами женского пола преобладала более выраженная активация стресс-либерирующего и контринсулярного звеньев гормонального профиля, тогда как в случае мужского пола плода отмечалась более выраженная активация стероидного звена и мелатонинового обмена.
В контексте проведенных исследований особый интерес представляло изучение частоты развития ГСД, клинический анализ характера акушерских осложнений и состояния новорожденных у беременных с ГСД.
При установлении частоты возникновения ГСД в зависимости от пола вынашиваемого плода («0» группа) было обнаружено, что у ММ данная патология регистрировалась в 2,1 раза чаще по сравнению с МД (219/1114 (19,7%) у ММ по сравнению с 88/934 (9,4%) у МД, р=0,03).
В процессе анализа характера акушерских осложнений беременности при ГСД в зависимости от пола плода установлено, что у беременных, вынашивающих мальчиков, чаще регистрировалась плацентарная недостаточность (363/1114 (32,6%) у ММ по сравнению с 181/934 (19,4%) у МД, р=0,001). У беременных, вынашивающих девочек, гестация чаще сопровождалась анемией легкой степени (270/934 (28,9%) по сравнению с 163/1114 (14,6%) у ММ, р=0,001). Частота задержки роста плода в зависимости от пола плода значимо не отличалась (281/1114 (25,2%) у ММ по сравнению с 174/934 (18,6%) у МД, р=0,10).
Роды через естественные родовые пути в зависимости от половой принадлежности вынашиваемого плода в Iа и Iб группах значимо не отличались (674/934 (72,2%) у МД и 807/1114 (72,4%) у ММ, р=0,93); частота родоразрешения при помощи операции кесарева сечения также значимо не отличалась в подгруппах с разным полом плода (260/934 (27,8%) у МД и 307/1114 (27,6%) у ММ, р=0,96). Анализ сроков родов показал, что более высокая частота преждевременных родов при ГСД была в группах матерей, вынашивающих мальчиков (325/1114 (29,2%) в сравнении с 118/934 12,6% у МД, р=0,001). У МД значимо чаще регистрировалась незрелая шейка матки (164/934 (17,6%) по сравнению с 80/1114 (97,2% ) у ММ, р=0,03) и аномалии родовой деятельности (155/934 (16,6%) в сравнении с 77/1114 (6,9%) у ММ, р=0,04).
В структуре осложнений последового и раннего послеродового периодов у ММ преобладали более частые случаи плотного прикрепления плаценты и задержки в полости матки плацентарной ткани, послеродовых гипотонических кровотечений, что сопровождалось более высокой (в 1,6 раза) частотой применения нерадикальных методов гемостаза. При анализе травм мягких тканей родовых путей было установлено, что у родильниц детьми женского пола значимо чаще по сравнению с ММ выявлялись разрывы шейки матки (148/934 (15,8%) у МД в сравнении с 52/1114 (4,7%) у ММ, р=0,04), разрывы промежности I–II степени чаще выявлялись у ММ (118/1114 (10,6%) в сравнении с 26/934 (2,8%) у МД, р=0,03), что, по-видимому, связано с более частым обнаружением при ГСД макросомии плода (437/1114 (39,2%) у ММ по сравнению с 250/934 (26,8%) у МД, р=0,001).
Состояние новорожденных по шкале Апгар при ГСД в зависимости от половой принадлежности плода также свидетельствовало о более низких (7 и ниже баллов) показателях на 1-й минуте после рождения преимущественно у новорожденных мужского пола (241/1114 (21,6%) по сравнению с 90/934 (9,6%) у девочек, р=0,001).
Выявленные отличия в характере акушерских осложнений при ГСД в зависимости от половой принадлежности плода требуют дальнейшего изучения механизмов их формирования.
Обсуждение
С наступлением беременности практически все системы женского организма претерпевают гестационные преобразования, которые сопровождаются значительными изменениями структурно-функциональных параметров в этих системах. Исследования последних лет свидетельствуют о том, что половая принадлежность плода является значимым фактором, играющим важную роль в гестационной перестройке функциональных процессов в организме матери. Основу перестройки, связанной с полом вынашиваемого плода, составляют взаимные биохимические и гормональные сигналы со стороны подсистем «мать» и «плод», выполняющие роль триггеров в функциональных процессах плодо-материнских взаимоотношений. По отношению к плоду материнские сигналы часто являются обучающими.
Гестационная перестройка гормонального статуса при физиологической беременности сама по себе имеет характер «физиологического метаболического синдрома» и направлена на создание необходимого запаса питательных веществ для плода и матери, на фоне которой целый ряд генетических и конституциональных факторов может перевести уже имеющуюся анаболическую направленность обмена беременной в область «метаболического срыва» в виде ГСД. Судя по уже проведенным ранее исследованиям и полученным результатам половая принадлежность плода может быть отнесена к ряду таких модулирующих факторов. Большая (в 2,1 раза) частота ГСД у беременных, вынашивающих плодов мужского пола свидетельствует, что при данном виде полового диморфизма опосредуются условия для повышения риска развития ГСД.
Опираясь на имеющиеся сведения об асимметрично-доминантном принципе организации женской репродуктивной системы, наиболее интересными (с позиции интерпретации полученных результатов) являются морфофункциональные асимметрии, которые носят системный и эволюционно детерминированный характер [4, 20]. В проведенных ранее по данной теме исследованиях было уже доказано, что морфофункциональные асимметрии женской репродуктивной системы является моделью, демонстрирующей биолого-физиологические процессы в фето-плацентарной системе и материнском организме, и его релиз по отношению к полу вынашиваемого плода, показавшего, что у МД преобладает правосторонняя плацентарная латерализация, а у ММ – амбилатеральное расположение плаценты. Доминирование амбилатерального расположения плаценты у ММ, на наш взгляд, является адаптивным проявлением усиления процессов питания и оксигенации плода из бассейна сразу двух маточных артерий, в связи с более выраженными трофическими потребностями плодов мужского пола. Исходя из принципов центро-периферической интеграции, такое распределение плацентарной латерализации у ММ сопровождается парциальным доминированием и активацией правополушарных обмен-ассоциированных структур головного мозга с последующей активацией симпато-адреналовых, вазопрессорных и анаболических правополушарных эффектов в ФСМПП, изменением гормонального и гликемического статуса, усилением генерализованных форм маточной активности, формированием ГСД, плацентарной недостаточности и преждевременных родов [24].
Именно благодаря преобладанию амбилатерального расположению плаценты у ММ начинают преобладать процессы центральной и периферической функциональной симметрии, являющейся основой для появления двусторонней генерализованной формы маточной активности, характерной как для срочной, так и преждевременной родовой деятельности.
Большая частота макросомии плода у ММ и генерализованная форма маточных контракций высокой мощности опосредуют более частые разрывы промежности, а преобладание асимметрии маточной активности у МД чаще сопровождается незрелой шейкой матки и дискоординацией родовой деятельности, т.к. динамика со стороны шейки матки в родах, во многом, определяется повышением внутриамниального давления, которое возможно лишь в условиях генерализованной маточной активности. Очевидно, что существуют и другие механизмы, требующие исследовательской активности в плане интерпретации причин возникновения и механизмов формирования различных акушерских осложнений на фоне ГСД в зависимости от пола вынашиваемого плода.
Проведенные исследования вносят вклад в изучение особенностей плодо-материнских отношений в процессе гестационной перестройки в зависимости от половой принадлежности вынашиваемого плода на примере наиболее динамично изменяющейся во время беременности гормональной системы женщин. Наряду с более частым возникновением ГСД у ММ, уже на ранних этапах гестации отмечаются отличия в степени вовлеченности различных гормональных подсистем в обеспечение гормональной перестройки в материнском организме. Установлено, что большая частота развития ГСД у беременных, вынашивающих мальчиков, сопровождается снижением активности стресс-либерирующего звена гормональной системы и повышением активности мелатонинового обмена в I триместре. У матерей девочек в гестационной перестройке более активно участвуют стресс-либерирующие и контринсулярные гормоны, способствующие большей резистентности их организма и меньшей частоте развития ГСД и, формирующихся на их фоне акушерских осложнений.
Особый интерес представляет дальнейшее изучение роли мелатонина в гормональной аранжировке гестационного процесса при вынашивании плодов разного пола при ГСД. Полученные результаты также определяют перспективу разработки индивидуальных программ гестационного сопровождения и способов профилактики ГСД с учетом пола плода.
Выводы
1. В случае мужского пола плода в материнском организме уже в I триместре беременности возникает снижение функциональной активности подсистемы стресс-либерирующих гормонов и повышение активности мелатонинового обмена, способствующие последующей манифестации ГСД. По результатам многофакторного анализа «Деревья решений» разработан алгоритм прогноза ГСД в зависимости от половой принадлежности вынашиваемого плода.
2. При вынашивании плодов мужского пола в 2,1 раза повышается частота развития гестационного сахарного диабета, в 1,6 – плацентарной недостаточности раза и в 1,8 раза – преждевременных родов, тогда как у беременных с плодами женского пола в 2 раза чаще выявляется анемия легкой степени.
3. Половая принадлежность плода при ГСД опосредует отличия по следующим осложнениям в родах: у матерей девочек значимо чаще регистрируется незрелая шейка матки, разрывы шейки матки и аномалии родовой деятельности, тогда как у матерей мальчиков значимо чаще отмечаются разрывы промежности I–II степени, что объясняется большей частотой макросомии плода в данной группе.



