Преждевременными называют роды, наступившие с 22-й до 37-й недели гестации, начиная с первого дня последней нормальной менструации при регулярном менструальном цикле. Из всех преждевременных родов две трети возникают спонтанно, остальные, как правило, индуцированы искусственно по медицинским показаниям в связи с развитием угрожающих жизни состояний со стороны матери и/или плода [1]. В соответствии со статистическими отчетами 184 стран частота преждевременных родов варьирует в пределах 5–18% всех рожденных детей, составляя в среднем 9,6% [2]. Ежегодно раньше срока рождается около пятнадцати миллионов детей [3], из которых один миллион погибает на первом году жизни по причине недоношенности [4]. Установлено, что 75% случаев младенческой смертности являются следствием преждевременных родов [5]. Наряду с этим преждевременные роды лидируют в структуре причин детской смертности в возрасте до 5 лет, а три четверти указанных смертельных случаев рассматриваются как условно предотвратимые [2, 6]. Эффективная профилактика преждевременных родов может быть реализована посредством управления так называемыми «модифицируемыми факторами риска» и включает в себя отказ от курения, снижение стрессовых нагрузок и облегчение трудового процесса, коррекцию питания, анемии, а также своевременную диагностику, а при необходимости – лечение инфекций различных локализаций [7–9].
Ранее показано, что 40–50% случаев спонтанных преждевременных родов являются следствием воздействия различных инфекционных факторов. При этом бактериальная инфекция признается ведущей в этиологии преждевременных родов. Важно отметить, что инфекционные причины преимущественно являются индукторами очень ранних и ранних преждевременных родов (с 22-й до 32-й недели гестации) [10].
Чаще всего в качестве наиболее вероятного источника и/или резервуара бактериальных патогенов рассматривают вагинальный биотоп [11]. Зависимость сроков родоразрешения от состояния цервико-вагинальной микробиоты демонстрируют результаты исследования, в соответствии с которыми нарушение микрофлоры влагалища в первом триместре ассоциируется с увеличением риска преждевременных родов до 35 недель на 75% [12]. В то же время большая часть опубликованных работ, изучающих вагинальную микробиоту во второй половине беременности, не обнаружила взаимосвязей между микробным пейзажем нижних отделов репродуктивного тракта и исходами гестации. В связи с тем, что негативное влияние инфекций генитального тракта на течение гестационного процесса подтверждается не всеми исследователями [13–15], остается открытым вопрос необходимости массового обследования популяции бессимптомных беременных в поздние сроки гестации для выявления возбудителей инфекций половых путей. В соответствии с действующими нормативными документами оценка состояния вагинального биотопа при беременности проводится дважды (при первичном обращении и в 30 недель) с применением микроскопического и бактериологического методов исследования; в случае осложненного течения гестации рекомендуется исключить хламидийную инфекцию путем детекции ДНК C. trachomatis с помощью полимеразной цепной реакции (ПЦР) в цилиндрическом эпителии цервикального канала (приказ МЗ РФ от 01.11.2012 г. № 572н). Очевидно, что регламентированный приказом объем скрининга на урогенитальные инфекции ограничен, как спектром определяемых микроорганизмов, так и применяемыми диагностическими методами, не позволяющими, в частности, изолировать из женского репродуктивного тракта ряд клинически-значимых для гестации анаэробов и некоторых возбудителей инфекций, передаваемых половым путем (ИППП).
Представленные в литературе разрозненные данные о роли инфекционных заболеваний органов репродуктивной системы, возникающих во второй половине беременности, в индукции преждевременных родов, противоречивые сведения о распространенности среди беременных с угрожающими преждевременными родами урогенитальных инфекций, диагностированных с применением лабораторных тестов с недостаточной диагностической эффективностью (бактериоскопических, культуральных), в определенной степени снижают эффективность лечебно-профилактических мероприятий, направленных на предотвращение перинатальной заболеваемости и смертности. В этой связи целью нашей работы стала оценка состояния цервико-вагинальной микробиоты у беременных с угрожающими преждевременными родами с применением ПЦР в реальном времени.
Материал и методы исследования
Для достижения цели был проведен инфекционный скрининг 300 беременных в сроке гестации от 27 до 32 недель. Все женщины, включенные в исследование, находились под динамическим наблюдением акушера-гинеколога в женской консультации и прошли клинико-лабораторное обследование в объеме, предусмотренном приказом МЗ РФ 01.11.2012 г. №572н. Основную группу сформировали 118 женщин, которые были госпитализированы в родильные дома №№ 1, 10, 24 г. Москвы с угрожающими преждевременными родами.
Набор пациенток в основную группу осуществляли согласно разработанным критериям включения: подписание добровольного информированного согласия на участие в исследовании; возраст более 17 лет и менее 45 лет; одноплодная беременность; диагноз «угрожающие преждевременные роды», верифицированный на основании появления регулярных (не менее 4 за 20 мин) схваток в сроке 22–316 недель гестации, укорочения длины шейки матки менее 25 мм (по данным ультразвуковго исследования трансвагинальным датчиком) и/или динамического изменения шейки матки (укорочение и сглаживание) при условии открытия маточного зева менее 30 мм и наличия интактных плодных оболочек.
Критерии исключения из исследования: беременность, наступившая с использованием вспомогательных репродуктивных технологий; тяжелые пороки развития плода; новообразования и тяжелая экстрагенитальная патология (ожирение, аутоиммунные заболевания, сахарный диабет; артериальная гипертензия); ВИЧ-инфекция, сифилис, инфекционные гепатиты; психические заболевания, хронический алкоголизм, наркомания; антибиотикотерапия за три недели до исследования, предшествующие обследованию.
Среди 118 беременных основной группы у 69% (n=81) пациенток ведущим синдромом стали угрожающие преждевременные роды, у 31% (n=37) госпитализированных наряду с угрозой преждевременных родов беременность осложнилась преэклампсией и/или задержкой роста плода.
 Контрольную группу сформировали из 182 женщин с физиологическим течением второй половины гестации, среди которых не были зарегистрированы случаи акушерских осложнений, а беременность завершилась нормальными родами. Взятие биологического материала у беременных контрольной группы производили в амбулаторных условиях при плановом обследовании в сроке гестации от 27 до 32 недель.
Контрольную группу сформировали из 182 женщин с физиологическим течением второй половины гестации, среди которых не были зарегистрированы случаи акушерских осложнений, а беременность завершилась нормальными родами. Взятие биологического материала у беременных контрольной группы производили в амбулаторных условиях при плановом обследовании в сроке гестации от 27 до 32 недель.
Сравниваемые группы были сопоставимы по возрасту обследуемых (30,45±4,79 и 30,69±4,92 года; p>0,05). Изучаемые выборки не различались по социально-экономическому статусу, характеру соматической патологии, индексу массы тела, паритету. Около половины пациенток основной и контрольной групп относились к первородящим (52% (n=61) и 54% (n=98); p>0,05). Гестационный срок проведения инфекционного скрининга составлял 30±2,7 и 30±1,5 недель – в основной и контрольной группах (p>0,05).
Для лабораторной верификации диагнозов «бактериальный вагиноз» (БВ), «аэробный вагинит» (АВ), «кандидозный вульвовагинит» (КВВ), «хламидийная инфекция» (ХИ), «гонорея», «трихомониаз», а также «инфекция, связанная с M.genitalium» использовали микроскопию мазков цервико-вагинального отделяемого и комплексный тест, предназначенный для диагностики инфекций урогенитального тракта и представляющий собой ПЦР-тест-систему в формате «мультиплекс» с детекцией продуктов реакции в режиме реального времени, показатели чувствительности и специфичности которой сопоставимы с международными клинико-лабораторными критериями диагностики указанных инфекций.
Для подтверждения диагноза инфекционного заболевания репродуктивного тракта применяли следующие клинико-лабораторные критерии:
- Диагноз «БВ» устанавливали на основании обнаружения 3 из 4 критериев Amsel [16] и ПЦР в реальном времени, в основе которого лежит расчет соотношений логарифмов концентраций ДНК Lactobacillus spp., общего количества ДНК бактерий и ДНК G.vaginalis, A.vaginae во влагалище.
- Диагноз «КВВ» устанавливали на основании выявления патогномоничных субъективных (зуд, жжение, «творожистые» выделения из половых путей) и объективных признаков (гиперемия и отек вульвы, влагалища, изменение характера выделений), микроскопического подтверждения воспалительной реакции (увеличение количества лейкоцитов более 10 в поле зрения) и наличия дрожжеподобных грибов или их фрагментов (спор, мицелия). Наряду с микроскопией, основанием для постановки диагноза «КВВ» считали обнаружение ДНК одного из 5 видов грибов рода Candida в концентрации выше 102 ГЭ/мл с помощью ПЦР в реальном времени.
- Диагноз «АВ» верифицировали при наличии субъективных проявлений (зуд, жжение, выделения из половых путей), объективных симптомов (гиперемия и отек) в сочетании с микроскопическими признаками воспалительной реакции (лейкоцитоз более 10 в поле зрения), снижением лактоморфотипов и при обнаружении ДНК аэробных микроорганизмов Enterobacteriaceae, Streptococcus spp., Staphylococcus spp.) в концентрациях, превышающих ДНК Lactobacillus spp. с помощью ПЦР в реальном времени.
- Диагнозы «ХИ», «гонорея», «трихомониаз», «инфекция, вызванная M. genitalium», устанавливали на основании обнаружения ДНК C. trachomatis, N.gonorrhoeae, T. vaginalis, M. genitalium в материале.
Для проведения анализа методом ПЦР в реальном времени проводили забор вагинального отделяемого из заднего свода влагалища урогенитальным зондом, рабочую часть которого оставляли в пробирке с «Транспортной средой с муколитиком» (Россия). Транспортировку материала осуществляли в соответствии с инструкцией производителя.
ПЦР – исследование состояло из следующих этапов:
- экстракция ДНК из исследуемых образцов с использованием сорбентной методики с применением набора реагентов ДНК-Сорб-АМ (Россия);
- амплификация ДНК c гибридизационно-флуоресцентной детекцией в режиме «реального времени» на приборе Rotor-Gene 6000 (Corbett Research, Австралия) в соответствии с инструкцией производителя;
- анализ и интерпретация результатов.
Выявление основных возбудителей инфекций органов репродукции методом мультиплексной ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме «реального времени» в пробах ДНК, полученных путем экстракции из соскобов, проводили наборами:
- «АмплиСенс Флороценоз/БВ-FL», предназначенного для расчета соотношения количества ДНК Lactobacillus spp., G.vaginalis, A.vaginae [17];
- «АмплиСенс Флороценоз/Аэробы-FL», предназначенного для определения количества ДНК Enterobacteriaceae, Staphylococcus spp., Streptococcus spp. [18];
- «АмплиСенс Флороценоз/Кандиды-FL», предназначенного для определения количества ДНК 5 видов грибов рода Candida: C.albicans, C.glabrata, C.krusei, C.parapsilosis и C.tropicalis [19];
- «АмплиСенс Флороценоз/Микоплазмы-FL», предназначенного для определения количества ДНК U.parvum/urealyticum и M.hominis [20];
- «АмплиСенс N.gonorrhoeae/C.trachomatis/ M.genitalium/T.vaginalis МУЛЬТИПРАЙМ-FL», предназначенного для выделения ДНК N.gonorrhoeae, C.trachomatis, M.genitalium и T.vaginalis.
Полученные значения концентраций ДНК микроорганизмов выражали в виде геномных эквивалентов в миллилитре (ГЭ/мл). Для получения заключения использовали программное обеспечение в формате Microsoft Excel для автоматической обработки данных и получения результатов комплексного исследования «Флороценоз» (версия 1.0)
Обработку данных осуществляли с применением современных пакетов прикладных программ математико-статистического анализа. Характер распределения оценивали по критериям Шапиро-Уилка и Колмогорова-Смирнова. При нормальном распределении применяли методы параметрической статистики: расчет средней арифметической (М) и ее стандартной ошибки (Sd), t-критерия Стьюдента, коэффициента линейной корреляции Пирсона (r). Производили расчет показателей структуры (в %). Определение значимости различий между категориальными переменными проводили посредством критерия χ2, для малых групп – χ2 с поправкой Йейтса, точного критерия Фишера. Отношение шансов (ОШ) и 95% доверительный интервал (ДИ) рассчитывали с помощью таблиц сопряженности. Отличия считали статистически достоверными при р<0,05.
Результаты исследования
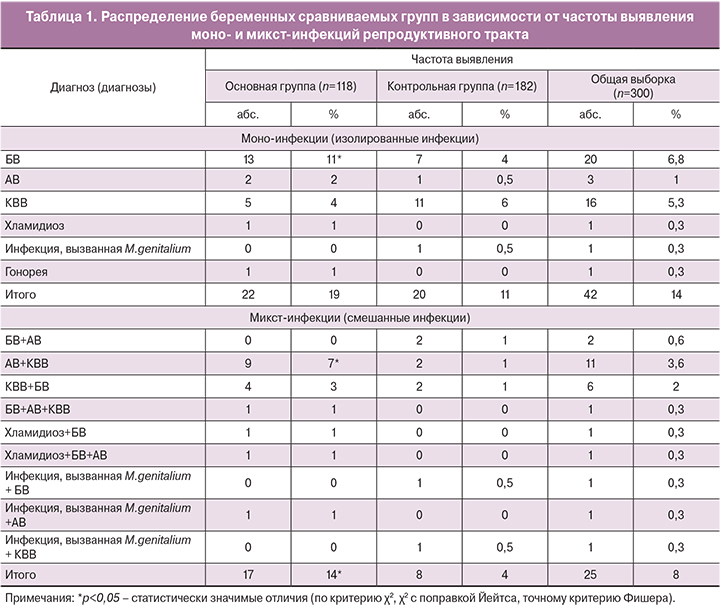
По результатам проведенного инфекционного скрининга (рисунок) частота встречаемости БВ составила 17% (n=20) в основной группе, что более чем в 2 раза превышало его распространенность в контрольной (7% (12); p<0,01). Доля женщин с БВ в когорте всех обследуемых составила 11% (32 случая из 300). Среди пациенток c угрожающими преждевременными родами АВ регистрировали в 12% (n=14) случаев и лишь у 3% (n=5) условно здоровых (p<0,01), что в пересчете на всю изучаемую выборку составило 6% (19 случаев из 300). Диагноз «КВВ» среди всех обследуемых устанавливали чаще других инфекций с частотой, равной 12% (в 35 случаях из 300). Несмотря на то, что диагноз «КВВ» выставили в 16% (n=19) наблюдений в основной группе, что несколько выше частоты его обнаружения в контрольной (в 9% (n=16) случаев), межгрупповые различия в распространенности КВВ оказались недостоверными (p=0,08). Рассчитали, что обнаружение БВ во второй половине беременности сопряжено с 3-кратным повышением риска угрожающих преждевременных родов (ОШ 2,89; 95% ДИ 1,36–6,17; p<0,05), АВ – почти с 5-кратным (ОШ 4,77; 95% ДИ 1,67–13,61; p<0,05). Ассоциации между угрожающими преждевременными родами и КВВ не выявлены (ОШ 1,99; 95% ДИ 0,98–4,05; p>0,05).
В основной группе из четырех бактериальных возбудителей ИППП, выявляемых используемой тест-системой, подтвердили наличие трех, при этом ХИ обнаружили у трех пациенток, а также зарегистрировали по одному случаю гонореи и инфекции, ассоциированной с M.genitalium. Среди 182 относительно здоровых беременных из облигатных патогенов изолировали исключительно M. genitalium в 2% (n=3) случаев. Сравниваемые группы не отличались по распространенности бактериальных ИППП (в 4% (n=5) и 2% (n=3) случаев; p>0,05). Межгрупповые различия установили по частоте обнаружения ДНК C. trachomatis (p<0,05).
В общей выборке доля женщин с любыми изолированными или смешанными урогенитальными инфекциями составила 22% (67 из 300). При этом инфекции органов репродукции регистрировали у 33% (n=39) беременных основной группы, что 2-кратно превышало их частоту в группе с физиологической беременностью (15% (n=28); p<0,001).
Анализ данных показал (табл. 1), что диагноз микст-инфекции репродуктивного тракта (два или более самостоятельных синдрома (заболевания)) устанавливали в 14% (n=17) случаев в основной группе и только в 4% (n=8) случаев – в контрольной (p<0,01), что позволило достоверно определить повышение риска возникновения преждевременных родов при развитии смешанных инфекций в нижних отделах половых путей (ОШ 3,88; 95% ДИ 1,63–9,24; p<0,05). К наиболее распространенным микст-инфекциям в обеих группах относили сочетания КВВ с БВ, КВВ с АВ, причем вторую комбинацию достоверно чаще регистрировали в основной группе (7% (n=9) и 1% (n=2), p<0,01). В структуре моно-инфекций в основной группе лидирующая позиция принадлежала БВ. Удельный вес пациенток основной группы с изолированным БВ был в 3 раза выше такового в контрольной группе (11% (n=13) и 4% (n=7); p<0,05). Доли беременных с другими моно-инфекциями (АВ, КВВ, ХИ, гонорея, инфекция, вызванная M.genitalium) в сравниваемых группах были примерно равны. Удельный вес женщин с моно-инфекциями в основной группе достоверно не отличался от такового в контрольной группе (19% (n=22) и 11% (n=20), p=0,06).
Сравнительная оценка цервико-вагинальной микробиоты, проведенная методом мультиплексной ПЦР в режиме реального времени, выявила относительно большее видовое разнообразие микроорганизмов, колонизирующих репродуктивный тракт при развитии угрожающих преждевременных родах. Среди изолируемых в нашем исследовании влагалищных условно патогенных микроорганизмов среднее количество семейств (видов), приходящихся на одну беременную основной группы, составляло 4,3±2,1, что достоверно превышало аналогичный показатель в контрольной группе (3,5±1,6; p<0,001).
Как видно из табл. 2, частота выделения большинства условно патогенных микроорганизмов была достоверно выше в основной группе, за исключением A.vaginae и Streptococcus spp.
Lactobacillus spp. были обнаружены в 100% исследуемых образцов, полученных от 300 беременных. Анализ показал, что развитие преждевременных родов сопровождалось сокращением уровня колонизации вагинальной микроэкосистемы Lactobacillus spp. по сравнению со значениями, установленными для контрольной группы (7,38±1,27 и 8,24±0,67 ГЭ/мл, соответственно; p<0,001). Хотя в обеих группах средние величины содержания ДНК Lactobacillus spp. находились в пределах нормы, снижение уровня ДНК Lactobacillus spp. во влагалище ниже 7 lg ГЭ/мл регистрировали у 22% (n=26) пациенток с угрозой преждевременных родов и лишь в 2% (n=4) наблюдениях – в контрольной группе (p<0,001). Рассчитали, что обнаружение ДНК Lactobacillus spp. во влагалище в концентрации ниже значения 7 lg ГЭ/мл связано с 12-кратным увеличением риска развития угрожающих преждевременных родов (OШ 12,58; 95% ДИ 4,26–37,12; p<0,001). Диапазон колебаний вагинальной концентрации ДНК Lactobacillus spp. был несколько ниже в основной группе и находился в пределах от 1,09 lg до 8,85 lg ГЭ/мл, в контрольной – от 3,00 lg ГЭ/мл до 9,64 lg ГЭ/мл.

Концентрации ДНК G.vaginalis и A.vaginae в образцах, полученных от женщин с угрожающими преждевременными родами (табл. 3), достоверно превышали установленные для физиологической беременности: 5,50±2,07 ГЭ/мл и 5,64±2,12 ГЭ/мл (в основной группе) против 4,77±1,97 ГЭ/мл и 4,37±2,00 ГЭ/мл (в контрольной группе) (p<0,05 и p<0,01 – для концентраций ДНК G.vaginalis и A. vaginae). При этом корреляционный анализ продемонстрировал наличие сильных положительных взаимосвязей между БВ-ассоциированными бактериями: G.vaginalis и A.vaginae (rs=0,86, p<0,001), а также G.vaginalis и M.hominis (rs=0,71, p<0,001).
Среди условно патогенных микроорганизмов в основной группе регистрировали увеличение колонизации влагалища возбудителями АВ, а именно Staphylococcus spp. (p<0,01), Streptococcus spp. (p<0,01), относительно аналогичных показателей в контрольной группе.
Обсуждение
Как известно, пролонгирование гестационного процесса до физиологического срока родоразрешения обеспечивается целым комплексом разнообразных анатомических, биохимических, иммунологических, нейроэндокринных, метаболических перестроек в материнском организме. Недавно установили, что фундаментальная роль в поддержании гомеостаза в системе «мать-плацента-плод» принадлежит микробным сообществам и отдельным микроорганизмам, колонизирующим кишечный, оральный, вагинальный, плацентарный и другие биотопы матери [21, 22]. Однако значение количественного и качественного состава цервико-вагинальной микробиоты в обеспечении физиологического течения гестационного процесса и в индукции преждевременных родов полностью не выяснено.
Дисбаланс микрофлоры родовых путей, по некоторым данным, ассоциируется с развитием поздних акушерских осложнений, а также влияет на характер колонизации биотопов новорожденного [21]. В этой связи, представляется важным своевременная диагностика цервико-вагинальных инфекций и назначение, при необходимости, этиотропной терапии, несмотря на результаты проведенного мета-анализа, в соответствии с которыми коррекция возникающих во второй половине беременности нарушений вагинальной микрофлоры не улучшает ее исходы [15]. По мнению R.F. Lamont [8], выводы по применению антибиотикотерапии в предупреждении преждевременных родов в представленном мета-анализе не могут считаться абсолютно объективными и окончательными, поскольку антибактериальное лечение в период беременности может быть эффективно при условии выявления этиологически значимых возбудителей, действительно выступающих триггерами преждевременной родовой деятельности, определения их антибиотикочувствительности, а также использования антибиотиков на ранних этапах воздействия инфекта до формирования необратимых бактериально-индуцированных воспалительных каскадов [8].
Полученные нами результаты свидетельствуют о более высокой распространенности общего числа урогенитальных инфекций, БВ, АВ, ХИ среди женщин с угрожающими преждевременными родами, что косвенно указывает на участие облигатных и условно-патогенных влагалищных микроорганизмов в инициации преждевременных родов. Однако установить точное направление причинно-следственной связи между развитием дисбаланса эндогенной цервико-вагинальной микробиоты и наступлением преждевременных родов в рамках настоящего кросс-секционного исследования не представляется возможным. По результатам проведенного скрининга, частота встречаемости БВ при угрожающих преждевременных родах более чем в 2 раза превышала его распространенность у беременных, родивших в срок, что не противоречит ранее описанному влиянию БВ на течение гестации, связанному с 2-кратным увеличением риска преждевременных родов при обнаружении БВ, с 7-кратным – в сроке до 16 недель, с 4-кратным – до 20 недель [23]. Однако считают, что воспалительная реакция, сопровождающая АВ, в большей степени согласуется с опосредованной медиаторами воспаления индукцией преждевременных родов, хориоамнионитом и разрывом плодных оболочек, чем при БВ [24]. Действительно, в соответствии с нашими результатами АВ в 4 раза чаще ассоциировался с угрожающими преждевременными родами.
Результаты исследований, изучающих взаимосвязь КВВ и преждевременных родов, неоднозначны. Ранние работы не обнаруживали влияния инфекций, вызванных дрожжеподобными грибами рода Candida, на течение гестации [25]. При этом, исследования последних лет, напротив, указывают на роль КВВ в индукции преждевременной родовой деятельности [26, 27], особенно во второй половине беременности [28]. По нашим данным, несмотря на относительно более высокую частоту встречаемости КВВ в основной группе, различия между сравниваемыми выборками по данному показателю не удалось подтвердить статистически. При этом маргинальные величины уровня значимости p позволяют обозначить тенденцию к увеличению частоты КВВ среди беременных с угрожающими преждевременными родами.
Из возбудителей ИППП среди относительно здоровых беременных в трех наблюдениях обнаружена инфекция, вызванная M.genitalium, участие которой в развитии преждевременных родов не доказано [29]. Различия по частоте выделения возбудителей ИППП при доношенной и недоношенной беременности не были значимыми; но при этом обращает на себя внимание тот факт, что среди обследуемых с угрожающими преждевременными родами по сравнению с условно здоровыми чаще обнаруживали C.trachomatis и N.gonorrhoeae, воздействие которых на состояние матери и плода ранее подтверждено результатами ряда работ [30]. Показано, что хламидиоз в 4 раза повышает риск ранних преждевременных родов и в 2,5 раза – родов до 35 недели беременности [31], хотя мета-анализ постулирует о недостаточном на сегодняшний день количестве данных, подтверждающих необходимость проведения скрининга на C.trachomatis при беременности, для улучшения ее исходов [14]. Несмотря на то, что поперечный характер исследования не разрешает сделать однозначный вывод об этиологической значимости БВ и АВ в развитии угрожающих преждевременных родов, направленность причинно-следственной взаимосвязи между ХИ и угрожающими преждевременными родами является очевидной, что позволяет вынести заключение об участии C.trachomatis в индукции родовой деятельности.
Известно, что у 30% женщин с инфекциями органов репродукции одновременно регистрируют сочетание нескольких нозологических форм и синдромов (микст-инфекция) [32]. Анализ данных показал, что среди обследуемых с угрожающими преждевременными родами смешанные инфекции репродуктивного тракта диагностировали в 3,5 раза чаще относительно условно здоровых беременных. Вероятно, индукция преждевременной родовой деятельности может быть следствием негативного влияния на материнский организм формирующегося при микст-инфекциях патологического микробного сообщества, патогенный потенциал которого, безусловно, превосходит таковой при моно-инфекциях. Особый интерес представляют полученные нами данные о том, что сравниваемые группы были практически сопоставимы по числу беременных с изолированными инфекциями репродуктивной системы; при этом межгрупповые различия регистрировали только по удельному весу беременных с изолированным БВ, хотя, как указано ранее, выборки отличались по показателям распространенности БВ, АВ и ХИ. Возможно, реализация патогенных свойств влагалищных микроорганизмов приобретает большее клиническое значение для характера течения гестации в условиях формирования микробного консорциума с более высоким видовым разнообразием.
Действительно, результаты видовой идентификации вагинальных микроорганизмов продемонстрировали, что среднее число видов (семейств) – ассоциантов, выделенных из вагинального биотопа беременных с угрожающими преждевременными родами, превышает аналогичный показатель при физиологической гестации. Полученные нами данные подтверждают опубликованные выводы о том [13], что нормальное течение беременности сопровождается обеднением видового разнообразия вагинальной микробиоты, что, вероятно, связано с филогенетически сформированным защитным механизмом, направленным на минимизацию потенциальных рисков, связанных с условно патогенными микроорганизмами. Необходимо отметить, что обнаруженные сильные положительные корреляционные взаимосвязи между концентрациями БВ-ассоциированных бактерий G.vaginalis и A.vaginae согласуются с представлениями о патогенетических механизмах развития БВ через образование микробных биопленок с участием обозначенных микроорганизмов [33]. Кроме того, положительные корреляции между содержанием во влагалище G.vaginalis и M.hominis служат основанием для рассмотрения M.hominis в качестве вида, ассоциированного с БВ, а не самостоятельного бактериального патогена, инициирующего преждевременные роды, что соответствует данным литературы [34].
Выявленное нами падение уровня Lactobacillus spp. во влагалище ниже значения 7 lg ГЭ/мл ассоциировалось с многократным увеличением риска развития преждевременных родов, что может объясняться протективной ролью лактофлоры в поддержании гестационного процесса. Снижение концентрации Lactobacillus spp. в вагинальном биотопе, как известно, является ключевым «патогенетическим событием» в развитии БВ и АВ [35]. В литературе не найдено данных о взаимосвязи степени колонизации репродуктивного тракта Lactobacillus spp. во второй половине беременности и риском развития преждевременных родов; но ранее обнаружено, что отсутствие Lactobacillus spp. во влагалище в первом триместре коррелирует с 2,4-кратным увеличением риска преждевременных родов [12].
Недостаточную эффективность существующей в настоящее время системы скрининга на инфекционные заболевания репродуктивного тракта среди беременных подчеркивает тот факт, что все обследуемые, в том числе с эндогенными (оппортунистическими) урогенитальными инфекциями и ИППП, находились под наблюдением в женской консультации и до госпитализации прошли полное клинико-лабораторное обследование в соответствии с приказом № 572н, по итогам которого ИППП не были диагностированы ни в одном случае.
Заключение
Сравнительный анализ результатов проведенного скрининга беременных с угрожающими преждевременными родами и нормальным течением второй половины гестации показал более высокую распространенность инфекций, в том числе микст-инфекций, нижних отделов женского полового тракта среди первых. По нашим данным, обнаружение у беременных во второй половине гестации хламидийной инфекции, бактериального вагиноза, аэробного (неспецифического) вагинита ассоциируется с повышенным риском развития угрозы преждевременных родов. Дизайн работы не позволяет установить являются ли обозначенные выше цервико-вагинальные инфекции причиной угрожающих преждевременных родов, либо изменения иммунного гомеостаза в организме беременных с данным акушерским осложнением способствует их развитию. Тем не менее, логично предположить, что выявленное нами снижение уровня протективных вагинальных Lactobacillus spp. и повышение концентраций условно патогенных микроорганизмов во второй половине гестации облегчает миграцию потенциальных возбудителей хориоамнионита и внутриутробных инфекций в верхние отделы репродуктивной системы, что в сочетании с изменением локальной иммунологической среды, может инициировать начало родовой деятельности. Напротив, физиологическое течение второй половины гестации характеризуется сокращением видового разнообразия и численности комменсальных микроорганизмов на фоне увеличения уровня Lactobacillus spp.
Обнаруженные нами особенности трансформации цервико-вагинальной микробиоты при физиологическом течении второй половины гестации и угрожающих преждевременных родах могут служить обоснованием для внедрения в рутинную акушерскую практику скрининга беременных на инфекции органов репродукции с применением молекулярно-биологических методов диагностики (ПЦР), позволяющих одномоментно определять в материале концентрацию Lactobacillus spp. и основных возбудителей бактериальных инфекций. Не исключается, что этиотропная терапия обнаруженных нарушений в цервико-вагинальном биотопе даже во второй половине гестации уменьшит вероятность развития преждевременных родов, а также послеродовых инфекционно-воспалительных осложнений у матери и неонатальных инфекций, что, однако, требует проведения дополнительных исследований. Реализация указанных мероприятий обеспечит сокращение рисков развития бактериально-индуцированных преждевременных родов и может рассматриваться в качестве резерва по снижению перинатальной и младенческой заболеваемости и смертности.



