Развитие и распространенность вспомогательных репродуктивных технологий (ВРТ) в настоящее время во многом расширили возможности лечения бесплодия. Однако, по данным РАРЧ, в России частота наступления беременности при проведении ЭКО за последние 5 лет практически не изменилась и составляет в расчете на цикл 31,5%, на пункцию – 32,4%, на перенос эмбрионов – 38,4% [1, 2]. Исход программы ЭКО зависит от множества факторов, наиболее значимыми из которых являются качество получаемых для оплодотворения ооцитов и эмбрионов, а также готовность эндометрия к имплантации бластоцисты [3, 4].
При этом на качество эмбрионов максимально влияют возраст пациентки и генетические факторы, тогда как на состояние эндометрия существенно воздействует гинекологическая патология [5, 6].
Пролиферация и дифференциация эндометрия контролируется стероидными гормонами яичника. Взаимодействие функционально полноценных рецепторов ткани эндометрия (ER – эстрогеновые рецепторы, PgR – прогестероновые рецепторы) и соответствующих стероидных гормонов играет решающую роль в их воздействии на эндометрий [4, 7].
Одним из важнейших факторов регуляции процесса адгезии и инвазии эмбриона признан лейкемия-ингибирующий фактор (LIF, Leukemia inhibitory factor) [4, 8–10]. Адекватная васкуляризация эндометрия необходима для совершения процесса имплантации. В этом процессе ключевая роль отводится cосудистому эндотелиальному фактору роста А (VEGF-A) [4, 8], который является основным ангиогенным фактором, регулирующим рост новых кровеносных и лимфатических сосудов в эндометрии человека [7, 11].
Распространение трофобласта в строму матки сопровождается лизисом базальных мембран путем активации протеолитических ферментов, в большей степени матриксных металлопротеиназ (MMP). Основными энзимами имплантации являются желатиназы (ММР-2, ММР-9), обеспечивающие инвазию трофобласта в децидуальную ткань и сосудистую сеть [9].
Достоверными маркерами эндометриальной функции и готовности эндометрия к имплантации являются адгезионные молекулы, роль которых стала интенсивно изучаться в последнее время. Интегрины, экспрессия которых возрастает в середину лютеиновой фазы, были определены как маркеры «окна имплантации». Принимая во внимание его экспрессию и локализацию, интегрин αVβ3 был предложен как потенциальный рецептор эмбрионального прикрепления [9].
Семейство НОХ-генов также участвует в росте, дифференциации и рецептивности эндометрия. Уровень экспрессии НОХА-10 значительно возрастает в среднюю и позднюю секреторную фазу менструального цикла и регулирует образование пиноподий, интегрина aVb3 [8].
К числу наиболее часто встречающихся нозологических форм, входящих в структуру бесплодного брака, относятся так называемые маточные формы бесплодия (50%) [6]. Любой патологический процесс, нарушающий анатомо-функциональное состояние матки, может способствовать формированию бесплодия. Выделяют врожденные и приобретенные поражения матки. У женщин с бесплодием наиболее часто выявляют следующие пороки развития матки: седловидную матку, внутриматочную перегородку, двурогую или однорогую матку. К приобретенным изменениям относят миому матки, хронический эндометрит, полипы и гиперплазию эндометрия, внутриматочные синехии.
Несмотря на многочисленные сведения, касающиеся механизмов возникновения бесплодия при аденомиозе, миоме матке, различной внутриматочной патологии, данные о рецептивности эндометрия при бесплодии у таких больных немногочисленны.
Цель исследования: оценка рецептивности эндометрия у больных с доброкачественными заболеваниями матки в сочетании с бесплодием до и после оперативного лечения.
Материалы и методы
На первом этапе исследования в отделении оперативной гинекологии (зав. отделением – д.м.н., профессор, академик РАН Адамян Л.В.) ФГБУ «НМИЦ АГиП им. В.И. Кулакова» было проведено обследование и хирургическое лечение 1466 пациенток с доброкачественными заболеваниями матки и бесплодием перед проведением программы ЭКО.
Пациенткам, которые были включены в исследование, было проведено лечение бесплодия в протоколе ЭКО (ЭКО+ИКСИ) с контролируемой стимуляцией яичников и переносом в полость матки эмбрионов или в цикле с переносом в полость матки ранее криоконсервированных эмбрионов (криопротокол) в отделении вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова (зав. отделением – д.м.н. Калинина Е.А.) ФГБУ «НМИЦ АГиП им. академика В.И. Кулакова». Все пациентки соответствовали основным критериям включения (возраст от 18 до 40 лет, нормальный овариальный резерв, информированное согласие на участие в исследовании).
Гистологическое и иммуногистохимическое (ИГХ) исследования эндометрия были проведены в патолого-анатомическом отделении (зав. отделением – д.м.н., профессор Щеголев А.И.).
Исследование выполнено на пайпель-биоптатах эндометрия с помощью аспирационной кюретки Pipelle de Cornier (Laboratorie C.C.D., Франция), взятых в период «окна имплантации» (6–8-й день после овуляции по данным ультразвукового исследования) в циклах до оперативного лечения и перед проведением программы ЭКО, от 70 пациенток, разделенных на 7 групп: 1-я группа – 10 пациенток с аденомиозом, 2-я группа – 10 пациенток с миомой матки, 3-я группа – 10 пациенток с внутриматочной перегородкой, 4-я группа – 10 пациенток с внутриматочной перегородкой, 5-я группа – 10 пациенток с полипами эндометрия, 6-я группа – 10 пациенток с внутриматочными синехиями и 7-я группа (группа контроля) – 10 пациенток с трубно-перитонеальным фактором бесплодия без патологии эндо- и миометрия.
ИГХ-исследование выполнялось по стандартной методике [12] c использованием моноклональных антител к Anti-ER antibody [clone 1D5], Mouse monoclonal, RTU (Dako, Denmark), Anti-PgR antibody [clone PR636], Mouse monoclonal, RTU (Dako, Denmark), Anti-LIF Antibody [clone 9824], Mouse monoclonal (MAB250, 1:100, R&D Systems,USA), Anti-LIFR antibody, Rabbit polyclonal, 1:200 (ab202847, Abcam, UK), Anti-Integrin αV/β3 antibody [clone 23C6], Mouse monoclonal, 1:100 (Santa Cruz Biotechnology, USA), Anti-VEGFA antibody, Rabbit polyclonal, 1:100 (ab9570, Abcam, UK), Anti-Claudin5 antibody, Rabbit polyclonal, 1:200 (ab15106, Abcam, UK), Anti-HOXA10 antibody, Rabbit polyclonal, 1:200 (GTX37412, GeneTex, USA), Anti-HOXA11 antibody, Rabbit polyclonal, 1:200 (GTX48983, GeneTex, USA), Anti-MMP9 antibody [clone EP1254], Rabbit monoclonal, 1:200 (ab76003, Abcam, UK), Anti-MMP2 antibody [clone 6E3F8], Mouse monoclonal, 1:200 (ab86607, Abcam, UK).
Оценку экспрессии ER осуществляли с помощью шкалы Histoscore по формуле: HS=1a+2b+3c, где а – % слабо окрашенных клеток, b – % умеренно окрашенных клеток, с – % сильно окрашенных клеток, 1, 2, 3 – интенсивность окрашивания, выраженная в баллах. Степень выраженности экспрессии ER и PR оценивали: 0–10 баллов – отсутствие экспрессии, 11–100 баллов – слабая экспрессия, 101–200 баллов – умеренная экспрессия, 201–300 баллов – выраженная экспрессия. Также подсчитывали стромальный прогестерон-эстрогеновый индекс (СПЭИ) – отношение экспрессии PR к экспрессии ER в эндометриальной строме.
Результаты ИГХ-реакции для других маркеров оценивали полуколичественным методом в баллах по общепринятой методике: отсутствие окрашенных клеток (-) – 0 баллов; менее 20% окрашенных клеток (+) – 1 балл; от 20 до 40% окрашенных клеток (++) – 4 балла; более 40% окрашенных клеток (+++) – 6 баллов [13].
Статистический анализ
Статистический анализ полученных данных производили с использованием программного обеспечения MS Office Excel и Statistica 10.0 (США) с соблюдением рекомендаций для медицинских и биологических исследований. Для определения нормальности распределения использовали критерий Шапиро–Уилка (при числе исследуемых менее 50). Данные с нормальным распределением представлены как среднее значение (стандартное отклонение). При сравнении средних величин в нормально распределенных совокупностях количественных данных рассчитывался t-критерий Стьюдента. Совокупности количественных показателей, распределение которых отличалось от нормального, описывались при помощи значений медианы (Me) и нижнего и верхнего квартилей (Q–Q3). Для сравнения независимых совокупностей в случаях отсутствия признаков нормального распределения данных использовался U-критерий Манна–Уитни. Для проверки различий между двумя сравниваемыми парными выборками нами применялся W-критерий Уилкоксона. Различия считались статистически значимыми при р<0,05.
Результаты
При ИГХ-исследовании маркеров рецептивности эндометрия у больных до и после оперативного лечения (перед использованием методов ВРТ) и в группе контроля получены следующие результаты.
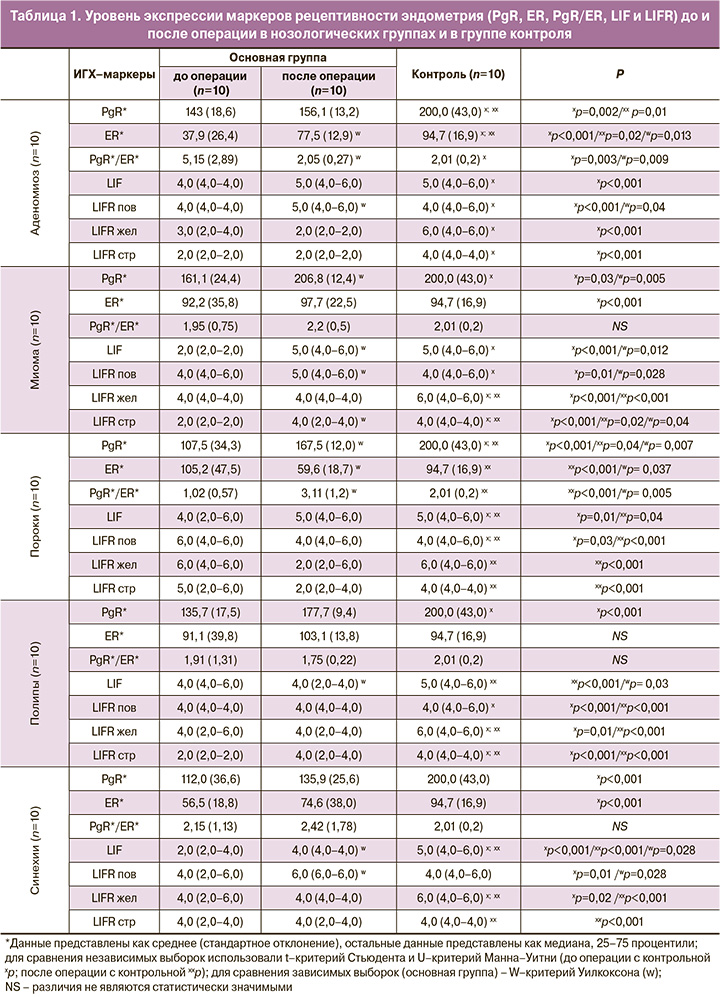
Экспрессия PgR и ER (табл. 1). В образцах эндометрия у больных с аденомиозом отмечена умеренная экспрессия PgR. При этом в контрольной группе отмечалась статистически значимо большая экспрессия PgR по сравнению с группами до и после оперативного лечения (p=0,002 и p=0,01 соответственно). В группах аденомиоза до операции отмечена слабая и статистически значимо меньшая, по сравнению с группами после операции и контроля экспрессия ER (p<0,001; p=0,013). При миоме матки в группе до операции отмечалась статистически значимо меньшая экспрессия PgR по сравнению с группами после оперативного лечения и контрольной (p=0,03; p=0,005 соответственно). В группе больных с миомой матки до и после операции отмечена слабая экспрессия ER. В группе больных с пороками развития матки до операции отмечалась статистически меньшая экспрессия PgR по сравнению с группами после оперативного лечения и контрольной (p<0,001; p=0,005 соответственно). В группе после операции отмечена статистически значимо более слабая экспрессия ER по сравнению с группой до операции и группой контроля, где экспрессия была умеренной (p<0,001; p=0,007 соответственно). У больных с полипами эндометрия до операции отмечалась статистически меньшая экспрессия PgR по сравнению с контрольной группой (p<0,001). В группе до операции отмечена слабая экспрессия ER по сравнению с группой после операции и группой контроля, где экспрессия была умеренной. При внутриматочных синехиях в группах до операции отмечалась статистически меньшая экспрессия PgR по сравнению с контрольной группой (p<0,001). В группе до операции отмечена слабая и статистически значимо меньшая экспрессия ER по сравнению с группой контроля, где экспрессия была умеренной (p<0,001).
Как известно, рецептивный эндометрий характеризуется показателем СПЭИ или PgR/ER в пределах 2–4 (табл. 1). При анализе рецептивности эндометрия у больных аденомиозом отмечено статистически значимое улучшение показателя СПЭИ после операции по сравнению с исходным уровнем (p=0,009). СПЭИ в группе больных с миомой матки до операции был менее 2, а в группе после операции – 2,2 (0,5) (p>0,05). СПЭИ был статистически значимо меньше в группах больных с пороками развития матки до операции по сравнению с группой после операции (p=0,005). Показатель СПЭИ был ниже 2 во всех группах больных с полипами эндометрия. У больных с внутриматочными синехиями показатель СПЭИ не различался в группах и был на нижней границе «нормы».
Исследования экспрессии LIF (табл. 1). При исследовании маркера рецептивности LIF, играющего важную роль в процессе инвазии трофобласта, нами установлено среднее значение уровня экспрессии во всех группах, отмечена статистически меньшая экспрессия LIF в группе больных с аденомиозом до операции по сравнению с контрольной группой (p<0,001).
Выявлена экспрессия маркера LIFR в цитоплазме поверхностного и железистого эпителия эндометрия и в цитоплазме стромы эндометрия. Отмечена более высокая экспрессия поверхностного LIFR при незначительной его стромальной экспрессии во всех группах. При аденомиозе отмечена статистически значимо большая экспрессия LIFR в цитоплазме поверхностного эпителия и в строме эндометрия после операции по сравнению с экспрессией этого маркера в образцах эндометрия, полученных до операции (p<0,001).
У больных с миомой матки установлена низкая экспрессия LIF в группе до операции, в то время как в группе после операции и в контрольной группе отмечена высокая экспрессия, что было статистически значимым (p=0,03; p=0,005 соответственно). Наблюдалась статистически значимо меньшая экспрессия поверхностного и стромального LIFR в группе до операции по сравнению с группой после операции и контрольной (p=0,012; p=0,028 соответственно). При пороках развития матки установлена умеренная и статистически значимо меньшая экспрессия LIF по сравнению с контрольной группой (p=0,01; p=0,04 соответственно). Наблюдалась статистически значимо меньшая экспрессия поверхностного LIFR в основной группе по сравнению с контрольной и с группой после операции (p=0,03 и p<0,001 соответственно). Установлена умеренная экспрессия LIF в группах больных с полипами эндометрия, в то время как в контрольной группе отмечена высокая экспрессия. Отмечена статистически значимо меньшая экспрессия LIFR во всех компонентах эндометрия в основных группах по сравнению с контрольной (p<0,001).
Отмечена низкая/умеренная и статистически меньшая экспрессия LIF в группах больных с внутриматочными синехиями до операции по сравнению с экспрессией в группе после операции и контрольной группе (p<0,001; p=0,028, соответственно)
Экспрессия LIFR была средней во всех компонентах эндометрия в основных группах и статистически значимо меньшей по сравнению с контрольной (p<0,05), где она была высокой; также отмечена средняя и статистически меньшая экспрессия LIFR в цитоплазме поверхностного эпителия эндометрия в группе до операции по сравнению с группой после операции, где она была высокой (p=0,001).
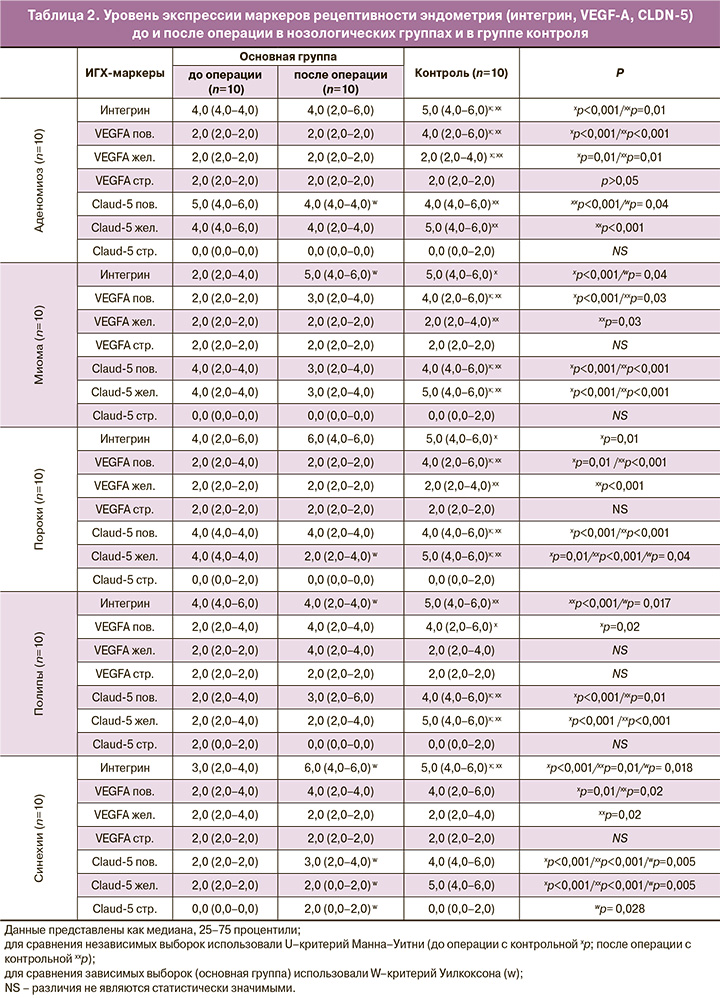
При изучении экспрессии αvβ3-интегрина (integrin β3) (табл. 2, рисунок), необходимого для осуществления успешной адгезии бластоцисты к поверхностному эпителию эндометрия, у больных аденомиозом установлено среднее значение уровня экспрессии интегрина в основных группах, которая была статистически значимо меньшей в группе до операции по сравнению с контрольной, где экспрессия была близкой к высокой (p<0,001; p=0,01 соответственно). При изучении экспрессии интегрина у больных с миомой матки установлена его низкая и статистически меньшая экспрессия в группе до операции по сравнению с группой после операции и контрольной, где экспрессия была высокой (p=0,001). При пороках развития установлена умеренная и статистически меньшая экспрессия интегрина в группе до операции по сравнению с контрольной (p=0,01). Установлена средняя экспрессия интегрина в группах больных с полипами эндометрия, которая была статистически значимо меньшей по сравнению с контрольной группой, где экспрессия была высокой (p<0,001). В группе больных с внутриматочными синехиями установлена средняя и статистически меньшая экспрессия интегрина в группе больных до операции по сравнению с группой после операции и контрольной группой, где экспрессия была высокой (p=0,018; p=0,01 соответственно).

При исследовании VEGF-A (табл. 2), также играющего важную роль в этапе имплантации бластоцисты, определяли его экспрессию в цитоплазме клеток поверхностного и железистого эпителия, в эндотелии сосудов эндометрия. При аденомиозе экспрессия VEGF-A в цитоплазме клеток поверхностного и железистого эпителия была слабой в основных группах по сравнению со средним значением уровня экспрессии маркера в контрольной, данное различие было статистически значимым (p<0,001), в то время как экспрессия в эндотелии сосудов не различалась. У больных с миомой матки выявлена более слабая экспрессия поверхностного VEGF-A по сравнению со средней экспрессией в контрольной группе, данное различие было статистически значимым (p<0,001; p=0,03 соответственно). У больных с пороками матки отмечается более слабая экспрессия поверхностного VEGF-A по сравнению со средней экспрессией в контрольной, данное различие было статистически значимым (p=0,01; p<0,001 соответственно). У больных с полипами эндометрия отмечается более слабая экспрессия VEGF-A во всех компонентах эндометрия. При внутриматочных синехиях отмечается более слабая и статистически меньшая экспрессия VEGF-A в цитоплазме клеток поверхностного эпителия по сравнению со средней экспрессией в контрольной группе(p=0,01; p=0,02 соответственно).
При аденомиозе отмечена статистически значимо более высокая экспрессия клаудина (CLDN-5) (табл. 2, рисунок) в цитоплазме клеток поверхностного эпителия в группах больных до операции по сравнению с группой после операции (p=0,04). У больных с миомой матки отмечена статистически значимо меньшая экспрессия клаудина (CLDN-5) в цитоплазме клеток поверхностного и железистого эпителия эндометрия в группах больных до операции по сравнению с контрольной группой после операции (p<0,001; p<0,001 соответственно). При пороках развития матки нами отмечена статистически значимо более высокая экспрессия клаудина (CLDN-5)
как в цитоплазме клеток поверхностного, так и железистого эпителия эндометрия в контрольной группе по сравнению с группой до и после операции (p<0,001). При изучении CLDN-5 у больных с полипами эндометрия отмечена более высокая его экспрессия в цитоплазме клеток поверхностного и железистого эпителия эндометрия в контрольной группе по сравнению с группой до и после операции (p<0,001). У больных с внутриматочными синехиями отмечена статистически значимо меньшая экспрессия клаудина (CLDN-5) в цитоплазме клеток поверхностного и железистого эпителия, эндотелия сосудов эндометрия по сравнению с группамми контроля и после операции (p=0,005; p=0,005; p=0,028 соответственно). Аналогичная разница в экспрессии отмечена и между основными группами: более высокая экспрессия CLDN-5 в цитоплазме клеток поверхностного и железистого эпителия, эндотелия сосудов в группе после операции по сравнению с группой до операции (p=0,001). При этом отмечена слабая экспрессия CLDN-5 в строме во всех нозологических группах (табл. 2).
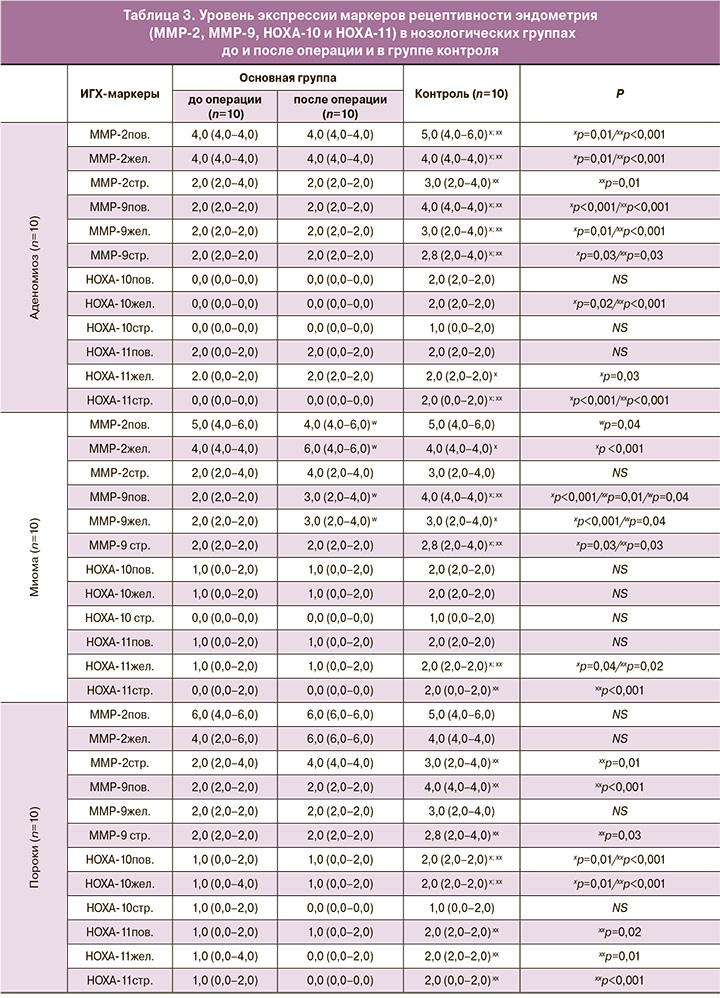
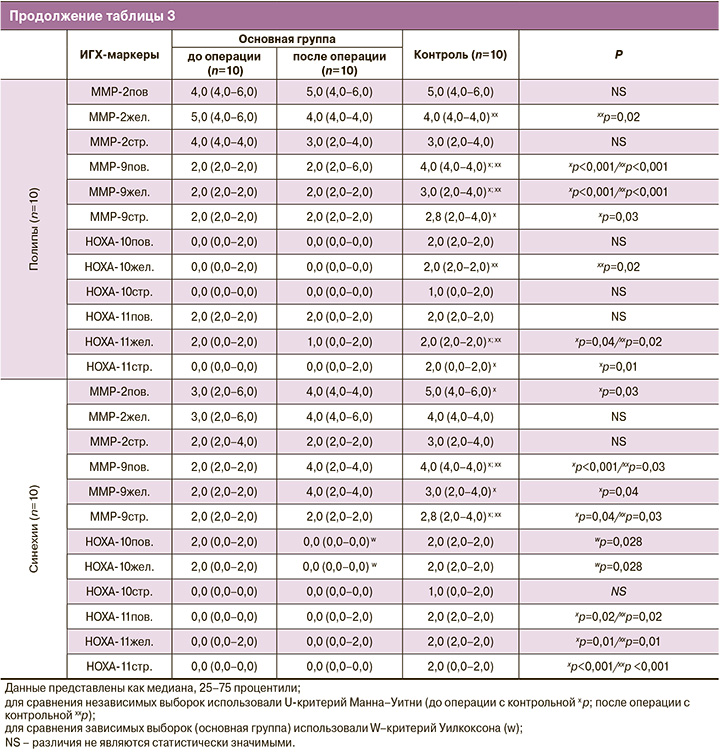
Как известно, основными энзимами имплантации являются матриксные металлопротеиназы (MMP), в частности ММР-2 и ММР-9 (табл. 3, рисунок). Экспрессия ММР-2 была умеренной в цитоплазме клеток поверхностного и железистого эпителия эндометрия и слабой – в цитоплазме клеток стромы эндометрия в группах больных аденомиозом по сравнению с группой контроля, где отмечена умеренная экспрессия маркера в цитоплазме клеток поверхностного и железистого эпителия эндометрия (p=0,01; p<0,001 соответственно) и немного сниженная – в цитоплазме клеток стромы эндометрия. Экспрессия ММР-9 была слабой во всех компонентах эпителия эндометрия в группах больных аденомиозом по сравнению с группой контроля, где отмечена умеренная экспрессия маркера, данные различия имели статистическую значимость (p<0,05). У больных с миомой матки до операции в целом отмечалась статистически значимо менее выраженная экспрессия ММР-2 и ММР-9 в цитоплазме клеток поверхностного и железистого эпителия эндометрия по сравнению с группой после операции и в контрольной (p=0,04; p=0,04 соответственно). Экспрессия ММР-2 и -9 в цитоплазме клеток стромы эндометрия в группах больных с миомой матки была статистически значимо меньшей по сравнению с контрольной группой (p<0,05). У больных с пороками развития матки в целом отмечалась одинаково выраженная экспрессия ММР-2 и ММР-9 в группах до и после операции. В группе больных с полипами эндометрия экспрессия ММР-2 и ММР-9 также не различалась между подгруппами основной группы. В группе больных с внутриматочными синехиями экспрессия ММР-2 и ММР-9 не различалась между подгруппами основной группы.
Что касается семейства НОХ-генов, в частности НОХА-10 и НОХА-11, то в нашем исследовании во всех нозологических группах отмечен низкий уровень экспрессии этих маркеров во всех компонентах эндометрия, однако у больных с внутриматочными синехиями до операции отмечена слабая и статистически значимо меньшая экспрессия НОХА-10 в цитоплазме клеток поверхностного и железистого эпителия эндометрия по сравнению с группой после операции (p=0,028; p=0,028 соответственно).
Обсуждение
Успешность имплантации во многом определяется наличием рецептивного эндометрия [12, 14, 15].
Имеющиеся в литературе данные о влиянии аденомиоза на репродуктивную функцию немногочисленны; тем не менее, нельзя отрицать негативное влияние аденомиоза на фертильность и, в частности, на результаты применения ВРТ [16]. Предполагается, что аденомиоз может способствовать бесплодию, изменяя нормальную архитектуру и функцию миометрия, изменяя нормальную перистальтику матки и отрицательно влияя на транспорт сперматозоидов. Более важным является то, что аденомиоз может привести к нарушенной децидуализации, проявляющейся в снижении рецептивности эндометрия.
В настоящее время появляется все больше данных, изучающих влияние аденомиоза на экспрессию молекулярных маркеров эндометрия. Экспрессия гена HOXA-10 может быть снижена в эндометрии секреторной фазы женщин с аденомиозом. Нарушение экспрессии LIF также наблюдается в «окно имплантации» [17, 18]. Отмечена сниженная экспрессия интегрина и остеопонтина у женщин с аденомиозом [18]. Имеются также данные о снижении метаболизма эстрогенов в эутопическом эндометрии. В целом это говорит о том, что аденомиоз может быть связан с эпигенетической дисрегуляцией генов [19].
Существуют малочисленные данные, оценивающие влияние медикаментозной терапии, хирургического удаления и других вмешательств на восстановление репродуктивной функции у женщин с аденомиозом [20–22]. Тем не менее есть некоторые доказательства, что применение агонистов гонадотропин-рилизинг-гормона (ГнРГ) в течение 1–3 месяцев может увеличить частоту наступления беременности после переноса криоконсервированных эмбрионов у женщин с аденомиозом [23, 24]. Учитывая доказательства того, что длительная терапия агонистами ГнРГ может привести к уменьшению проявлений аденомиоза, включая влияние на процессы воспаления тканей и ангиогенеза, а также повышение апоптотического индекса [19], можно предположить, что этот подход может улучшить рецептивность эндометрия.
Ранее опубликованный систематический обзор показал, что субмукозные лейомиомы ассоциированы с более низкой частотой имплантации, чем у женщин без таковых, и с повышенным риском ранней потери беременности [19]. Влияние интрамуральных лейомиом на репродуктивную функцию остается предметом дискуссий [25–29].
Существует целый ряд потенциальных механизмов, с помощью которых лейомиомы могут негативно влиять на имплантацию. К ним относятся аномально повышенная сократительная способность матки и нарушения экспрессии цитокинов эндометрия, а также аномальная васкуляризация и хроническое воспаление эндометрия. Имеются данные, что уровень HOXA-10 снижается в эндометрии женщин с подслизистыми лейомиомами не только в ткани, которая находится над самими лейомиомами, но и в эндометрии [19]. Было продемонстрировано, что сниженная экспрессия таких факторов, как HOXA-10 и LIF, может объяснить дефектную децидуализацию и снижение частоты имплантации [30]. При наличии подслизистых лейомиом нормальное увеличение LIF в лютеиновую фазу «замедляется» [19]. У пациенток с множественными узлами миомы, а также с наличием узлов, деформирующих полость матки, нарушение рецептивности наиболее выражено. Эндометрий пациенток с миомой матки в сочетании с бесплодием характеризуется снижением уровня LIF, что свидетельствует о неполноценности эндометрия и согласуется с работами [11, 14].
Одним из подходов к оценке взаимосвязи между полипами эндометрия и бесплодием является изучение влияния полипэктомии на восстановление фертильности [31]. В группе больных после гистероскопической полипэктомии отмечено в два раза больше шансов наступления беременности, чем в контрольной группе больных, которые не подвергались полипэктомии [19, 32]. Потенциальные механизмы, с помощью которых полипы эндометрия могут отрицательно влиять на фертильность, включают как механическое вмешательство, так и высвобождение молекул, которые отрицательно влияют на транспорт сперматозоидов или имплантацию эмбрионов. Имеются данные о сниженных уровнях HOXA-10 и HOXA-11 [19]. Не было найдено ни одного исследования, сравнивающего эти выражения до и после полипэктомии.
В доступной нам литературе мы не обнаружили информации по рецептивности эндометрия у больных с пороками развития и внутриматочными синехиями, а также по оценке рецептивности эндометрия до и после хирургического лечения доброкачественных заболеваний матки.
Заключение
На основании проведенного нами исследования мы сделали следующие выводы: доброкачественные заболевания и пороки развития матки оказывают негативное влияние на рецептивность эндометрия, что выражается в умеренной экспрессии PR, преимущественно низком уровне СПЭИ, среднем уровне экспрессии LIF, низком и среднем уровнях экспрессии интегрина, низкой экспрессии VEGF-A, умеренной экспрессии MMP-2 и низкой экспрессии MMP-9, слабой экспрессии HOXA-10 и HOXA-11. После комплексного лечения отмечено улучшение рецептивности эндометрия: увеличение уровня экспрессии PR и ER, нормализация уровня СПЭИ, увеличение уровня экспрессии LIFR, интегрина, VEGF-A.



