В настоящее время атипичный гемолитико-уремический синдром (аГУС) – крайне редкое, но без лечения – летальное заболевание, входит в практику не только нефрологических и реанимационных отделений. С ним можно столкнуться в неврологических и акушерских стационарах, есть описания развития этого заболевания после хирургических манипуляций, однако для своевременной диагностики этого катастрофического и угрожающего жизни заболевания, при котором до 75% пациентов умирает без лечения даже при первом эпизоде болезни, необходимо быть бдительным. Разнообразие возможных комплемент-активирующих состояний, «запускающих» развитие аГУС, требует содружественной работы специалистов различного профиля. АГУС представляет собой комплемент-опосредованную тромботическую микроангиопатию (ТМА), для которой, помимо типичных для всех ТМА гемолитической анемии и тромбоцитопении, наиболее характерно развитие почечной недостаточности. Однако генерализация ТМА с вовлечением других сосудистых бассейнов может привести к поражению различных органов и систем, создавая значительные диагностические сложности. При этом вероятность встретить ТМА довольно высока даже в хирургической практике, поскольку нередко определить точную причину анемии и тромбоцитопении в сочетании с почечной недостаточностью у пациента, перенесшего оперативное вмешательство, крайне сложно, особенно при массивных кровопотерях. ТМА, широко распространенная в акушерской практике, является крайне редким осложнением при гинекологических манипуляциях и описана, в основном, после миомэктомий и выскабливаний полости матки, сопровождающихся умеренной кровопотерей [1–3]. В то же время дисфункциональные маточные кровотечения по-прежнему являются одной из наиболее серьезных проблем современной гинекологии. Патология эта, частота которой в структуре всех гинекологических заболеваний достигает 40%, склонна к затяжному течению с частыми рецидивами, особенно у женщин в перименопаузальном периоде. При этом постоянная активация системы гемостаза, длительное и неконтролируемое использование гемостатических препаратов, выскабливание слизистой матки с поступлением провоспалительных цитокинов в кровь создает предпосылки для развития ТМА. ТМА в гинекологической практике коварна не только тем, что редко встречается и поздно диагностируется, но и трудностями в определении точной причины микроангиопатических нарушений, связанными с высокой вероятностью развития диссеминированного внутрисосудистого свертывания в периоперационном периоде [4]. Генерализация ТМА с вовлечением нескольких сосудистых бассейнов обусловливает полиморфизм клинических проявлений, что создает дополнительные диагностические трудности. Атипичный ГУС представляет собой системную ТМА с преимущественным поражением почек, обусловленную нарушением регуляции альтернативного пути активации комплемента [5, 6]. Представляем наблюдение аГУС, который манифестировал после хирургического вмешательства по поводу дисфункционального маточного кровотечения.
Клиническое наблюдение
Пациентка 50 лет экстренно госпитализирована в Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова с дисфункциональным маточным кровотечением (в течение 2 недель продолжались обильные кровянистые выделения из половых путей). В соматическом анамнезе – холецистэктомия по поводу желчекаменной болезни около 20 лет назад с последующими ежегодными приступами холангита/панкреатита в отсутствие данных за холедохолитиаз. Наследственный анамнез: не отягощен. Акушерский анамнез: 1 медицинский аборт, без осложнений.
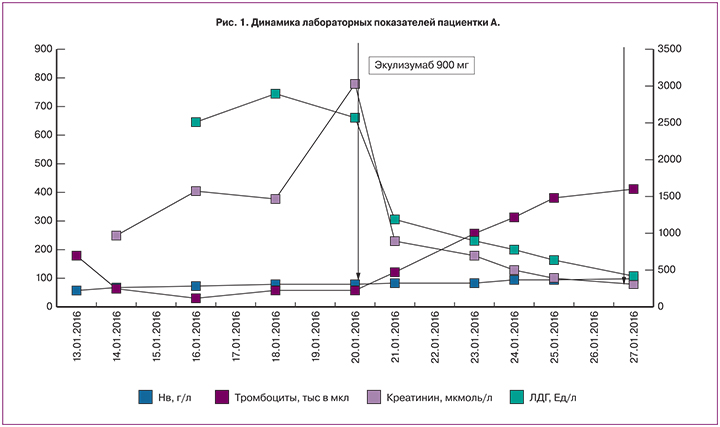
При поступлении (рис. 1) выявлена тяжелая анемия (гемоглобин 59 г/л), остальные показатели крови в пределах нормы (тромбоциты 183х10^9/л). Проведено раздельное диагностическое выскабливание слизистой полости матки и цервикального канала, кровопотеря при оперативном вмешательстве оценена в 400 мл, гемодинамические показатели во время и после него оставались стабильными. После выскабливания – трансфузия эритроцитарной взвеси в объеме 670 мл и инфузия 1000 мл кристаллоидов, уровень гемоглобина составил 76 г/л. После оперативного пособия отмечалась тошнота и рвота, купированная введением ондасетрона 4 мг. В течение последующих 3 часов отмечались тахикардия до 115 уд/мин, АД 150 и 100 мм рт. ст., по катетеру с момента госпитализации выделилось 100 мл мочи с последующим уменьшением темпа диуреза. Для стимуляции последнего вводился фуросемид в максимальной дозе 400 мг, однако за 12 часов получено лишь 120 мл мочи вида мясных помоев.
На следующий день утром появилась выраженная инспираторная одышка, тошнота, неоднократная рвота, боли в эпигастрии и внизу живота. Сохранялась анурия, резистентная к стимуляции, креатинин сыворотки (СКр) составил 250 мкмоль/л. При осмотре зарегистрировано повышение АД до 200 и 120 мм рт. ст., ортопноэ, цианоз носогубного треугольника, крепитация в нижних отделах легких. Зафиксированы умеренная тромбоцитопения (до 64×109/л), признаки выраженной гиперкоагуляции (АЧТВ 19 сек, D-димер 9999 мкг/л), нейтрофильный лейкоцитоз (лейкоциты 16,6×109/л). В связи с подозрением на тромбоз в системе нижней полой вены (вероятно, с вовлечением почечных вен) и тромбоэмболию легочной артерии (ТЭЛА) выполнена ультразвуковая допплерография (УЗДГ) нижней полой вены, нижних конечностей, эхокардиография (ЭХО КГ) и рентгенография легких. На доступных осмотру участках нижней полой вены и почечных вен признаков тромбоза не обнаружено. Выявлен двухсторонний тромбоз глубоких вен обеих нижних конечностей (окклюзивный тромбоз задней большеберцовой вены (ЗББВ) в средней трети, тотальный тромбоз медиальных и суральных вен правой голени, ЗББВ в верхней и средней трети, тотальный тромбоз медиальных и суральных вен левой голени). По данным ЭХО КГ зарегистрирована умеренная легочная гипертензия (среднее давление в легочной артерии 60 мм рт. ст.) при нормальных размерах полости левого желудочка и фракции выброса. На рентгенограмме легких: убедительных данных за наличие ТЭЛА крупных ветвей не получено, выявлены признаки сосудистого полнокровия легких. С целью уточнения характера поражения почек выполнено ультразвуковое исследование (УЗИ) почек с допплерографией почечного кровотока: расположение, форма, структура, эхогенность и размеры обеих почек в пределах нормы. Однако по данным допплерографии выявлено полное отсутствие коркового кровотока при сохранном кровотоке по магистральным почечным артериям, что характерно для острого повреждения почек с преимущественно ренальным механизмом.
Учитывая тромбоз глубоких вен с предположительной ТЭЛА мелких ветвей у пациентки с почечной недостаточностью, начата терапия нефракционированным гепарином в суточной дозе 25000 ЕД с дозированной скоростью введения под контролем АЧТВ (целевой уровень 60–90 секунд). Состояние пациентки оставалось тяжелым, но стабильным. К концу 2-х суток сохранялись артериальная гипертензия, тяжелая анемия (гемоглобин 66 г/л), тромбоцитопения (28×109/л), лейкоцитоз (17×109/л), впервые зарегистрирована гипергликемия (16 ммоль/л), отмечено нарастание мочевины (16,9 ммоль/л) и креатинина (404,9 мкмоль/л). В связи с этим начата терапия гемодиализом. Наличие нейтрофильного лейкоцитоза и повышение уровня прокальцитонина до 4,5 потребовало назначения антибактериальных препаратов (амоксиклав).
В связи с подозрением на ТМА исследованы маркеры микроангиопатического гемолиза – шизоциты и лактатдегидрогеназа (ЛДГ). Диагноз ТМА подтвержден полученными результатами: ЛДГ 2512 ЕД/л (норма до 480 ЕД/л), шизоциты – 2,5% (норма 0,1%). Для уточнения причины ТМА взята кровь на ADAMTS 13 и антифосфолипидные антитела (АФА). Гистологическое исследование материала, полученного во время выскабливания матки, позволило исключить онкологический процесс. Была также исключена наследственная тромбофилия (не выявлено мутаций факторов II и V, уровень антитромбина III – 80%).
В связи с появлением у пациентки сильных разлитых болей в животе распирающего характера с симптомами раздражения брюшины обсуждалась острая хирургическая патология. С целью выяснения причины болей в животе выполнена эзофагогастродуоденоскопия (ЭГДС) выявлены эрозии в антральной части желудка и в луковице двенадцатиперстной кишки без признаков прободения. УЗИ брюшной полости – без особенностей. Впервые исследован уровень амилазы крови, достигший 320 Ед/л (норма 25–125 Ед/л). Гиперамилаземия в сочетании с гипергликемией позволила обсуждать ТМА поджелудочной железы. Учитывая наличие тромбоза в системе нижней полой вены, несмотря на генерализацию ТМА, от плазмообмена было решено воздержаться до получения результатов АФА и ADAMTS-13. Продолжена заместительная почечная, антикоагулянтная, антибактериальная и симптоматическая терапия. В последующие 4 дня состояние пациентки сохранялось стабильным, тяжелым, без отрицательной динамики. Гемодинамика на фоне гипотензивной терапии оставалась стабильной, уровень гемоглобина увеличился до 81 г/л, число тромбоцитов – до 60–73×109/л. Однако острое повреждение почек не разрешалась, сохранялись шизоцитоз (2,5%), и повышенный уровень ЛДГ (2560 Ед/л).
Получены результаты анализов. Активность ADAMTS 13 составила 45%, что исключало диагноз тромботической тромбоцитопенической пурпуры. Катастрофический антифосфолипидный синдром (КАФС) был исключен на основании отсутствия антител к кардиолипину, В2-гликопротеину 1 и волчаночного антикоагулянта. Установлен диагноз: Атипичный ГУС: тромботическая микроангиопатия (микроангиопатическая гемолитическая анемия, тромбоцитопения) с поражением почек, поджелудочной железы, желудочно-кишечного тракта. Тромбоз глубоких вен обеих нижних конечностей. ТЭЛА, мелких ветвей.
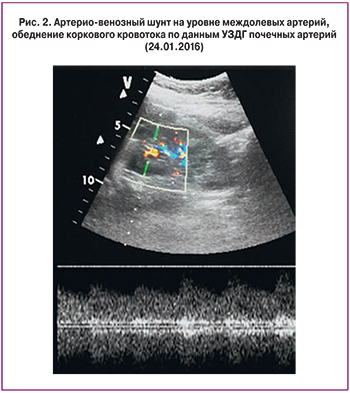
Учитывая тяжесть состояния больной и возможность дальнейшей генерализации ТМА с высоким риском развития угрожающих жизни осложнений, было принято решение о назначении экулизумаба. Перед началом терапии пациентка была вакцинирована противоменингококковой вакциной менцевакс. Первая инфузия экулизумаба в дозе 900 мг проведена на седьмые сутки пребывания в стационаре. В течение первой недели после введения препарата отмечено разрешение острого поражения почек: диурез быстро увеличивался и достиг 3200 мл/сут, СКр и мочевина в динамике снизились до 187 мкмоль/л и 12 ммоль/л, соответственно, скорость клубочковой фильтрации по клиренсу креатинина (проба Реберга) составила 23 мл/мин, что позволило прекратить процедуры гемодиализа. В общем анализе мочи – белок 1,6 г/л, эритроцитурия 30–40 в п/зр. При повторной УЗДГ почечных артерий отмечено появление коркового кровотока, хотя и сильно обедненного, с резким повышением индексов резистивности (RI) до 0,9. Отмечена быстрая положительная динамика гематологических показателей: к концу недели число тромбоцитов нормализовалось (263×109/л), уровень гемоглобина повысился, ЛДГ – снизился до 740 Ед/л, купирована гипергликемия. При повторной ЭГДС отмечено улучшение эндоскопической картины. Коагулограмма не имела значимых отклонений. Пациентка переведена на терапию низкомолекулярными гепаринами. В связи с необходимостью продолжения антибактериальной терапии в течение 2 недель после вакцинации произведена смена антибиотика – назначен тиенам в суточной дозе 1 г, продолжена в прежнем объеме симптоматическая терапия. После повторного введения 900 мг экулизумаба через семь дней после первого отмечена нормализация СКр (104–80 мкмоль/л), однако анемия сохранялась (гемоглобин 86 г/л). По данным повторной УЗДГ вен нижних конечностей отмечена начальная реканализация тромбоза глубоких вен. Выполненная в третий раз УЗДГ почечных артерий обнаружила улучшение показателей коркового кровотока: на фоне незначительного повышения RI (до 0,7) и снижения систолических скоростей отмечены единичные спектры с RI 0,48. Был выявлен также артерио-венозный шунт на уровне междолевых артерий (рис. 2). Такие допплерографические находки свидетельствовали о сохраняющейся ишемии почек как следствия тромботической блокады их микроциркуляторного русла. Об этом же свидетельствовала персистирующая протеинурия, которая колебалась от 0,8 до 1,5 г/сутки и практически исчезла только через 3 месяца после начала терапии.
 Пациентка была выписана с удовлетворительными лабораторными показателями на 17-е сутки. После завершения индукционного курса экулизумаба антикомплементарная терапия продолжена в поддерживающем режиме (1200 мг/2 нед.) АД нормализовалось в течение 3 недель, что позволило полностью отказаться от антигипертензивной терапии. Продолжена антикоагулянтная терапия, через 6 месяцев низкомолекулярный гепарин заменен на варфарин с достижением целевого международного нормализованного отношения. Через 10 мес. после перенесенного острого эпизода показатели функции почек стабильно нормальные, мочевой синдром отсутствует, гематологические показатели в пределах нормы.
Пациентка была выписана с удовлетворительными лабораторными показателями на 17-е сутки. После завершения индукционного курса экулизумаба антикомплементарная терапия продолжена в поддерживающем режиме (1200 мг/2 нед.) АД нормализовалось в течение 3 недель, что позволило полностью отказаться от антигипертензивной терапии. Продолжена антикоагулянтная терапия, через 6 месяцев низкомолекулярный гепарин заменен на варфарин с достижением целевого международного нормализованного отношения. Через 10 мес. после перенесенного острого эпизода показатели функции почек стабильно нормальные, мочевой синдром отсутствует, гематологические показатели в пределах нормы.
Особенности случая и выводы
- Органосохраняющие хирургические вмешательства на матке сопровождаются мощным выбросом провоспалительных цитокинов, активацией системы свертывания крови и могут запустить каскад активации комплемента. Любые заболевания, сопровождающиеся маточным кровотечением, могут рассматриваться, как факторы риска ТМА.
- Поражение поджелудочной железы – частый спутник ТМА. При этом панкреатит может быть как одним из проявлений ТМА, так и одним из комплемент-активирующих состояний.
- При ТМА могут развиваться тромбозы крупных сосудов.
- УЗДГ почечных сосудов может служить основным неинвазивным методом диагностики окклюзивного поражения микроциркуляторного сосудистого русла почек при любых вариантах ТМА.
Обсуждение
Представленный случай интересен со многих позиций. Прежде всего, хирургическое выскабливание при дисфункциональном маточном кровотечении можно рассматривать как одно из основных комплемент-активирующих состояний, о чем свидетельствует наше наблюдение. С ним согласуются описания аГУС, развившегося после хирургических манипуляций в полости матки, особенно после выскабливания, миомэктомий и ручного отделения плаценты [7–9]. Эти ситуации характеризуются мощным выбросом провоспалительных цитокинов, в основном интерлейкина 6, индуцированного экспрессией тканевого фактора, что приводит к активации эндотелия, мононуклеаров и системы гемостаза, запуская каскадную активацию комплемента. Интересно, что при миомэктомии дополнительным триггером для активации комплемента рассматривают ишемию матки вследствие наложения щипцов, а также «выкручивание» миоматозного узла. Таким образом, при любых манипуляциях в полости матки врачи должны иметь определенную ТМА-настороженность.
Особенностью аГУС в нашем случае стало также поражение поджелудочной железы, развившееся как следствие генерализации микроангиопатического процесса. У пациентки, длительно страдающей хроническим панкреатитом, осложнившим болезнь желчевыводящих путей, ТМА-ассоциированное поражение поджелудочной железы было вполне ожидаемым, поскольку ишемия органа в результате микротромбообразования могла спровоцировать обострение хронического воспаления. С другой стороны, предшествующий панкреатит мог быть одним из мощных комплемент-активирующих состояний, способных индуцировать острую ТМА. Так, по данным ТМА – регистра Оклахомы, у 20% пациентов имелись признаки острого панкреатита, предшествующего развитию ТМА. Вероятно, поврежденная поджелудочная железа является источником агрессивных ферментов и множества провоспалительных цитокинов, что также приводит к поражению эндотелия и может спровоцировать активацию комплемента [10]. Мы полагаем, что имеющийся у больной хронический панкреатит мог стать дополнительным триггером ТМА, наряду с гинекологическими причинами.
При ТМА в 20% случаев развиваются тромбозы крупных сосудов. Согласно концепции тромботического шторма, предложенной С. Kitchens в 1998 г., все заболевания с массивным тромбообразованием, в том числе и ТМА, развиваются вследствие избыточного ответа на первоначальный протромботический стимул. В основе этого явления лежит прогрессирующая ступенчатая активация образования тромбина и угнетение фибринолиза с потреблением антикоагулянтных факторов. Развитие ТМА приводит к прогрессирующей выраженной органной ишемии, которая усугубляет процесс выбросом провоспалительных цитокинов, потенциирующих тромбообразование [11, 12]. Таким образом, тромботический шторм, как универсальный патологический круг, запускает тромбообразование в сосудах различного калибра, не только в микроциркуляторном русле. Наличие тромбоза глубоких вен/ТЭЛА больше характерно для КАФС. Именно в популяции этих больных, согласно международному реестру, частота тромбозов крупных сосудов достигает 20%. Учитывая общность патогенетических механизмов можно предполагать сходную частоту развития тромбозов крупных сосудов у пациентов с аГУС, о чем следует помнить врачам различных специальностей. В данном случае помимо тромбоза глубоких вен/ТЭЛА было подозрение на мезентериальный тромбоз, а также зафиксирована не совсем типичная локализация микроциркуляторного поражения (почки, желудочно-кишечный иракт, мочевой пузырь, легкие). Все это требовало исключения КАФС, и уже после выписки пациентка повторно сдала кровь на АФА, которые оказались отрицательными, что позволило окончательно отвергнуть КАФС [12]. Кроме того, учитывая потенциальную возможность развития ТМА у пациентов с наследственной формой тромбофилии, мы исключили мутации факторов V (Лейден) и II (протромбина) [13, 14].
Таким образом, наше наблюдение подтверждает положение о том, что диагноз аГУС всегда представляет собой диагноз исключения.
Наличие ренальной ТМА как основного проявления аГУС мы подтвердили с помощью УЗДГ почечных сосудов, которая может служить основным неинвазивным методом диагностики окклюзивного поражения микроциркуляторного сосудистого русла почек, независимо от механизма его развития [15, 16]. Выявленные у пациентки обеднение дистального почечного кровотока в режиме цветного допплеровского картирования, снижение скоростных показателей в дуговых и междолевых артериях в сочетании с мозаичностью кровотока на уровне этих сосудов отражают ишемический характер внутрипочечного процесса. Выраженность изменений зависит от остроты процесса, что подтверждают результаты исследований, выполненных нашей больной в динамике. Кроме того, по данным ряда исследователей, УЗДГ позволяет дифференцировать почечную ТМА от острого канальцевого некроза вследствие, например, массивной кровопотери [17]. Таким образом, выявленные ультразвуковые признаки высоко специфичны для ТМА независимо от ее генеза, что позволяет считать УЗДГ ценным диагностическим методом, дополняющим и в ряде случаев заменяющим морфологическое исследование ткани почки при ТМА.
Особенностью нашего наблюдения также стал тот факт, что мы сразу начали терапию экулизумабом без предшествующего использования плазмы в связи с потенциальной тромбогенностью свежезамороженной плазмы и острой ТЭЛА у пациентки. По существующим российским рекомендациям по лечению аГУС у взрослых, всем больным с впервые выявленной ТМА или рецидивом аГУС, диагноз которого был установлен ранее, назначается плазмотерапия в режиме инфузий или обмена [18]. Плазмотерапия в случаях аГУС, эмпирически используемая в течение последних трех десятилетий, позволила значимо снизить летальность, однако восстановление функции почек при таком лечении до сих пор не превышает 50%. Экулизумаб – препарат группы комплемент-ингибирующих антител, назначается при неэффективности или при невозможности использования плазмотерапии, а также при наличии полиорганной недостаточности. Экулизумаб блокирует расщепление С5 на С5а и С5b, что препятствует образованию мембрано-атакующего комплекса С5b-9 и подавляет провоспалительное, протромботическое и литическое действия комплемента, предотвращая повреждение эндотелия и прекращая процессы микроциркуляторного тромбообразования. Применение экулизумаба приводит к обратному развитию явлений ТМА. При блокаде С5 компонента комплемента препаратом экулизумаб может нарушаться иммунный ответ на некоторые инкапсулированные бактерии, поэтому с целью предотвращения менингококковой инфекции необходима предварительная вакцинация, что мы и сделали. В случае невозможности вакцинации до старта рекомендована длительная антибиотикопрофилактика.
И последней особенностью ТМА в нашем наблюдении, на которую хотелось бы обратить внимание, стал крайне быстрый и четкий эффект экулизумаба, своевременно начатая терапия которым стала следствием скорой и всесторонней диагностики, возможной в результате слаженной работы целой команды специалистов.
Заключение
Представленное клиническое наблюдение демонстрирует манифестацию аГУС с тромбозом глубоких вен и ТЭЛА после диагностического выскабливания полости матки у пациентки, длительно страдающей панкреатитом. Такое сочетание комплемент-активирующих состояний привело к развитию аГУС с генерализацией микроангиопатического процесса и формированием полиорганного поражения в раннем послеоперационном периоде. Патогенетическое лечение, начатое на 7-е сутки с момента дебюта аГУС, позволило быстро добиться не только гематологического ответа, но и полностью восстановить функцию почек и других пораженных органов.



