В течение последних лет отмечена тревожная тенденция в акушерстве: ежегодно регистрируется рост материнской смертности от преэклампсии (ПЭ) и ее осложнений, несмотря на оптимизацию методов ранней диагностики и подходов к родоразрешению. Такая тенденция имеет целый ряд объяснений, однако особое внимание во всем мире уделяется появлению целого ряда состояний, способных имитировать ПЭ. За время, прошедшее с момента объединения L. Weinstein в 1982 г. симптомов гемолиза, тромбоцитопении и цитолиза, развивающихся во время беременности, в акроним HELLP-синдром, количество спорных вопросов диагностики и лечения этого заболевания неуклонно растет. Исходно состояние, названное HELLP-синдромом, было отнесено к осложненному течению ПЭ. Однако по мере накопления опыта оказалось, что HELLP-синдром сопровождается симптомами ПЭ только в 80% случаев, имеет целый ряд нетипичных проявлений в виде поражения других органов наряду с печенью (сердца, почек, легких, головного мозга и др.), а также может развиваться или прогрессировать в послеродовом периоде. HELLP-синдром, особенно при его дебюте после родов, характеризуется высокой летальностью, оцениваемой по данным разных исследований от 1 до 25%, а также высокой перинатальной смертностью (7–30%) [1–3]. Клинические и лабораторные проявления, а также морфологическая картина поражения печени при HELLP-синдроме имеют много общего с ПЭ. Однако остается открытым вопрос о причинах различий в фенотипических проявлениях ПЭ в этих случаях: почему у кого-то развивается «чистая» ПЭ, а у кого-то HELLP-синдром без симптомов ПЭ. Теорий, объясняющих эти различия, множество. Огромную роль в развитии HELLP-синдрома уделяют антифосфолипидному синдрому (АФС) и другим вариантам тромбофилий (мутации Лейдена (FV) и протромбина (F II)). Кроме этого, ведутся споры, является ли HELLP-синдром тромботической микроангиопатией (ТМА). Имеются описания полиморфизмов генов, кодирующих белки-регуляторы системы комплемента, что роднит HELLP-синдром с более грозным вариантом ТМА – атипичным гемолитико-уремическим синдромом (аГУС) [4].
Считается, что HELLP синдром осложняет 0,8–1% беременностей, а при тяжелой ПЭ и эклампсии встречается в 10–20% случаев. Однако различные варианты и особенности проявлений HELLP-синдрома мало известны врачам. Кроме того, имеются основания полагать, что HELLP-синдром не является ПЭ как таковой.
Цели исследования: изучить клинико-лабораторные характеристики HELLP-синдрома, а также сравнить клинические проявления нефропатии у женщин с умеренной и тяжелой ПЭ и HELLP-синдромом, сопоставив их с содержанием плацентарного фактора роста (PLGF) и растворимой fms-подобной тирозинкиназы-1 (sFlt-1) в крови.
Материал и методы исследования
Нами было оценено течение беременности у 141 женщины на сроке от 19 до 41 недель. В исследование были включены женщины в возрасте 18–41 года (средний возраст 31,35±1,14 года), наблюдавшиеся в Научном центре акушерства, гинекологии и перинатологии им. В.И. Кулакова в период с 2011 г. по сентябрь 2016 г. Пациентки были разделены на 4 основные группы: 1-ю группу составили 36 пациенток с полным и парциальным HELLP-синдромом (срок от 19 до 40 недель); 2-ю группу – 35 пациенток с тяжелой ПЭ (срок от 25,6 до 39,5 недель); 3-ю группу – 35 пациенток с умеренной ПЭ (срок от 29 до 40 недель); 40-ю группу (контрольную) – 35 соматически здоровых пациенток с неотягощенным акушерско-гинекологическим анамнезом и физиологическим течением данной беременности (срок от 34 до 41 недели). Контрольная группа была отобрана ретроспективно уже после родоразрешения: в течение всей беременности и после родоразрешения у них не было симптомов ПЭ и HELLP-синдрома.
Критериями для постановки диагноза полный HELLP-синдром служило сочетание 3 симптомов, развившихся во время беременности и купировавшихся в течение 48 часов после родоразрешения: 1) тромбоцитопения менее 150х10*9/л или снижения уровня тромбоцитов на 25% исходного значения, 2) повышения уровня лактатдегидрогеназы (ЛДГ) >600 МЕ/л, 3) появления маркеров цитолиза (АЛТ и/или АСТ >70 МЕ/л). В отсутствие тромбоцитопении или цитолиза устанавливался диагноз парциального HELLP-синдрома (ELLP и HEL-синдромы). Полный HELLP-синдром был зарегистрирован в 29 случаях (80%). Из 7 пациенток (20%) с неполным или парциальным HELLP-синдромом тромбоцитопении не имели 4 (11%), цитолиза – 3 (9%). Среди пациенток с HELLP-синдромом по уровню тромбоцитопении (с тромбоцитопенией были 32 пациентки) I классу по классификации Missisipi соответствовало 11 пациенток (30,6%), у них минимальные значения тромбоцитов варьировали от 4 до 50×109/л; II классу – 12 пациенток (33,3%), их значения тромбоцитов колебались от 51 до 98×109/л; III классу – 9 пациенток (25%), значения тромбоцитов от 104 до 152×109/л.
Хроническая артериальная гипертензия (ХАГ) была зарегистрирована у 11,1% пациенток с полным и парциальным HELLP-синдромом. В связи с тем, что провести четкую границу между умеренной и тяжелой ПЭ у пациенток с ХАГ не представляется возможным, мы исключили из анализа пациенток, отобранных для 2-й и 3-й группы, с предшествующей ХАГ, развивших ПЭ. В группе контроля ХАГ отмечалась у 8,5% пациенток, однако признаков ПЭ и прогрессии артериальной гипертензии во время беременности ни у одной из них зарегистрировано не было. По-видимому, ХАГ нельзя отнести к факторам риска развития HELLP-синдрома. В то же время оказалось, что хроническая болезнь почек (ХБП) 1–3б стадии была зарегистрирована у 25,7% пациенток с умеренной ПЭ, 22,2% с HELLP-синдромом и 14,2% с тяжелой ПЭ, тогда как в контрольной группе частота ХБП составила всего 5,7%. Интересно, что 4 (8,3%) пациентки, у которых развился HELLP-синдром, имели гепатит А в анамнезе, у одной пациентки был гепатит С минимальной степени активности.
При анализе соматического анамнеза в исследуемых группах на первый план вышел тот факт, что в группе HELLP-синдрома 4 пациентки (11,1%) имели почечный аллотрансплантат, у 4 (11,1%) пациенток была диагностирована до беременности системная красная волчанка, 4 пациентки имели достоверный АФС, у 1 из которых АФС был вторичный. У одной пациентки с первичным АФС и с рецидивирующими тромбозами глубоких вен с неоднократным развитием тромбоэмболии легочной артерии HELLP-синдром развился дважды, причем во вторую беременность она получала лечебные дозы низкомолекулярного гепарина (уровень анти-Ха составлял 0,72–1,2). Уровень sFlt-1 регулярно мониторировался во время беременности и находился в пределах нормальных значений, однако отмена низкомолекулярного гепарина за сутки до кесарева сечения привела к снижению уровня тромбоцитов до 86 тыс. в мкл и повышению ЛДГ до 680 МЕ/л. Эти лабораторные изменения сопровождались появлением олигурии, боли в правом подреберье, выраженной головной боли и общемозговой симптоматики при АД 130 и 86 мм рт. ст. максимально.
Только у 10 женщин 1-й группы были исследованы антифосфолипидные антитела (АФА), у 4 были выявлены достоверные признаки АФС (12%), еще у 3 были выявлены только не-критериальные АФА (антитела к аннексину, фосфатидилэтаноламину, протромбину). Диагноз «АФС» установлен в соответствии с критериями, принятыми в Саппоро в 1998 г. (дополненными в 2004–2006 гг.), на основании сочетания артериальных, венозных и/или микроциркуляторных тромбозов и/или акушерской патологии (синдром потери плода три и более раз на сроке до 10 нед, однократно на сроке более 10 нед, одна или более смерть плода от 10 и более недель беременности, одни или более преждевременные роды морфологически нормального новорожденного до 34 недели в результате тяжелой ПЭ, эклампсии или плацентарной недостаточности) с серологическими маркерами (дважды выявленными умеренными или высокими титрами антител к кардиолипину класса IgG и/или IgM, и/или антителами к β2-гликопротеину-I класса IgG и/или IgM, и/или волчаночным антикоагулянтом). Три пациентки (8,8%) с HELLP-синдромом имели системную красную волчанку, установленную еще до беременности согласно диагностическим критериям ACR 1997 г., на момент беременности болезнь была в стадии стойкой клинико-лабораторной ремиссии (SLEDAI 2-6).
4 пациентки с HELLP-синдромом имели почечный аллотрансплантат. Трансплантация почки была во всех случаях трупной, за 4–7 лет до наступления беременности, все 3 пациентки на предгравидарном этапе и в течение беременности получали иммуносупрессивную терапию циклоспорином в сочетании с преднизолоном. Признаков лекарственной ТМА до беременности ни клинически, ни морфологически ни у одной не было, тогда как концентрация циклоспорина регулярно исследовалась в течение беременности, проводилась своевременная коррекция доз.
Диагноз ПЭ установлен в соответствии с критериями ВОЗ от 2008 г., на основании появления после 20-й недели гестации артериальной гипертензии и протеинурии (более 0,3 г белка в суточной моче) с возможным развитием органной дисфункции. Тяжелой считалась ПЭ при двукратно выявленном повышении АД более 160 и 110 мм рт. ст., резистентному к антигипертензивной терапии и/или протеинурии более 5 г.
Протеинурия и признаки ренальной дисфункции до развития ПЭ у всех женщин отсутствовали. Нарушения функции почек у пациенток констатировали при скорости клубочковой фильтрации по методу Реберга–Тареева ниже 100 мл/мин и/или при уровне креатинина сыворотки более 90 мкмоль/л. Протеинурию определяли как суточную экскрецию белка более 0,3 г. Указанные клинические и лабораторные показатели регистрировали либо при поступлении беременной в клинику с признаками ПЭ, либо для родоразрешения в плановом порядке. У всех женщин прослежена динамика показателей начиная со II триместра беременности. У 14 пациенток основной группы в момент госпитализации, а также у всех пациенток из группы с ПЭ и у женщин группы контроля перед родами определяли содержание в плазме крови sFlt-1, PLGF, а также рассчитывали соотношение sFlt-1/PLGF.
Концентрацию PlGF и sFlt-1 в сыворотке крови беременных женщин определяли с помощью электрохемилюминесцентных диагностических тест-систем Elecsys PlGF и Elecsys sFlt-1 концерна «Ф. Хоффманн-Ля Рош» (Швейцария) на автоматическом анализаторе Cobas-e411 фирмы «КОНЕ» (Финляндия). Нормальными значениями PlGF считали значения от 170 до 950 пг/мл, sFlt1 – от 950 до 2800 пг/мл, sFlt-1/PlGF – от 4 до 20. Анализ проводился только 17 пациенткам с HELLP-синдромом (1-я группа), 12 пациенткам с тяжелой ПЭ (2-я группа) и 16 пациенткам с умеренной ПЭ (3-я группа).
Критериями исключения из исследования служили хронические вирусные гепатиты с высокой степенью активности; гемолитические анемии наследственного характера; сахарный диабет 1-го типа; установленная ранее идиопатическая тромбоцитопеническая пурпура; пароксизмальная ночная гемоглобинурия. Также из исследования были исключены женщины, у которых ТМА после родов прогрессировала.
Все полученные результаты наблюдения и обследования вносились в электронные таблицы MS Excel. Для выборки рассчитывались следующие статистические параметры: среднее математическое ожидание, медиана, стандартное отклонение, дисперсия, доверительный интервал. Для исследования вероятность принималась за 0,95. При проверке выборок на нормальность распределения использовался одновыборочный критерий Колмогорова–Смирнова. Уровень значимости был равен 0,05. При определении корреляции при нормальном распределении рассчитывался коэффициент Пирсона. При значении коэффициента менее 0,25 – нет корреляции, от 0,25 до 0,75 — умеренная связь, от 0,75 до 1 – сильная. Следует отметить, что если значения не подчинялись закону о нормальном распределении, тогда для определения корреляции мы рассчитывали коэффициент корреляции (r) Спирмена. Для сравнения двух независимых выборок использовался коэффициент Стьюдента: достоверными считали различия при р<0,05; при уровне р менее 0,05, но более 0,001 говорили о наличии тенденции к достоверности. Для сравнения нескольких (более 2) выборок использовался дисперсионный анализ ANOVA.
Результаты исследований
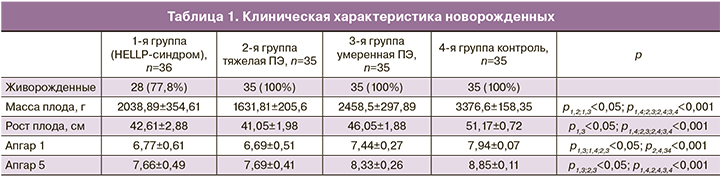
Сроки появления артериальной гипертензии в группе с ПЭ составили 26,92±2,52 недель, для HELLP-синдрома эти показатели не оценивались в связи с наличием у некоторых пациенток ХАГ. Средние значения для систолического и диастолического АД составили 145,92±10,30 и 91,29±5,07 мм рт.ст. соответственно, тогда как при тяжелой ПЭ эти показатели были 169,31±5,07 и 104,41±2,59 мм рт.ст., а при умеренной ПЭ – 149,56±5,96 и 96,08±2,36 мм рт.ст.
Средние сроки родоразрешения для пациенток 1-й группы были сопоставимы со 2-й группой (32,07±1,7 и 32,65±1,22 недель), в то время как 3-я группа была родоразрешена на сроке 35,81±0,98 недель, а контрольная – в 38,97±0,39 недель. Экстренное родоразрешение во 2-м триместре было проведено 2 (6%) пациенткам с HELLP-синдромом на сроке 19 и 21 неделя. В 19 недель дебютировал HELLP-синдром при многоплодной беременности у пациентки с первичным АФС.
При оценке состояния новорожденных обращает внимание высокая частота антенатальной гибели плода у пациентов с HELLP-синдромом (22,2%), процент живорожденных младенцев составил всего 77,8%, тогда как во 2-й, 3-й и 4-й группах все младенцы родились живыми (табл. 1). У пациенток с HELLP-синдромом чаще отмечены различные осложнения: у 4 (11,1%) – преждевременная отслойка нормально расположенной плаценты, у 6 из 36 (16,7%) было зарегистрировано кровотечение различной степени выраженности (до 2000 мл).
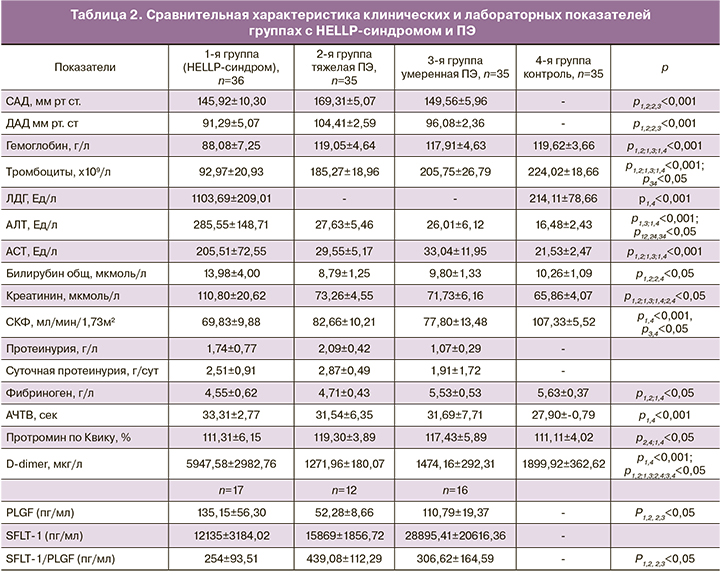
При определении концентрации PlGF и sFlt-1в сыворотке крови и соотношения sFlt-1/PlGF выявлены более высокие показатели соотношения sFlt-1/PlGF у женщин с тяжелой и умеренной ПЭ по сравнению с пациентками с HELLP-синдромом. Также отмечена умеренная связь уровня sFlt-1/PlGF со сроком родоразрешения: чем выше было соотношение sFlt-1/ PlGF, тем раньше пациентке требовалось родоразрешение (r=-0,38). При максимальных значениях sFlt-1/ PlGF в выборке с HELLP-синдромом 874,1 и 669,7 пг/мл сроки родоразрешения составили 25 недель, что является самым ранним у пациенток с исследованными маркерами ПЭ. Для выборки с тяжелой ПЭ максимальные значения sFlt-1/ PlGF: 1183 пг/мл и 860,6 пг/мл, а срок родоразрешения составил 26 недель и 31 неделю.
Значимая протеинурия и снижение функции почек отмечались у 23 (63,9%) пациенток с HELLP-синдромом (табл. 2). Значения суточной протеинурии были достоверно выше у пациенток с тяжелой ПЭ, при этом снижение функции почек было зарегистрировано только в группе HELLP-синдрома. Скорость клубочковой фильтрации у пациенток с HELLP-синдромом достигала минимального значения 16 мл/мин/1,73 м2, среднее значение 69,83±9,88 мл/мин/1,73 м2. У пациенток из группы контроля белок в моче не превышал физиологических значений.
У пациенток 1-й группы поражение почек было более выраженным, причем тяжесть нефропатии проявлялась не в выраженности протеинурии, а в степени снижении функции почек. Уровни гемоглобина и тромбоцитов в группе HELLP-синдрома были значимо ниже соответствующих показателей при умеренной и тяжелой ПЭ. При этом отмечена умеренная прямая корреляция значений гемоглобина и тромбоцитов (r=0,332). Уровень ЛДГ был исследован только у пациенток с HELLP-синдромом и составил 1103,69±209,01 Ед/л. Этот показатель, к сожалению, не входит в панель стандартного исследования у беременных женщин. Выявлена умеренная прямая связь уровня ЛДГ с уровнем креатинина (r=0,539) и с уровнем общего билирубина (r=0,606), и обратная корреляция ЛДГ с тромбоцитами (r=-0,384). Исследование шизоцитов проводили только 18 пациенткам с HELLP-синдромом, среднее значение составило 0,11±0,07%. Цитолиз у пациенток с HELLP-синдромом семикратно превышал норму, при этом не было выявлено значимых различий между уровнем АЛТ и АСТ, более того, выявлена прямая сильная связь АЛТ с АСТ (r=0,829). Также в этой группе было отмечено достоверное повышение билирубина в отличие от здоровых и пациенток с ПЭ, при том, что значения билирубина не выходили за референсные значения нормы.
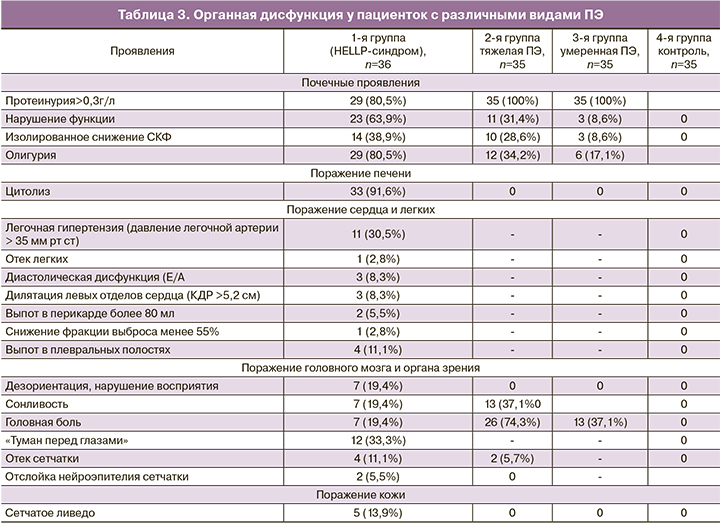
Анализ органного поражения при HELLP-синдроме выявил признаки вовлечения в патологический процесс не только печени и почек. Поражение кожи отмечались у 5 (13,9%) пациенток и было представлено сетчатым ливедо (у 2 пациенток ливедо имело генерализованный харктер), у 3 пациенток с минимальными значениями тромбоцитов отмечались множественные петехиальные высыпания и сливные гематомы на конечностях. Семь (19,4%) пациенток имели различные неврологические проявления, представленные в основном общемозговой симптоматикой: нарушение восприятия, ориентации в пространстве и во времени, сонливость, «туман» перед глазами. В группе ПЭ была только головная боль. В связи с жалобами на снижение зрения и «туман» перед глазами 12 (33,3%) пациенток с HELLP-синдромом были обследованы окулистом. У 4 пациенток по результатам офтальмоскопии был зафиксирован отек сетчатки, у 2 – с отслойкой нейроэпителия. Участкам отслойки соответствовали множественные микроскотомы по данным периметрии. Помимо артериальной гипертензии у 11 (30,5%) пациенток с HELLP-синдромом были выявлены признаки легочной гипертензии от минимальной до тяжелой степени, у 1 из которых развился клинически значимый отек легких, у 3 были выявлены признаки незначительной дилятации полостей сердца, у 2 – выпот в перикарде до 1 см толщиной, у 1 – снижение фракции выброса до 40% (табл. 3).
Обсуждение
Результаты нашего исследования позволяют предположить ошибочность концепции, согласно которой ПЭ последовательно прогрессирует по этапам «умеренная – тяжелая – HELLP-синдром». По-видимому, HELLP-синдром не является более тяжелым вариантом ПЭ, как считалось ранее. Вероятно, дисбаланс PlGF и sFlt-1, приводящий к ПЭ, служит всего лишь триггером для развития HELLP-синдрома. К такому выводу мы пришли на основании того, что соотношение sFlt1 и PlGF у пациенток с HELLP-синдромом оказалось почти в 2 раза ниже, чем у пациенток с тяжелой ПЭ, и в полтора раза ниже умеренной ПЭ. В попытке найти объяснение столь значимому различию мы изучили данные литературы. Известно, что ПЭ развивается вследствие нарушения формирования плаценты из-за дефекта поверхностной инвазии цитотрофобласта на самых ранних сроках гестации. Вследствие этого ишемизированная плацента продуцирует целый ряд антиангиогенных субстанций, основной из которых является sFlt-1, которые, связываясь с сосудисто-эндотелиальным и плацентарным (PLGF) факторами роста, приводят к протеинурии и артериальной гипертензии [5–8].
Анализ публикаций свидетельствует о достоверных различиях динамики концентрации PlGF, sFlt-1 и их соотношения в течение физиологической беременности и беременности, осложненной ПЭ. При этом именно изменения значений соотношения sFlt-1/PlGF наиболее ярко выражены, а не каждый отдельно взятый показатель. Принято считать, что показатель дисбаланса является наиболее информативным при диагностике ПЭ, а степень отклонения параметров коррелирует с тяжестью ПЭ [9–15]. Данные показатели доказали свою ценность как прогностические маркеры ПЭ, в то же время при нормально протекающей беременности верифицирован стабильно низкий уровень sFlt-1 вплоть до 33–36-й недели беременности с последующим нарастанием примерно на 145 пг/мл в неделю вплоть до родов. Именно поэтому считается, что высокая прогностическая значимость этого соотношения может быть только при развитии ПЭ до 34-й недели беременности. Кроме того, согласно последним исследованиям, только уровень sFlt-1/PlGF более 86,2 позволяет с чувствительностью 77,8% и специфичностью 80,0% считаться значимым маркером ПЭ [13]. В наше исследование вошли 2 пациентки с HELLP-синдромом с дебютом болезни до 34 недель беременности, у которых соотношение sFlt-1/PlGF находилось в пределах референсных значений нормы, и 4 пациентки с соотношением менее 86,2. Таким образом, представление о том, что HELLP-синдром является осложнением тяжелой ПЭ, не подтверждается результатами нашего исследования. В то же время исследований sFlt-1/PlGF только при HELLP-синдроме не проводилось.
Другой отличительной особенностью HELLP-синдрома в нашем исследовании оказалась высокая частота нарушения функции почек, которое было зарегистрировано у 63,9% пациенток, при этом оно проявлялось не только изолированным снижением скорости клубочковой фильтрации при нормальном уровне креатинина в крови, как в группе с умеренной, так и в группе с тяжелой ПЭ. Средние значения креатинина составили 110,80±20,62, что значимо выше показателей азотемии при ПЭ. Следует отметить, что изолированное снижение скорости клубочковой фильтрации является первым проявлением почечной недостаточности у больных с ТМА и впервые было описано у больных с АФС-ассоциированной нефропатией. При этом азотемия может «запаздывать» в дебюте болезни, тогда как при манифестации развернутой картины ТМА уже появляется повышение креатинина [16, 17].
При ПЭ изолированное снижение скорости клубочковой фильтрации развивается вследствие уменьшения фенестрации эндотелиальных клеток клубочков, которая в норме происходит под воздействием вырабатываемого подоцитами сосудисто-эндотелиального фактора роста [18]. Результаты нашего исследования могут рассматриваться как косвенные признаки того, что HELLP-синдром принадлежит к клинически манифестным вариантам ТМА. Дополнительным подтверждением этого служит выявление прямой сильной корреляция уровня ЛДГ с уровнем креатинина. Интересно, что наиболее выраженное нарушение функции почек зарегистрировано у пациенток, у которых отмечена прогрессия признаков ТМА после родоразрешения. Так, выраженность почечной недостаточности у 2 пациенток потребовала выполнения нескольких сеансов заместительной почечной терапии, у них зарегистрированы минимальные показатели скорости клубочковой фильтрации (13–26 мл/мин), у одной из них протеинурия достигла нефротического уровня. При этом эти 2 пациентки имели клинические признаки «чистой» ПЭ до родоразрешения, еще до родов у них была отмечена олигурия и снижение скорости клубочковой фильтрации при нормальных значениях креатинина. Эти данные позволяют предполагать, что ПЭ при беременности может стать основным «триггером» для развития HELLP-синдрома.
Также интересно выявленное нами повышение общего уровня билирубина при сравнении с пациентками с ПЭ и здоровыми беременными женщинами. На этот же феномен обратили внимание наши турецкие коллеги, изучив течение HELLP-синдрома у 171 беременной. Они даже выделили повышение билирубина наравне с повышением ЛДГ более 1200 и тромбоцитопенией менее 50 тыс. в мкл как прогностически неблагоприятный маркер для матери [19]. По-видимому, микроангиопатический гемолиз все же сопровождается повышением билирубина, однако степень выраженности гипербилирубинемии минимальна и не может быть основным диагностическим маркером микроангиопатического гемолиза.
Анализ органной дисфункции выявил разнообразие неврологической и офтальмологической симптоматики, причем клинически поражение головного мозга не было представлено нарушением мозгового кровообращения. На первый план выходила общемозговая симптоматика. Данные проявления считаются высокоспецифичными для ТМА. Так, при синдроме Снеддона – варианте медленно прогрессирующей ТМА с преимущественным поражением головного мозга описан так называемый первично-прогрессирующий вариант течения, при котором происходит постепенное нарастание признаков хронической недостаточности кровоснабжения головного мозга, развиваются симптомы энцефалопатии и когнитивных нарушений в отсутствие четкой клинической картины нарушений мозгового кровообращения. И только при проведении нейровизуализационных методов исследования можно выявить очаги ишемического генеза, что свидетельствует о клинически асимптомном или малосимптомном развитии поражения головного мозга [20]. Очаговая симптоматика при ТМА с поражением головного мозга нестойкая, в 80% случаев отмечается полное восстановление двигательных функций, что, очевидно, связано с развитием нарушений мозгового кровообращения в бассейнах небольших по диаметру артерий и их локализацией вне «двигательных» структур головного мозга [20]. Наиболее частым неврологическим проявлением HELLP-синдрома была головная боль, такие же симптомы характерны и для всех видов ТМА: головная боль мигренеподобного характера, эпилептические припадки, реже – хорея и периферическая невропатия. Сосуды глаз являются такой же мишенью тромбообразования при ТМА, как и сосуды почек, головного мозга, сердца или печени. Глазные проявления HELLP-синдрома могут быть также обусловлены ишемическим поражением затылочной коры, то есть глазные жалобы могут возникать при поражении коркового отдела зрительного анализатора в отсутствие прямых признаков поражения органа зрения. Так, например, в литературе есть данные о развитии нарушения цветового восприятия у пациентки с HELLP-синдромом вследствие развития задней обратимой энцефалопатии. Это проявление было первым симптомом болезни, предшествующее клинической манифестации HELLP-синдрома [21–24]. По аналогии с более изученными глазными проявлениями АФС, поражение микроциркуляторного русла органа зрения может проявляться изолированным ишемическим отеком сетчатки, в ряде случаев приводящем к нейропатии [25–28]. И тогда могут регистрироваться множественные отслойки сетчатки и соответствующие им микроскотомы, как и было выявлено в нашем исследовании. Поражение органа зрения может быть одним из первых клинических проявлений HELLP-синдрома, в то же время до трети пациентов могут не иметь глазных симптомов.
Поражение сердца было отмечено у 30,5% пациенток. Острая левожелудочковая недостаточность, впервые описанная еще в 1925 г. Э. Мошковицем при очерчивании симптомов фатальной тромботической тромбоцитопенической пурпуры, и в настоящее время рассматривается как неблагоприятный прогностический признак любых ТМА [29].
При этом поражение крупных коронарных сосудов регистрируется довольно редко, а субстратом острой сердечной недостаточности являются тромбы микроциркуляторного русла миокарда. При HELLP-синдроме кардиальная симптоматика часто не имеет симптомов, вследствие чего остается недиагностированной. Интересно, что по данным исследования 49 пациентов с HELLP-синдромом у 21,7% было выявлено изолированное снижение фракции выброса [30]. Также в литературе имеются описания нарушения ритма сердца, которое также может появляться еще до манифестации развернутого HELLP-синдрома [31].
Таким образом, органная дисфункция, регистрируемая в группе пациентов с HELLP-синдромом, с одной стороны свидетельствует о тяжести течения болезни при сравнении даже с тяжелой ПЭ, с другой – может рассматриваться как еще один косвенный признак того, что HELLP-синдром является ТМА. Кроме этого, НELLP-синдром в нашем исследовании сопровождался более высокими показателями Д-димера, что сложно трактовать однозначно, учитывая низкую чувствительность и специфичность этого показателя у беременных женщин [32]. Однако выраженность тромбинемии независимо от сроков ее развития сопровождалась худшими показателями АД, протеинурии и функции почек. Корреляция тромбинемии и функции почек позволяет выделить ее как дополнительный фактор прогрессии эндотелиального повреждения.
Выявленные факторы риска развития HELLP-синдрома, такие как системная красная волчанка и аллотрансплантация почки, подтверждают данные литературы. Так, в исследовании Jakobsen и соавт. (2015), изучавшем течение беременности у пациенток с системной красной волчанкой, HELLP-синдром был выявлен у 4,8% пациентов. Следовательно, если в популяции частота HELLP-синдрома не превышает 0,8–1%, то наличие системной красной волчанки увеличивает риск его развития в 4–6 раз [33].
Частота развития HELLP-синдрома у пациентов после органной трансплантации не изучалась. Имеются только единичные клинические описания или указания на развитие HELLP-синдрома у этих пациентов с последующим переходом в генерализованную ТМА – акушерский аГУС [34, 35]. Имеются и описания того, что люди, перенесшие HELLP-синдром, не должны быть донорами в связи с высокой частотой прогрессии ТМА у реципиента после трансплантации [36]. Известно, что иммуносупрессивная терапия может быть причиной для развития лекарственной ТМА. Однако в наших случаях концентрации циклоспорина и такролимуса строго мониторировались, у пациенток развивался HELLP-синдром с быстрым восстановлением после родоразрешения в отсутствие коррекции иммуносупрессивной терапии, что не типично для лекарственной ТМА [37–39].
Наличие АФС является грозным фактором риска развития HELLP-синдрома даже при адекватной антикоагуляции в течение всей беременности. По данным литературы, частота HELLP-синдрома у больных с критериальным диагнозом АФС достигает 3%, что в 3–4 раза выше, чем в популяции, тогда как частота ПЭ достигает 16,4% [40]. АФС может приводить к манифестации заболевания ранее, описан дебют HELLP-синдрома в 17 недель беременности. Включенная нами в исследование пациентка с первичным АФС развила HELLP-синдром на сроке 19 недель беременности. Манифестация ТМА при АФС рассматривается как фактор риска по развитию катастрофического АФС, поэтому подходы к ведению таких пациентов должны отличаться [41, 42].
Таким образом, наличие системной красной волчанки, АФС (первичного или вторичного) и посттрансплантационной ТМА являются независимыми факторами риска развития именно HELLP-синдрома, а не «чистой» ПЭ.
Заключение
Полученные нами результаты позволяют предполагать, что HELLP-синдром не является более тяжелым вариантом ПЭ. HELLP-синдром – это тяжелое системное заболевание, клинически манифестная ТМА, проявляющаяся поражением целого ряда органов и систем вследствие генерализованного эндотелиального поражения. По-видимому, ПЭ является всего лишь триггером для развития HELLP-синдрома, он только запускается дисбалансом между про- и антиангиогенными плацентарными факторами. HELLP-синдром следует рассматривать, скорее как отдельное от ПЭ состояние, клинические проявления которого хотя и сходны с симптомами ПЭ, однако более тяжелы. Правомерность такого предположения обоснована полученными недавно сведениями о том, что наиболее часто акушерский аГУС дебютирует после HELLP-синдрома, что позволяет рассматривать эти два заболевания как разные стадии одной и той же болезни: комплемент-опосредованной ТМА [4]. Для развития HELLP-синдрома необходимо сочетание дисбаланса sFlt-1/PLGF с дополнительными факторами риска эндотелиального повреждения (кровотечение, преждевременная отслойка нормально расположенной плаценты и др.), что еще раз доказывает универсальность теории «двойного удара» для любых вариантов ТМА.



