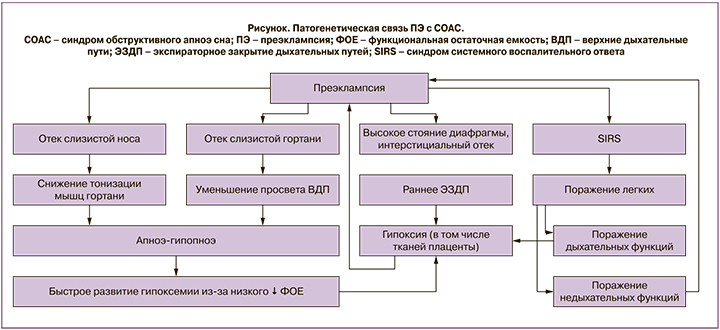
По данным Росстата, в структуре материнской смертности смертность от гипертензивных расстройств (ГР) во время беременности, родов и послеродового периода в 2016 г. составила 12% и заняла 4-е место среди всех причин [1]. За последние 10 лет на территории Российской Федерации нельзя не отметить явную тенденцию к снижению как материнской смертности в целом (370 человек в 2005 г., 188 – в 2016 г.), так и смертности от ГР (47 человек в 2005 г., 22 – в 2016 г.). Это стало возможным благодаря экономическим успехам, улучшению оснащения больниц, а также появлению фундаментальных знаний об этиопатогенезе преэклампсии (ПЭ). Дальнейшее же улучшение показателей будет невозможно без продолжения изучения причин и механизмов развития ПЭ, а также возможности влиять на выявленные новые патогенетические процессы. К сожалению, ГР влияют не только на материнские, но и на неонатальные исходы. Смертность и неонатальные осложнения у детей, родившихся от пациенток с ГР, выше [2, 3]. Также достоверно известно, что выживаемость новорожденных напрямую зависит от срока гестации [4]. В то же время единственным этиологическим лечением ПЭ остается родоразрешение [5]. Таким образом, учитывая последнее, при развитии ранней преэклампсии (РПЭ) всегда возникает вопрос о балансировке между здоровьем матери и ребенка, так как неонатальные выживаемость и осложнения зависят от срока гестации, и в то же время лучшим лечением матери будет родоразрешение. Поэтому одной из рекомендаций ISSHP для РПЭ от 2018 г. является пролонгирование беременности до 37 недель или до тех пор, пока позволяет состояние матери [6]. Таким образом, современные социальные требования диктуют необходимость поиска научным медицинским сообществом новых механизмов влияния на течение ПЭ с целью пролонгирования беременности для улучшения неонатальных исходов. На наш взгляд, одним из таких механизмов может быть синдром обструктивного апноэ сна (СОАС) [7]. Патогенетическая связь ПЭ с СОАС представлена на рисунке [7].
Также стоит отметить, что у пациентов с СОАС и РПЭ имеет место схожая суточная вариабельность артериального давления (АД); они являются «нондипперами» и/или «найтпикерами», то есть в течение ночи АД у них, как положено в норме, не снижается и даже имеется его повышение, что связано с ночной гипоксемией [8, 9]. Исходя из вышеописанного, представляем вниманию клинический случай применения режима искусственной вентиляции легких постоянным положительным давлением (СPAP-терапии) пациентке с РПЭ и СОАС с целью пролонгирования беременности, так как основным лечением СОАС является именно CPAP-терапия [10].
Клиническое наблюдение
Пациентка Д., 38 лет, поступила в НМИЦ АГиП им В.И. Кулакова (Центр) 20.03.18 г. с диагнозом: «Беременность 30 недель 3 дня, экстракорпоральное оплодотворение (ЭКО). Донация спермы. Головное предлежание. ПЭ на фоне хронической артериальной гипертензии (АГ). Синдром задержки роста плода 1–2 степени. Туннельная нейропатия верхних конечностей, синдром запястных каналов с двух сторон. Первородящая, 38 лет».
Из анамнеза известно, что АГ впервые выявлена в 2016 г., по поводу чего периодически принимала Каптоприл. Со слов, АД до беременности повышалось максимум до 150 и 90 мм рт. ст. Настоящая беременность наступила в результате ЭКО. В I триместре был токсикоз легкой степени (тошнота). До 20-й недели беременности антигипертензивной терапии не получала, однако с 20-й недели начали отмечаться эпизоды повышения АД до 150 и 90 мм рт. ст., в связи с чем назначен препарат Метилдопа по 250 мг 3 раза в сутки. В 26 недель проведена профилактика респираторного дистресс-синдрома плода, в 29 недель – повторный курс. При дообследовании в Центре была выявлена задержка роста плода (ЗРП) на 3 недели.
Вес на момент поступления 92 кг, рост 172 см. Индекс массы тела (ИМТ) 31,1 кг/м2, вес до беременности составлял 83 кг, соответственно ИМТ – 28,06 кг/м2. Таким образом, у пациентки уже до беременности имелась избыточная масса тела, которая является главным фактором риска развития СОАС.
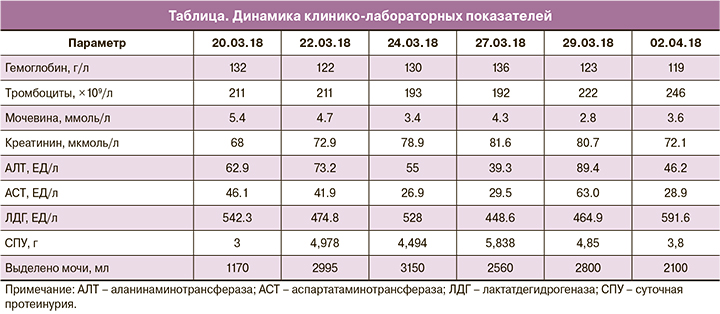
Учитывая тяжелую гипертензию до 165 и 102 мм рт.ст., 22.03.18 в отделении патологии беременных введена нагрузочная доза сернокислой магнезии, и пациентка была переведена в отделение анестезиологии и реанимации. Анализы при поступлении: гемоглобин 132 г/л, тромбоциты 211×109/л, креатинин 68 мкмоль/л, мочевина 5,4 ммоль/л, АЛТ 62,9 ЕД/л, АСТ 46,1 ЕД/л, ЛДГ 542,3 ЕД/л, протеинурия 3 г/л, маркеры преэклампсии: plgf 50,06 пг/мл, sflt 129914 пг/мг, plgf/sflt более 597,56. Начата терапия: магнезия 25% внутривенно 4 мл/ч, Метилдопа по 500 мг 4 раза в сутки, ретардная форма Нифедипина по 40 мг 2 раза в сутки. Принимая во внимание недоношенный срок, беременность решено было пролонгировать.
Со слов, ранее близкие пациентки на ее храп никогда не жаловались, однако со II триместра беременности муж стал периодически сообщать, что жена начала храпеть, помимо этого, женщина отмечала постоянную дневную сонливость со второй половины беременности. В связи с этим, а также учитывая ИМТ, пациентке для скрининга СОАС решено было провести респираторную полиграфию и компьютерную пульсоксиметрию в течение ночи (с 22.03 на 23.03.18 г.). Индекс апноэ-гипопноэ составил 17,5, что соответствует средней степени тяжести СОАС, самое долгое апноэ продолжалось около полутора минут, в течение которого отмечались десатурация до 76% и брадикардия до 45 в минуту. Поэтому со второй ночи нахождения в отделении анестезиологии и реанимации (с 23.03.18) и до родоразрешения (29.03.18) пациентка с 22:00 до 6:00 получала СPAP-терапию. Использовали аппарат, умеющий работать в режиме autoCPAP. Параметры неинвазивной респираторной поддержки были следующими: первые 10 мин положительное давление в конце вдоха (ПДКВ) – 5 см H2O, далее – терапевтическое окно ПДКВ от 7 до 12 см H2O; в начале выдоха снижение ПДКВ на 2 см H2O; аппарат подавал увлажненный подогретый атмосферный воздух без дополнительной донации кислорода (FiO2 21%); использовали ороназальную герметичную маску. При анализе параметров вентиляции выяснилось, что большую часть времени аппарат искусственной вентиляции легких (ИВЛ) поддерживал ПДКВ на уровне от 8 до 10 см H2O.
Учитывая плохо развитую периферическую венозную систему, а также необходимость постоянного введения сернокислой магнезии и контроль анализов, была катетеризирована внутренняя яремная вена справа, в связи с чем появилась возможность адекватного контроля газового состава крови. Кислотно-щелочной состав и газы артериальной (из a. radialis) и центральной венозной крови брались ежедневно в 22:00 и в 6:00, т.е до начала и после окончания CPAP-терапии. К утру отмечалась тенденция к снижению лактатемии, а также увеличение артерио-венозной разницы по кислороду, в большей степени за счет снижения содержания кислорода в венозной крови. Тенденции этих показателей говорили о том, что у пациентки удавалось в течение ночи улучшить тканевую оксигенацию. На наш взгляд, происходило это благодаря двум механизмам. Первый – предотвращение раннего экспираторного закрытия дыхательных путей и, как следствие, предотвращение шунтирования крови и развития гипоксемии. А второй механизм связан с доказанным влиянием гипоксии на выброс эндогенных катехоламинов у пациентов с СОАС [11]. Учитывая, что гипоксемия во время CPAP-терапии не наблюдалась, это позволило предотвратить секрецию симпатомиметиков в кровь и спазм артериол и, как следствие, улучшить периферическое кровоснабжение и тканевую оксигенацию.
Динамика клинико-лабораторных показателей представлена в таблице.
Стоит отметить, что состояние пациентки в течение пролонгирования беременности не потребовало усиления антигипертензивной терапии, в течение 7 дней она не менялась. Также у пациентки в течение ночи не отмечалось повышения АД, характерного для пациенток с ПЭ и/или СОАС. Таким образом, состояние матери позволяло пролонгировать беременность дальше, однако в связи с отсутствием роста плода, а также с ухудшением показателей маточно-плацентарного и фето-плацентарного кровотоков 29.03.18 женщину решено было родоразрешить путем операции кесарева сечения.
Родилась девочка, 6,7 балла по шкале Апгар, масса 1140 г, рост 38 см. В операционном блоке проводили продленный вдох, СРАР через маску, затем через назофаренгиальную трубку. На 15-й минуте жизни методом LISA был введен Kуросурф. На неинвазивной ИВЛ ребенок был переведен в отделение реанимации новорожденных. Диагноз: «Острый респираторный дистресс-синдром новорожденных. Неонатальная пневмония. Гипербилирубинемия новорожденных». Проводилась респираторная терапия Biphasic в течение 41 ч. На 2-е сутки жизни получала Кофеин с целью стимуляции дыхательного центра. С 6-х суток жизни ребенок находился на самостоятельном дыхании. Самостоятельное питание с 5-х суток. Антибиотикотерапия в течение 15 дней. На 13-е сутки переведена в отделение патологии новорожденных. На 41-е сутки с массой тела 1818 г выписана с диагнозом «Малый размер к сроку гестации».
Родильница наблюдалась в отделении анестезиологии и реанимации 1 сутки после родоразрешения с применением CPAP-терапии в ночное время, после чего была переведена в послеродовое отделение. Выписана 09.04.18 г. в удовлетворительном состоянии и со стабильными клинико-лабораторными показателями.
Заключение
Физиологически протекающая беременность сама по себе увеличивает риски развития СОАС. В то же время СОАС и ПЭ утяжеляют течение друг друга, и, как правило, при попадании таких женщин в поле зрения клиницистов уже поздно понять, что было первично. Однако, влияя на течение СОАС, мы, безусловно, влияем на течение ПЭ.
Таким образом, специалистам, работающим с беременными, необходимо знать о такой распространенной патологии, как СОАС, и быть настороженными в отношении пациенток, имеющих характерные жалобы и высокий ИМТ. В случае необходимости следует вовремя проводить скрининг СОАС и начинать соответствующую терапию.



