В настоящее время при выполнении программ вспомогательных репродуктивных технологий (ВРТ) в 20–25% случаев приходится использовать ооциты донора (программа ЭКО-ОД) из-за невозможности получения собственных женских гамет. Основная причина использования ЭКО-ОД связана с лечением бесплодия у пациенток старшего репродуктивного возраста, у которых имеет место физиологическое угасание функции яичников [1]. Кроме того, ЭКО-ОД назначают пациенткам с ятрогенно спровоцированной редукцией овариального резерва (тотального удаления яичников, субтотальной резекции яичников), а также женщинам с признаками преждевременного истощения яичников, синдромом резистентных яичников, пациенткам с дисгенезией гонад [2]. Также приходится использовать ЭКО-ОД в ситуациях, связанных с подтвержденной неспособностью к оплодотворению собственных ооцитов пациентки. Перечисленные показания к назначению ЭКО-ОД позволяют констатировать, что этот вариант ЭКО оказывается весьма востребованным в клинической практике. Причем можно уверенно прогнозировать, что доля использования именно ЭКО-ОД среди всех существующих программ ЭКО будет только возрастать, что прежде всего объясняется продолжающимся увеличением частоты женщин старшего репродуктивного возраста среди пациенток с бесплодием.
До недавнего времени при выполнении ЭКО-ОД использовали только нативные эмбрионы, получаемые из нативных ооцитов донора. В последующем благодаря успехам криоконсервационных технологий сначала появилась возможность отсроченного применения размороженных криоконсервированных эмбрионов, получаемых из свежевыделенных донорских ооцитов, а затем и эмбрионов, полученных из размороженных исходно витрифицированных ооцитов донора [3–5]. С учетом существования трех перечисленных «конкурирующих» вариантов ЭКО-ОД (с использованием нативных эмбрионов, размороженных эмбрионов из нативных ооцитов и эмбрионов из предварительно витрифицированных ооцитов), предназначенных для применения в одних и тех же клинических ситуациях, представляется актуальным сравнительная оценка клинических исходов этих программ для обоснования приоритета к выбору наиболее эффективной из них.
Цель исследования – проанализировать лабораторные и клинические исходы ЭКО-ОД с эмбрионами из витрифицированных донорских ооцитов и сопоставить их с результатами программ ЭКО-ОД со свежими и размороженными эмбрионами, полученными из нативных ооцитов донора.
Материал и методы исследования
В соответствии с целью исследования были проанализированы лабораторные и клинические результаты 29 циклов ЭКО-ОД с использованием эмбрионов из витрифицированных ооцитов. Подвергавшиеся криоконсервации ооциты были получены от доноров ооцитов, которые были обследованы согласно Приказу Минздрава России №107н от 30 августа 2013 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению».
Клинические исходы программы ЭКО-ОД с витрифицированными ооцитами сопоставляли с данными, зарегистрированными в 115 циклах с переносом нативных эмбрионов и в 56 циклах с переносом размороженных эмбрионов, полученных из нативных донорских ооцитов. Эффективность лечения оценивали по частоте наступления беременности (общей и развивающейся) на перенос эмбрионов (ПЭ) (ЧНБПЭ), частоте имплантации, частоте многоплодия и частоте ранних (в I триместре) репродуктивных потерь.
Предназначавшиеся для криоконсервации ооциты освобождали от клеток cumulus oophorus с помощью фермента гиалуронидазы. Далее по морфологическим критериям оценивали качество и степень зрелости женских гамет [6, 7]. Витрификации подвергали ооциты, пребывающие в своем развитии на стадии М-II и имеющие нормальную морфологию, то есть без признаков дегенерации.
Ооциты размораживали и культивировали в течение 4 часов до оплодотворения [8, 9].
Размороженные ооциты оплодотворяли методом ИКСИ. Полученные свежие ооциты, предназначенные для использования в программах ЭКО-ОД с нативными и с размороженными эмбрионами, оплодотворяли путем обычной инсеминации. Во всех случаях использовали биоматериал мужей пациенток-реципиентов, не имеющий каких-либо количественных и качественных отклонений, то есть с нормозооспермией.
Подготовку эндометрия к ПЭ во всех случаях проводили в не стимулированных циклах. Конкретная методология подготовки реципиента определялась, во-первых, особенностями получения переносимых эмбрионов (нативные, размороженные или полученные из витрифицированных ооцитов) и состоянием овуляторной функции (аменорея или сохранный овуляторный цикл).
В программах ЭКО-ОД с переносом размороженных эмбрионов, полученных из нативных ооцитов и эмбрионов из размороженных витрифицированных ооцитов у пациенток-реципиентов проводилась подготовка эндометрия с использованием монотерапии эстрадиолом (прогинова перорально в дозе от 4 до 12 мг/сут.). При достижении эндометрием толщины 8 мм и более по данным ультразвукового исследования (УЗИ) для трансформации эндометрия добавляли препараты прогестерона, сохраняя прежнюю дозировку используемых эстрогенов. ПЭ выполняли на 6-й день после назначения препарата прогестерона. На 14-й день после переноса эмбрионов оценивался уровень β-субъединицы хорионического гонадотропина человека. У пациенток с подтвержденной биохимической беременностью гормональную поддержку продолжали до клинического (по данным УЗИ) подтверждения беременности (21–28-й день после ПЭ), а затем – до 10–12-й недели беременности.
В программе ЭКО-ОД с нативными эмбрионами на 1-м этапе проводилась синхронизация циклов донор-реципиент, после чего аналогичная подготовка эндометрия женщины-реципиента.
Качество переносимых эмбрионов на 5-е сутки культивирования оценивали по критериям, предложенным D. Gardner [10].
Стимуляцию яичников у женщин-доноров выполняли либо с использованием длинного протокола down-регуляции с назначением агониста гонадотропин-рилизинг гормона с 21-го дня предшествующего цикла, либо с применением короткого протокола с антагонистом гонадотропин-рилизинг гормона, назначаемым в при достижении лидирующим фолликулом диаметра 14 мм. При достижении лидирующим фолликулом диаметра 18–20 мм вводили триггер овуляции – 5–10 тысяч МЕ человеческого хорионического гонадотропина и через 34–36 часов выполняли трансвагинальную пункцию всех фолликулов диаметром более 15 мм. Выделение ооцитов, их инсеминацию, культивирование и перенос эмбрионов выполняли в соответствии с существующими стандартными рекомендациями [2, 11].
Полученные результаты обрабатывали с использованием методов описательной статистики, представленных в программе Statistica 6.0. При парных сравнениях выявленные различия между сопоставляемыми группами расценивали как статистически значимые при уровне значимости не менее 95% (р<0,05)
Результаты исследования
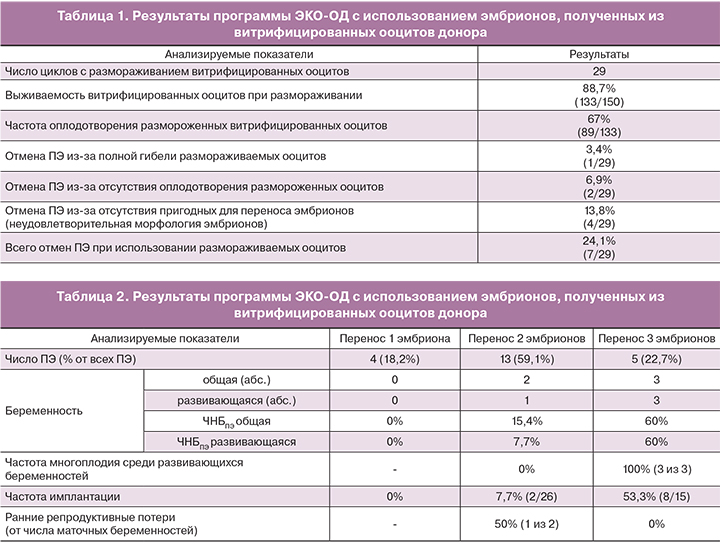
При оценке результатов программы ЭКО-ОД с эмбрионами, полученных из витрифицированных ооцитов, было установлено (табл. 1), что выживаемость размораживаемых криоконсервированных ооцитов составляла 88,7% (133 из 150), а частота их оплодотворения – 67% (89 из 133).
В 7 из 29 циклов с размораживанием витрифицированных ооцитов ПЭ выполнить не удалось. Наиболее часто причиной отмены ПЭ (в 4 из 7 случаев) была неудовлетворительная морфология полученных эмбрионов. Также имели место случаи полного лизиса размораживаемых эмбрионов (3,4%) и полного отсутствия оплодотворения ооцитов (6,9%), что в совокупности со случаями отсутствия пригодных для переноса эмбрионов по морфологическим критериям (13,8%) доводило частоту отмены ПЭ при выполнении ЭКО-ОД с витрифицированными ооцитами до 24,1%.
Анализ клинических исходов программы ЭКО-ОД с витрифицированными ооцитами показал (табл. 2), что результаты лечения в определяющей степени зависят от того, сколько именно переносится эмбрионов. По нашим наблюдениям, в этой программе перенос единственного эмбриона ни разу не привел к возникновению клинически подтвержденной беременности. Перенос двух эмбрионов обеспечил наступление беременности лишь в 2 из 13 случаев (ЧНБПЭ = 15,4%, частота имплантации =7,7%), однако лишь одна из них оказалась развивающейся, то есть частота ранних репродуктивных потерь составила 50%.
Перенос трех эмбрионов сопровождался наступлением беременности в 3 из 5 случаев (ЧНБПЭ =60%, частота имплантации =53,3%), причем все три индуцированные беременности оказались многоплодными (две тройни и одна двойня) и развивающимися (частота ранних репродуктивных потерь =0).
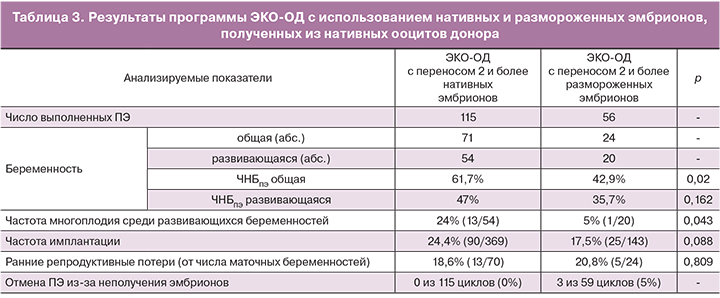
При оценке клинических результатов вариантов ЭКО-ОД, являющихся альтернативой программе с витрифицированными ооцитами, были установлены следующие факты (табл. 3).
В программах ЭКО-ОД с переносом двух и более свежих или размороженных эмбрионов, полученных из нативных ооцитов, ЧНБПЭ общая составляла соответственно 61,7 и 42,9%, ЧНБПЭ развивающаяся – 47 и 35,7%, частота многоплодия – 24 и 5%, частота имплантации – 24,4 и 17,5%, частота ранних репродуктивных потерь – 18,6 и 20,8% соответственно.
Заслуживает внимания, что в программе ЭКО-ОД с нативными эмбрионами нам ни разу не пришлось отменять ПЭ из-за отсутствия оплодотворения полученных свежих ооцитов или неполучения морфологически пригодных для переноса эмбрионов. В программе ЭКО-ОД с криоконсервированными эмбрионами перенос размороженных эмбрионов был отменен в 3 из 59 циклов (5%) из-за последствий криотравмы (полного лизиса или появления морфологических дефектов при размораживании). Из этого наблюдения следует, что по критерию частоты отмен ПЭ из-за неполучения эмбрионов с удовлетворительными морфологическими характеристиками, программа ЭКО с витрифицрованными ооцитами сопровождается гораздо более низкими результатами (24,1% отмен ПЭ), чем «конкурирующие» с ней программы ЭКО-ОД с нативными и размороженными эмбрионами, получаемыми из нативных ооцитов (соответственно 0% и 5% отмен ПЭ).
Обсуждение
Анализ полученных результатов позволяет отметить, что программа ЭКО-ОД с витрифицированными ооцитами по важнейшим показателям клинической эффективности серьезно уступает своим конкурентам, то есть программам ЭКО-ОД с размороженными и с нативными эмбрионами, получаемыми из свежих ооцитов.
Прежде всего обращает внимание, что до 1/4 всех циклов с размораживанием витрифицированных ооцитов так и не закончились ПЭ, что в основном было связано с неудовлетворительной морфологией полученных эмбрионов, а также с полной гибелью ооцитов при размораживании или их неспособностью к оплодотворению после размораживании.
В программе ЭКО-ОД с размороженными эмбрионами частота отмен ПЭ из-за неполучения пригодных для переноса эмбрионов не превышала 5%, а в программе ЭКО с нативными эмбрионами оказалась равной нулю. Из этого наблюдения следует, что для обеспечения сопоставимой частоты наступления беременности в случаях использования ЭКО-ОД с витрифицированными ооцитами потребуется минимум на 25% больше попыток, чем при выполнении описываемых конкурирующих программ ЭКО-ОД. На практике для многих пациенток это неизбежно будет приводить к удорожанию лечения, так как, учащение отмен ПЭ означает возрастание потребности в повторных попытках ЭКО. Кроме того, программа ЭКО-ОД с витрифицированными ооцитами оказывается более дорогостоящей еще и из-за того, что при ее выполнении для оплодотворения размороженных женских гамет всегда приходится использовать технологию ИКСИ. В отличие от этого, в программах ЭКО с нативными эмбрионами и размороженными криоконсервированными эмбрионами для оплодотворения нативных ооцитов при отсутствии сопутствующего мужского фактора вполне пригодна менее дорогая методика стандартной инсеминации спермой.
Оценка клинических исходов сопоставлявшихся программ ЭКО-ОД указывает на то, что наименее эффективной была программа с использованием эмбрионов, полученных из витрифицированных ооцитов. Приходится констатировать, что в этой программе высокий показатель развивающейся ЧНБ на ПЭ (60%) регистрировался лишь при переносе большего количества эмбрионов, а перенос одного эмбриона не обеспечил наступления беременности ни в одном случае.
Также обращает на себя внимание, что при переносе трех эмбрионов в программе ЭКО-ОД с витрифицированными ооцитами частота многоплодия оказывалась существенно выше (достигая фактически 100%) в сравнении с программами ЭКО-ОД с нативными эмбрионами (24%) и размороженными эмбрионами (5%) (полученными из нативных ооцитов), в которых переносили не менее двух эмбрионов. Из этого наблюдения следует, что сама по себе программа ЭКО-ОД с витрифицированными ооцитами характеризуется парадоксальной несбалансированностью зависимости ЧНБ от числа переносимых эмбрионов. Суть этой несбалансированности состоит в том, что при переносе 2 эмбрионов, то есть числа, считающегося оптимальным для выдерживания более или менее приемлемого соотношения между вероятностью наступления беременности (не менее 30–40% на ПЭ) и частотой многоплодия (не более 20% от развивающихся беременностей), применение программы ЭКО-ОД с витрифицированными ооцитами сопровождается низкой ЧНБ.
А выполнение в этой программе переноса трех эмбрионов, улучшая показатель ЧНБ, влечет за собой резкий рост частоты многоплодия, превышающий таковой в любых других программах ЭКО.
В основе этого может лежать принцип криотолерантности ооцитов к методу витрификации, который до настоящего времени недостаточно изучен.
Суммируя представленный материал, можно констатировать, что по совокупности параметров, характеризующих клинические исходы сравнивавшихся программ ЭКО-ОД, наилучшими и примерно одинаковыми оказались варианты с использованием свежих и размороженных эмбрионов, полученных из нативных ооцитов. В свою очередь, применение эмбрионов, полученных из предварительно витрифицированных ооцитов оказалось менее эффективным.
По нашему мнению, витрификация ооцитов должна использоваться у доноров в программах ЭКО-ОД, ооциты которых не обладают криотолерантностью к методу витрификации, либо применяться для сохранения репродуктивного потенциала у женщин с вполне нормальным (в период забора ооцитов) овариальным резервом. Показанием к использованию витрификации собственных ооцитов служит желание женщины сохранить свой генетический материал для отсроченного его использования.
Одним из основных показаний к витрификации ооцитов может быть угроза потери репродуктивной функции (перед проведением гонадотоксичной терапии, операций на яичниках), если у женщины нет полового партнера и одновременно нет желания сохранения эмбрионов, полученных из собственных ооцитов и донорской спермы.
Несомненно, методики витрификации, последующего размораживания и оплодотворения ооцитов является значительным достижением современной эмбриологии. Тем не менее, данные литературы и собственный опыт позволяют предостеречь от чрезмерной коммерциализации этого направления. Безусловными показаниями для процедуры витрификации ооцитов является сохранение собственных яйцеклеток пациентки перед токсичными и грозящими потерей репродуктивной функции яичников видами лечения. Тем не менее, желание женщины, обусловленное ее социальными установками, тоже может служить показанием для криоконсервации собственных ооцитов.
Специалисты должны максимально объективно доводить до сведения пациентки шансы наступления беременности после размораживания ооцитов и их оплодотворения.
Что касается программ ЭКО-ОД, то данные, полученные в нашем исследовании, также продемонстрировали приоритетность метода оплодотворения нативных ооцитов, переноса или криоконсервации полученных эмбрионов. При этом показана не только клиническая эффективность, но и экономическая целесообразность использования для оплодотворения нативных ооцитов, по сравнению с применением размороженных ооцитов доноров в программах ЭКО-ОД.
Выводы
- Клинические исходы программы ЭКО-ОД с применением эмбрионов, полученных из витрифицированных ооцитов, существенно уступают результатам программ ЭКО-ОД с нативными или размороженными эмбрионами, полученными из нативных ооцитов.
- Улучшение результатов лечения по показателю ЧНБ в программе ЭКО-ОД с витрифицированными ооцитами возможно лишь при увеличении числа переносимых эмбрионов, однако при этом возрастает риск многоплодия, который оказывается значительно большим, чем в альтернативных программах ЭКО-ОД с эмбрионами, полученными из свежих ооцитов.
- Исследование донора на криотолерантность ооцитов позволит улучшить ЧНБ у пациенток в программах ЭКО-ОД.
- Витрификация ооцитов позволит сохранить собственный репродуктивный материал женщин, планирующих беременность в более позднем возрасте.



