Хронический эндометрит (ХЭ) – распространенное заболевание, частота которого в популяции составляет 14,1–24,4% (по другим данным – 0,2–46% в зависимости от профиля пациентки и метода биопсии), при этом в структуре причин бесплодия ХЭ составляет 2,8–56,8%, рецидивирующих неудач имплантации (РНИ) при вспомогательных репродуктивных технологиях (ВРТ) – 7,7–67,5% [1–4].
Наступление беременности при ХЭ возможно, но нередко завершается самопроизвольными выкидышами (СПВ) в ранние сроки (40–62,4%) или преждевременными родами (ПР) (14,3–27%) [5, 6]. Даже при беременности, наступившей в результате ВРТ, риск неблагоприятных исходов сохраняется [6].
Исследования последних лет свидетельствуют о том, что нарушение репродуктивной функции при ХЭ обусловлено изменением рецептивности эндометрия, являющейся результатом провоспалительного состояния в эндометрии вследствие активации местной иммунной защиты, сопровождающейся секрецией цитокинов и хемокинов [7].
Этиология ХЭ связана с изменениями микробиоты влагалища с преобладанием условно-патогенных микроорганизмов (наиболее часто – стафилококков, стрептококков, эубактерий) и вирусов, восходящей инфекцией, воспалительными изменениями в последе и плацентарной недостаточностью [8].
В патогенезе репродуктивных нарушений при ХЭ играет роль эндометриальная дисфункция с такими патогномоничными признаками, как несоответствие строения эндометрия дню менструального цикла, снижение экспрессии рецепторов эстрогенов и прогестерона, патологическая активация неоангиогенеза, нарушение клеточного цикла [9]. Изменения в эндометрии приводят к нарушению имплантации, процесса инвазии трофобласта, формированию плаценты с дефицитным кровотоком, и, как следствие, – осложнениям беременности, что в сочетании с воспалительными изменениями в хорионе и плаценте ведет к ее досрочному завершению.
Антибактериальная (АБ) терапия ХЭ эффективна и способствует восстановлению фертильности с увеличением коэффициента живорождений в программах ВРТ при условии разрешения ХЭ (ОШ 6,82 – по сравнению с персистирующим ХЭ) [10, 11]. Однако разрешение ХЭ достигается после одного курса АБ-терапии только у 31,3% пациенток [12] и требует либо повторных курсов применения АБ, либо средств, дополняющих терапию АБ у пациенток, среди которых излечения добиться не удалось.
Повторный курс АБ-терапии позволяет вылечить еще 30% пациенток, а третий – 19% [12], однако об увеличении частоты беременностей/живорождений в данном исследовании не сообщается. Комплексное применение системного и внутриматочного введения АБ, позволяет добиться излечения у пациенток на 40% больше, однако без увеличения частоты беременностей/живорождений [13].
Попытки терапии иными средствами (без АБ-терапии) на основе концепции об аутоиммунной природе ХЭ оказались неэффективными, а сама теория – несостоятельной, поскольку было доказано, что пациентки с ХЭ не отличались ни по системным воспалительным, ни аутоиммунным профилям от пациенток без ХЭ [9, 14–16].
Наиболее эффективными дополнительными методами лечения ХЭ, способствующими наступлению беременности/живорождения при ВРТ, по данным нескольких систематических обзоров и метаанализов признаны внутриматочное введение богатой тромбоцитами плазмы [17], иммуномодулирующие средства [18], в том числе внутриматочное введение аутологичных мононуклеарных клеток периферической крови (МКПК), получаемых от пациенток перед ЭКО [19, 20]. Доказана эффективность локальной терапии экзогенными продуктами секреции МКПК, или секретóмная терапия, в виде лекарственного средства (ЛС), содержащего комплекс природных антимикробных пептидов и цитокинов, который получают из МКПК крови свиней (Суперлимф) [20–22].
В связи с этим представляет интерес изучение морфологических изменений эндометрия, хориона и плацент для понимания причин невынашивания и недонашивания беременности при ХЭ, а также особенности их строения после проведенного комплексного лечения с использованием препарата «Суперлимф» на прегравидарном этапе. Работ, посвященных изучению морфологии хориона и плацент при неудачном и благоприятном исходе беременности у пациенток с ХЭ в публикациях не найдено.
Понимание связи между гистологической структурой эндометрия, хориона/плаценты, клиническим течением и исходами беременности, наступившей у пациенток после лечения ХЭ, позволит уточнить патофизиологические процессы, происходящие при данной патологии, а также оптимизировать ведение женщин, что определяет актуальность настоящего исследования.
Цель: определить особенности морфологической структуры эндометрия, хориона и плаценты у пациенток с благоприятным и неблагоприятным исходом беременности, наступившей в результате ЭКО с криопереносом, после лечения хронического эндометрита в прегравидарном периоде с использованием комплекса природных антимикробных пептидов и цитокинов.
Материалы и методы
Дизайн. Вторичный анализ результатов исследования «Течение и исходы беременности, наступившей в результате экстракорпорального оплодотворения, у пациенток с хроническим эндометритом, получавших комплексное лечение с использованием препарата «Суперлимф» на прегравидарном этапе (рандомизированное контролируемое испытание «ТЮЛЬПАН 2» [23].
Материал. Использовали данные из электронной базы, созданной при обращении 600 пациенток в женскую консультацию ГБУЗ ТО «Перинатальный центр» (Тюмень, Россия) по поводу бесплодия с диагнозом хроническая воспалительная болезнь матки (N71.1) с сентября 2019 г. по июнь 2023 г. Диагноз подтвержден гистологически и иммуногистохимически, пациентки отвечали критериям включения/исключения, прошли лечение ХЭ и процедуру ЭКО (криоперенос) [23]. Пациентки были разделены на группы: I группа (n=300) – на прегравидарном этапе принимали антибиотик (АБ); гестаген во вторую фазу цикла; комплекс природных антимикробных пептидов и цитокинов (Суперлимф), II группа (n=300) – получали АБ/гестаген (контрольная). Прием гестагена продолжали до криопереноса (не более 6 месяцев).
Методы. Для гистологического исследования использовали материал: аспират эндометрия, полученный до и после лечения пациенток перед зачатием на 21–24-й день менструального цикла и ткани гестации после завершения беременности в сроках: при раннем выкидыше – до 116 недель (26 и 23 пациенток из I и II групп соответственно), позднем – 120–216 недель (8 и 12 соответственно), преждевременных родах – 220–366 недель (14 и 12 соответственно) и родах в срок – 370–416 недель (123 и 59 пациенток соответственно). Морфологическое строение эндометрия оценивали по критериям диагностики ХЭ [24, 25], плаценты – по классификации и критериям макро- и микроскопических характеристик плаценты [26].
Статистический анализ
Использовали программу SPSS v.27.0. Применяли критерий Колмогорова–Смирнова для оценки распределения признаков. При нормальном распределении количественные признаки выражали их в виде средних значений (М) и стандартного отклонения (SD), другие – в виде медианы (Ме) и межквартильного диапазона (Q1–Q3), качественные – абсолютными числами (n), а их доли – относительными величинами (%). Количественные показатели, отличные от нормального распределения, сравнивали с помощью U-критерия Манна–Уитни. Сравнение процентных долей выполняли с помощью критерия хи-квадрат Пирсона. Значимыми считали различия при р<0,05 и уровнях ошибки первого и второго рода α=5% и β=20% соответственно. Зависимость вмешательства и исхода определяли путем расчета относительного риска (ОР) с 95% доверительным интервалом (ДИ).
Результаты
Общие сведения о пациентках и исходы лечения. Возраст пациенток варьировал от 18 до 45 лет, Ме (Q1–Q3)=36 (33–38) лет. Большинство из них находились в возрасте 35 лет и старше – 87,4% (202/300) и 63,0% (189/300) в I и II группах соответственно, р=0,27. Социальная и клиническая характеристики пациенток представлены в статье [23]. Отличие пациенток между группами I и II было только по уровню образования, по остальным параметрам статистически значимые различия отсутствовали. Данные общего осмотра и соматического статуса в обеих группах были сопоставимы.
Продолжительность бесплодия в среднем составила 6,0 (4,5–7,0) и 5,5 (4,0–6,5) лет соответственно, р=0,06. Среди пациенток I группы прошли один курс лечения с использованием Суперлимфа 21 (7,0%), два – 142 (47,3%), три – 100 (33,3%) и 4 курса – 37 (12,3%) женщин.
Общая частота наступления беременности и ее исходы представлены в таблице 1.
Таким образом, подготовка эндометрия у пациенток с ХЭ в прегравидарном периоде с использованием комплекса «Суперлимф»/АБ/гестаген способствовала снижению риска СПВ в ранние сроки и ПР ранее 370 недель в 2 раза, а также осложнений беременности – в 2–3 раза у пациенток, забеременевших в результате ЭКО.
Результаты морфологического исследования
Морфологическое строение эндометрия у пациенток в прегравидарном периоде. Гистологическое исследование эндометрия проведено у всех пациенток (табл. 2).
Анализ таблицы 2 показал, что после лечения в I группе частота выявления склероза спиральных артерий была статистически значимо ниже по сравнению со II группой. Аналогичные результаты были получены и в отношении перигландулярного фиброза, частота которого снизилась в обеих группах, но была существенно ниже в I группе. При этом инфильтрация плазмоцитами отсутствовала у 80,7% против 49,3% пациенток соответственно (ОР=1,64, 95% ДИ: 1,44–1,86, р<0,001), что свидетельствует о преимуществе комплексного лечения и, таким образом, вероятность выявления ХЭ была в 1,6 раза ниже у женщин, получавших Суперлимф.
Морфологическое строение хориона у пациенток с самопроизвольным выкидышем в I триместре. СПВ в I триместре произошел у 26/171 (15,2%) и 33/116 (28,5%) пациенток соответственно. Результаты представлены в таблице 3. Гравидарная трансформация эндометрия в I группе была лучше, чем во II, промежуточный тип ворсин хориона встречался чаще, а дистрофические/склеротические изменения в нем с признаками инфицирования были реже.
Пролиферация хориального синцития в обеих группах не наблюдалась. Вместе с тем в обеих группах с одинаковой частотой определялись такие изменения как резкий отек ворсин, их гипо-/аваскуляризация с наличием ишемических инфарктов и массивных кровоизлияний, что, по-видимому, и явилось причиной СПВ в ранние сроки.
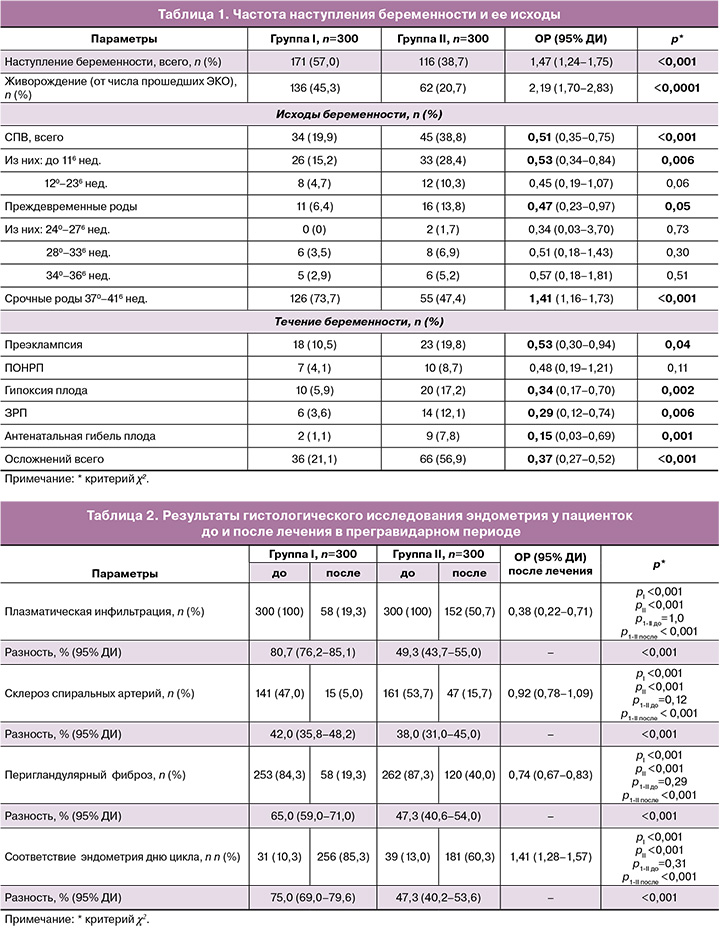
На рисунке 1 представлено гистологическое строение хориона при СПВ раннего срока.
На рисунке 1.1 представлен хорион, полученный в результате СПВ у пациентки при беременности 11 недель. Ворсины хориона промежуточного незрелого типа строения с гиповаскуляризацией, дистрофическими изменениями, межворсинчатым фибриноидом и относительным малокровием сосудистого русла. Малокровие интервиллезного пространства. Базальная пластинка с очаговой моноцитарной инфильтрацией. Заключение: неразвивающаяся маточная беременность с признаками гематогенной инфекции неустановленной этиологии (очаговый продуктивный виллузит).
На рисунке 1.2 представлен хорион, полученный в результате СПВ у пациентки при беременности 9 недель. Ворсины хориона промежуточного незрелого типа строения с гиповаскуляризацией, часть ворсин с признаками редукции сосудистого русла. Строма ворсин с дистрофическими изменениями и отложением фибриноида в межворсинчатом пространстве. В плацентарном ложе диффузная моноцитарная инфильтрация с очаговой примесью нейтрофилов, очаговые экссудативно-некротические изменения и кровоизлияния. Заключение: неразвивающаяся маточная беременность. Базальный вторичный экссудативно-некротический децидуит.
В обоих наблюдениях наличие дистрофических изменений ворсин хориона и отложения фибриноида в межворсинчатом пространстве позволяет предположить реакцию иммунного отторжения как этиологического фактора прерывания беременности, являющегося следствием персистирующего воспаления в эндометрии, что подтверждается наличием очаговой моноцитарной инфильтрацией с очаговыми экссудативно-некротическими изменениями и кровоизлияниями.
Морфологическое строение хориона/плаценты у пациенток с СПВ в поздние сроки. СПВ в сроки 120–216 недель произошел у 8/171 (4,7%) и 12/116 (10,3%) пациенток анализируемых групп (табл. 4).
На основании анализа показателей, представленных в таблице 4, можно сделать вывод, что в обеих группах не было статистически значимых различий в строении хориона/плаценты – выявлена воспалительная инфильтрация, отложение межворсинчатого фибриноида, дистрофия клеток базальной децидуальной оболочки.
Неполноценность морфологического строения хориона/плаценты проявляется снижением его васкуляризации в эти сроки, свидетельствует о недостаточности функционирования, что обусловлено неполным восстановлением структуры эндометрия под влиянием лечения на прегравидарном этапе.
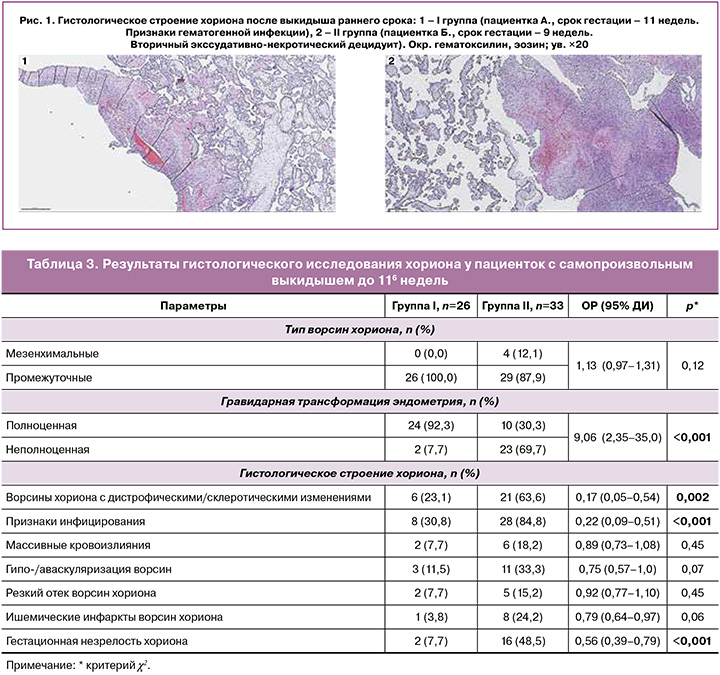
Результаты гистологического исследования плацент у пациенток после поздних СПВ представлены на рисунке 2.
На рисунке 2.1 представлена плацента после СПВ у пациентки в сроке 18 недель. Ворсины промежуточного незрелого и зрелого строения с гиповаскуляризацией. Строма с дистрофическими и склеротическими изменениями, местами с отеком. Единичные ворсины хориона с моноцитарной инфильтрацией в строме. Базальная пластинка с диффузной моноцитарной инфильтрацией, очаговыми экссудативно-некротическими изменениями. Заключение: плацентарная ткань соответствует сроку гестации, гематогенная инфекция неустановленной этиологии (базальный и париетальный экссудативно-некротический децидуит, очаговый продуктивный виллузит).
На рисунке 2.2 представлена плацента после СПВ в сроке 17 недель. Плацента промежуточного незрелого строения с частичной редукцией кровеносного русла, умеренным кровенаполнением капилляров. Строма ворсин с дистрофическими изменениями. В строме части ворсин кровоизлияния и единичные моноциты. Крупные пролифераты трофобласта, местами с дистрофическими изменениями. Базальная пластинка с диффузной моноцитарной инфильтрацией. Хориальная пластинка без патологических изменений. Депозиты солей кальция. Заключение: гистологическое строение плацентарной ткани не соответствует сроку гестации. Гематогенная инфекция неустановленной этиологии (базальный продуктивный децидуит, очаговый продуктивный виллузит).
Данные наблюдения свидетельствуют о формирующейся вторичной плацентарной недостаточности, обусловленной инфекционной патологией фетоплацентарной системы с проявлениями гематогенной инфекции.
Гистологическое строение плаценты у пациенток с преждевременными родами. ПР произошли у 14/171 (8,2%) и 12/116 (10,3%) пациенток. При этом родивших в срок 280–366 недель было большинство (10/14 (71,4%) и 9/12 (75,0%) соответственно). Морфология плацент представлена в таблице 5.
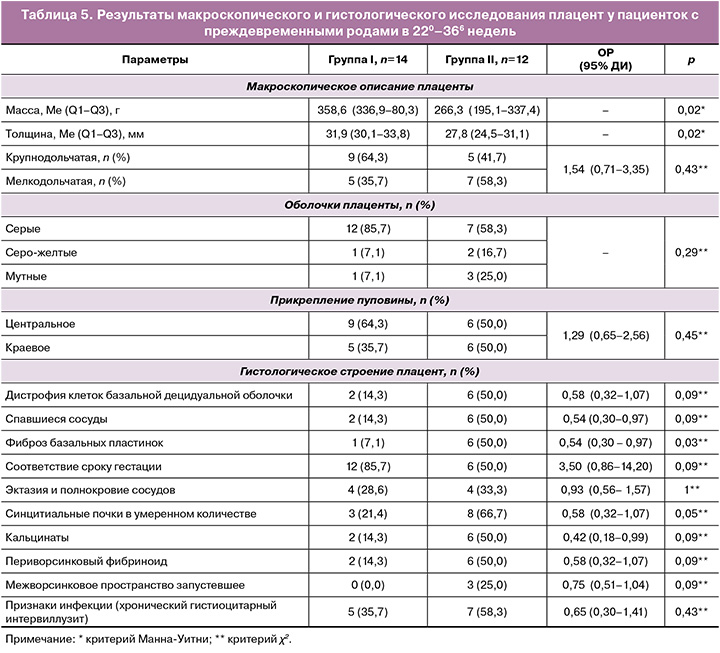
Из таблицы 5 видно, что масса и толщина плаценты были значимо выше у пациенток в I группе, однако морфологическое строение отличалось только меньшим количеством синцитиальных почек и фиброза базальных пластинок. Остальные показатели в обеих группах свидетельствовали о ее неполноценности, как и у пациенток с поздними СПВ.
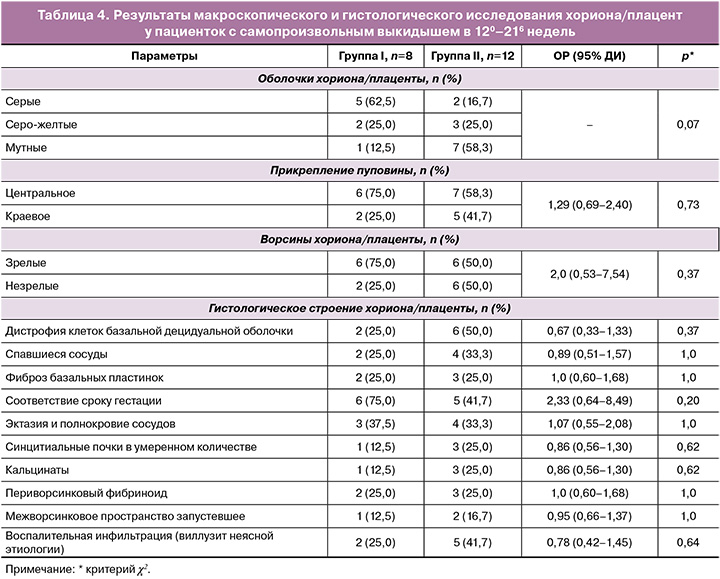
Примеры морфологического строения плацент у пациенток из двух групп после ПР представлены на рисунке 3.
На рисунке 3.1 представлены результаты гистологического исследования плаценты после родов в 32 недели. Плацента промежуточно-терминального типа развития виллезного дерева с умеренным кровенаполнением сосудистого русла ворсин всех генераций. Группы ворсин с фибриноидной альтерацией. Большое количество синцитиальных узелков. Базальная пластинка с периваскулярной моноцитарной инфильтрацией, полнокровными сосудами и очаговой экссудативной инфильтрацией в фибриноиде. Хориальная пластинка с эктазией интраплацентарных вен. Мелкоочаговые депозиты солей кальция. Заключение: гистологическое строение плацентарной ткани не соответствует сроку гестации (гестационная незрелость).
На рисунке 3.2 представлены результаты гистологического исследования плаценты после родов в сроке 31 неделя. Плацента промежуточно-терминального типа строения с умеренным кровенаполнением сосудистого русла всех генераций. Группы некротизированных ворсин с фибриноидной альтерацией. Неравномерное полнокровие интервиллезного пространства. В базальной пластинке рассеянная моноцитарная инфильтрация, утолщенный слой фибриноида с крупноочаговыми экссудативно-некротическими изменениями и расслаивающими кровоизлияниями. Хориальная пластинка без патологических изменений. Депозиты солей кальция. Заключение: гистологическое строение плацентарной ткани не соответствует сроку гестации (гестационная незрелость).
Морфологическое строение плаценты у пациенток, родивших в срок. Результаты макроскопического и гистологического исследования плацент от женщин, родивших в срок 370–416 недель, представлены в таблице 6.
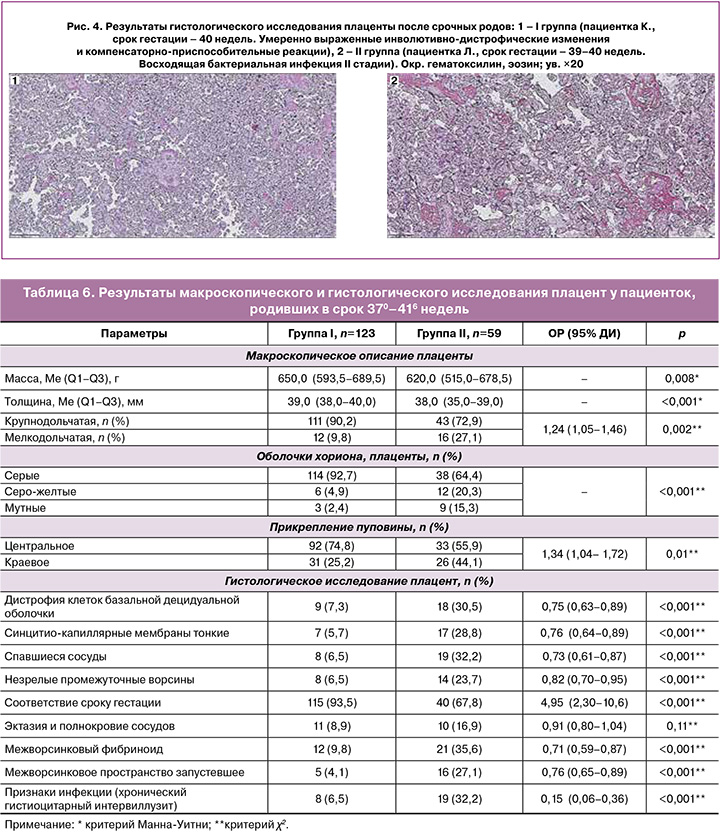
Количество пациенток, родивших в срок, существенно отличалось между группами – 71,9 и 50,9% от количества наступивших беременностей, р<0,001. Масса плацент была сопоставима, но по всем остальным параметрам наблюдалась статистики значимая разница (кроме эктазии и полнокровия сосудов) между пациентками I и II групп с уменьшением риска неполноценного строения по отдельным показателям от 2 до 9 раз в пользу I группы. Эта разница определила меньший риск осложнений во время беременности у пациенток I группы в 2,7 раза.
Примеры гистологического исследования плацент после срочных родов у пациенток из двух групп представлены на рисунке 4.
На рисунке 4.1 представлены результаты гистологического исследования плаценты после срочных родов в 40 недель. Плацента: терминальный тип развития виллезного дерева с умеренным кровенаполнением сосудистого русла ворсин всех генераций. Большое количество синцитиальных узелков. Группы ворсин с фибриноидной альтерацией, склеротическими изменениями стромы. Базальная пластинка с крупноочаговыми кровоизлияниями, рассеянной моноцитарной инфильтрацией, полнокровными сосудами, очагами экссудативно-некротических изменений. Хориальная пластинка без особенностей. Депозиты солей кальция. Пуповина: умеренный отек стромы, сосудов – 3. Эктазия сосудов. В просветах сосудов кровь. Оболочки: представлены амнионом нормального строения. Заключение: гистологическое строение плацентарной ткани соответствует сроку гестации, умеренно выраженные инволютивно-дистрофические изменения и компенсаторно-приспособительные реакции с равномерным распределением.
На рисунке 4.2 представлены результаты морфологического исследования плаценты после срочных родов в 39–40 недель. Плацента: терминальный тип развития виллезного дерева с парезом и полнокровием сосудистого русла ворсин всех генераций. Большое количество синцитиальных узелков. Неравномерное полнокровие интервиллезного пространства. Базальная пластинка с рассеянной моноцитарной инфильтрацией. Хориальная пластинка – в субхориальном фибриноиде диффузная экссудативная инфильтрация. Оболочки: амниальный слой частично отслоен. Темноклеточный трофобластический слой. Децидуальная оболочка спонгиозного типа с очаговой экссудативной инфильтрацией. Пуповина: умеренный отек стромы, сосудов. Крупноочаговые периваскулярные кровоизлияния. Заключение: гистологическое строение плацентарной ткани соответствует сроку гестации. Восходящая бактериальная инфекция II стадии (экссудативный плацентарный децидуит, экссудативный субхориальный интервиллузит). Выраженные острые циркуляторные нарушения в плацентарной ткани.
Обсуждение
Среди причин неудачных попыток ЭКО выделяют два фактора – неспособность к внутриматочной нидации полученных in vitro эмбрионов (эмбриональный фактор) либо снижение рецептивности эндометрия (эндометриальный фактор), который при условии получения эмбрионов хорошего качества приобретает ведущую роль, обусловливая до 70% неудач ЭКО, что мотивирует ученых к поиску методов воздействия на эндометрий [27].
Морфологические особенности эндометрия при ХЭ уже хорошо изучены и выявлены основные его проявления – инфильтрация стромы эндометрия плазмоцитами, наличие лимфоидных инфильтратов, склероз спиральных артерий, очаговая гиперплазия базального слоя [9]. Имеют место тяжелые дистрофически-атрофические изменения в слизистой оболочке и железистом эпителии одновременно с полиморфной клеточной инфильтрацией и фибропластической стромальной трансформацией различной интенсивности [28]. Характерными структурными изменениями для ХЭ являются интенсивные процессы апоптоза эпителия слизистой оболочки матки при незначительной его пролиферативной активности, при этом возникает неадекватная рецепция прогестерона клетками-мишенями [29]. Также обнаружены образование рубцовой ткани и нарушение гемодинамики, приводящее к очаговым кровоизлияниям в слизистую оболочку матки [30].
Наиболее часто обсуждаемым методом лечения ХЭ является АБ-терапия, однако в исследованиях делается акцент на репродуктивные результаты, а морфологические изменения в эндометрии под влиянием терапии не описаны [31]. Также в литературе отсутствуют сведения об особенностях строения хориона/плацент, связи их со строением эндометрия перед зачатием и зависимости от них исходов беременности у пациенток с ХЭ.
В настоящей работе было показано, что при лечении пациенток с бесплодием, обусловленном ХЭ, на прегравидарном этапе морфологическое строение эндометрия улучшается в обеих группах. Лечение с использованием Суперлимфа/АБ/гестагена и АБ/гестагена привело к нормализации процессов секреции/пролиферации в соответствие с фазами менструального цикла и уменьшению фиброза, однако результаты были в 1,5 раза лучше в I группе, при этом разрешение ХЭ было с вероятностью в 1,6 раза выше по критерию CD138, что свидетельствует о преимуществе комплексного лечения.
Что касается повторного исследования эндометрия (морфология в сочетании с ИГХ), у женщин с ХЭ, в работе Liu W. J. et al. (2022) показало, что лечение доксициклином может улучшить репродуктивные результаты в программах ВРТ с криопереносом, однако, если ХЭ сохранялся после первого курса, то повторное применение антибиотиков (1 или 2 курса по 14 дней) не улучшало исходы [32]. Морфологические характеристики эндометрия под влиянием лечения в этой работе не приводятся. Вероятно, потенциал влияния АБ на структуры эндометрия ограничен элиминацией плазматических клеток без восстановления функциональной активности тканей. Известно, что, даже, в случае соответствия морфологической структуры эндометрия фазе менструального цикла, возможно нарушение его функциональных свойств, необходимых для процессов имплантации [33]. Это положение подтверждается результатами, полученными в настоящем исследовании – после терапии АБ/гестагеном беременность наступила только у 38,7% пациенток, тогда как при добавлении Суперлимфа – у 57,0% с увеличением шансов наступления беременности в 1,5 раза.
Изучение хориона после выкидыша в работе Kaku S. et al. (2020) показало присутствие плазматических клеток, что свидетельствовало о наличии ХЭ [33]. Однако морфологические особенности хориона в данной работе не изучались. В настоящем исследовании статистически значимыми различиями в морфологии тканей гестации после СПВ в I триместре были – полноценная гравидарная трансформация эндометрия (92,3 против 30,3% соответственно, р<0,001), наличие ворсин хориона с дистрофическими/склеротическими изменениями (23,1 против 63,6%, р=0,002), воспаление в хорионе (30,8 против 84,8%, р<0,001), гестационная незрелость хориона (7,7 против 48,5%, р<0,001). Большее количество нарушений в структуре хориона свидетельствует о его функциональной неполноценности, что закономерно реализовалось более высокой частотой выкидышей в ранние сроки.
При СПВ в сроки120–216 недель выделить значимые изменения в хорионе/плаценте не удалось. После ПР масса и толщина плаценты были статистически значимо выше у пациенток в I группе, однако морфологическое строение отличалось только меньшим количеством синцитиальных почек (21,4 и 66,7%, р=0,05) и фиброза базальной пластинки (7,1 и 50,0%, р=0,03) соответственно.
Известно, что нормализация строения и функции эндометрия обеспечивает нормальный процесс инвазии трофобласта после имплантации, который является критическим для адекватного функционирования плаценты в дальнейшем и влияет на течение беременности. Это подтверждается результатами настоящего исследования: снижением риска преэклампсии в 2 раза, гипоксии и задержки роста плода – в 3 раза, а также антенатальной гибели плода – в 6 раз. Исходы беременности также свидетельствуют о преимуществе использования Суперлимфа перед зачатием – увеличение шансов на живорождение было 2 раза выше, риск СПВ в ранние сроки и ПР – в 2 раза ниже, и этот эффект был значительнее по сравнению с исходами, которые приводятся в работах других авторов [34, 35]. Более низкая частота осложнений и улучшение исходов может быть связано с тем, что экспрессия рецепторов к прогестерону в эпителии и строме эндометрия увеличивается в 3 и 2,7 раза соответственно, а также выявлено улучшение показателей ангиогенеза и васкуляризации эндометрия под влиянием Суперлимфа, что было показано в исследовании Доброхотовой Ю.Э. и соавт. [36]. Авторами также установлено восстановление экспрессии факторов врожденного иммунитета, купирование ХЭ и нормализация рецептивности ткани эндометрия [37].
В публикациях отмечается, что в плацентах женщин с ПР чаще наблюдаются сосудистая мальперфузия [38] и нарушение созревания ворсинок [39], обнаружены пролиферативный виллузит, поствоспалительная гиповаскуляризация, аномальная дифференцировка сосудисто-стромального компонента ворсинок, нарушения кровообращения, компенсаторная гиперплазия терминальных ворсинок, капилляров и их синцитиальных мембран [40], что согласуется с результатами настоящего исследования.
Preston M. et al. в обзоре 2024 г. сообщают, что плацентарные нарушения (ПН) играют определенную роль в этиологии ПР наряду с воспалительными изменениями [41]. У женщин, родивших преждевременно, обнаруживаются сосудистые поражения плаценты. Несмотря на убедительные доказательства того, что ПН может способствовать развитию ПР, механизмы, лежащие в основе этих процессов, не изучены. Согласно одной из теорий, когда маточно-плацентарная ишемия настолько серьезна, что приводит к децидуальному некрозу и кровотечению, тромбин играет роль в инициировании родов поскольку обладает мощной окситоцин подобной активностью.
ПН хорошо известна как причина ЗРП, когда спиральные артерии не могут трансформироваться, и это приводит к повышению сосудистого сопротивления и снижению притока крови к плаценте и плоду [41].
Описанные выше изменения в плаценте выявлены нами у женщин с ХЭ, пролеченных в прегравидарном периоде, а также определены и некоторые особенности, которые, вероятно, обусловлены воспалительной реакцией иммунной системы на персистенцию условно-патогенных микроорганизмов и вирусов.
Vitagliano A. et al. (2018) считают, что контрольная биопсия с гистологическим исследованием эндометрия после лечения ХЭ необходима во всех случаях для подтверждения разрешения ХЭ, перед выполнением ЭКО [42]. Наше исследование также демонстрирует необходимость диагностики восстановления полноценности эндометрия на прегравидарном этапе, однако, как показано в наших других работах, не только в морфологическом плане, но и в функциональном с помощью дополнительных современных методов исследования [43], а также использования инструментов прогноза для наступления беременности и ее исходов, разработанных на основе нейросетевой технологии [44].
Заключение
У пациенток с ХЭ и неудачными исходами ЭКО обнаруживаются морфологические признаки неполноценности хориона/плаценты (плацентарной недостаточности), что определяет необходимость восстановления структуры и функции эндометрия до зачатия. Морфологическое исследование эндометрия перед планированием ЭКО у пациенток, получивших курс комплексного лечения, включающего комплекс «Суперлимф» в период прегравидарной подготовки, свидетельствует о значительном улучшении его структуры по сравнению с контролем (соответствие дню цикла, уменьшение склероза спиральных артерий и перигландулярного фиброза), что позволяет улучшить результаты ЭКО и исходы беременностей.



