Естественное вскармливание является постнатальным эквивалентом пуповинной связи-гемотрофного питания внутриутробного периода, реализующим наследственный фонд через эпигенетические механизмы программирования здоровья [1, 2].
При исходном дисбалансе нейро-эндокринно-иммунно-метаболических процессов, в частности, при метаболическом синдроме (МС) вероятность патологического пуэрперия значительно возрастает, следствием чего является незавершенность гестационного маммогенеза и, как следствие, нарушения лактогенеза определяют весь последующий этап естественного вскармливания [3, 4].
В настоящее время доказано, что МС приводит к отклонениям от «нормы беременности», и характерные изменения углеводного и липидного обменов, провоспалительный статус, напряженный сосудисто-тромбоцитарный гемостаз, повышенный коагуляционный потенциал формируют либо состояние «нормы компенсированной патологии» с сохраненной ауторегуляцией, либо происходит срыв адаптационных механизмов с развитием акушерской патологии, что нарушает структурно-функциональную перестройку организма родильницы в послеродовом периоде [4,5]. Типичным осложнением пуэрперия, патогенетически связанным с МС, является ранняя гипогалактия. На примере распространенного МС демонстрируется роль фетального программирования лактации, сопровождающегося ростом частоты ранней гипогалактии. При МС основной причиной несвоевременного прекращения грудного вскармливания является гипогалактия и ассоциированные с ней заболевания детей [6]. В связи с этим, актуальной является разработка патогенетически обоснованных эффективных методов прогнозирования и профилактики ранних нарушений лактационной функции. Наиболее оптимальными в этом отношении являются периоды окончания гестации и лактогенеза, то есть первые 7 дней послеродового периода. Медикаментозные методы коррекции патологической лактации имеют ряд побочных реакций, усугубляющих гипоталамическую дисфункцию, и применяются после установления диагноза – к концу лактогенеза, что мало результативно при МС [7, 8]. Очевидно, решение проблемы профилактики гипогалактии при МС следует искать в разработке немедикаментозных методов и своевременном начале превентивного лечения. В последние годы из немедикаментозных методов с регуляторным механизмом действия активно изучается светотерапия видимым инфракрасным некогерентным поляризованным светом (ВИП-свет). В основе лечебных свойств ВИП-света лежат молекулярные механизмы активации ферментных комплексов (НАДФH-оксидазы, NO-синтазы) с образованием высоко реакционных радикалов и молекул. Каскад активных форм кислорода и оксида азота модифицирует рецепторные комплексы клеток и трансмембранную трансляцию биохимических сигналов, что реализуется в системных и местных эффектах [7].
Вышеизложенное обосновывает необходимость модернизации предикции и превенции нарушений лактогенеза при МС.
Цель исследования: выявить особенности предлактационной перестройки и становления лактации при МС для разработки новых патогенетически обоснованных методов прогнозирования и профилактики ранней гипогалактии.
Материал и методы исследования
Обследованы 219 беременных женщин, из них у 184 имел место МС. В I группу вошли 88 беременных с МС, которым проводили только базовые мероприятия по поддержке естественного вскармливания (ВОЗ (2003), приказ МЗ РФ № 572н от 2012 г.). Учитывая влияние на становление лактации не только МС, но и осложнений беременности, группа I была разделена на две подгруппы: IА – 46 женщин с неосложненным течением гестации; IВ – 42 пациентки с осложненной беременностью. II группу составили 96 беременных с МС, которым, дополнительно к базовым мероприятиям проведена коррекция нарушений становления лактации комплексным немедикаментозным методом. Аналогично I группе, II группа была разделена на две подгруппы: в IIА вошли 52 женщины с неосложненной гестацией; в IIВ – 44 женщины с осложненным течением беременности. III группу составили 35 женщин с физиологически протекающей беременностью.
Критерии отбора женщин с МС: спонтанная беременность, отсутствие тяжелой соматической патологии, сахарного диабета, неконтролируемой артериальной гипертензии, булимии, инфекционно-воспалительных заболеваний, синдрома поликистозных яичников. Критерии исключения: абсолютные и относительные противопоказания для грудного вскармливания, патологические изменения молочных желез, антенатальная гибель плода, критическая плацентарная недостаточность (ПН), тяжелая преэклампсия (ПЭ), очень ранние и ранние преждевременные роды (до 34 нед.).
Для диагностики ПН применялась комплексная балльная шкала с расчетом итогового показателя [9], тяжесть ПЭ оценивали критериями ВОЗ (2011). В крови беременных определялись: неконъюгированный эстриол (НЭ), прогестерон, плацентарный лактоген (ПЛ) – ИФА («Hoffman Le Roche», Switzerland)); маркеры сосудисто-эндотелиальной дисфункции – количество тромбоцитов и их максимальная амплитуда агрегации (МААТ, агрегометр «Payton» (США)), циркулирующие эндотелиальные клетки (ЦЭК), фактор роста плаценты (ФРП) – ИФА (ELISA), фибронектин (ФН), («НВО-Иммунотех», Россия); параметры липидного и энергетического обменов – общий холестерин (ХС), триглицериды (ТГ), ХС липопротеидов высокой плотности (ЛПВП) с расчетом ТГ/ХС ЛПВП и коэффициента атерогенности (КА = общий ХС – ЛПВП/ЛПВП), термостабильная щелочная фосфатаза (ТЩФ) – анализатор «Stat Fax 4500+» (США), лептин (DSL (USA)), плацентарный α-1микроглобулин (ПАМГ) – «ПАМГ Фертитест» (РФ); маркеры воспалительной реакции и апоптоза – фактор некроза опухоли альфа (ФНОα), С-реактивный белок (СРБ) – «Протеиновый контур» (РФ), лимфоциты с фенотипом CD95+ (Л CD95+), общий реактивный потенциал организма (ИСЛК – индекс сдвига лейкоцитов крови, ИА – индекс аллергизации). Морфологическое исследование плацент проводили с учетом критериев А.П. Милованова (2009).
Ультразвуковое исследование (УЗИ) и ультразвуковую допплерографию (УЗДГ) молочных желез проводили в 37–39 недель, 4–6-е сутки пуэрперия. Критерии завершенности маммогенеза в конце беременности – УЗ-морфотип «беременности», полноценного течения лактогенеза – «лактационный» морфотип. УЗДГ латеральных грудных артерий (S/D) позволила выявить степень дефицита кровотока в молочных железах при МС в период предлактационной перестройки.
Становление лактационной функции оценивали по суточному объему и качественному составу молока, с учетом потребности в нем новорожденного, термометрии молочных желез, уровням в крови пролактина (ПРЛ) (ИФА («Hoffman Le Roche», Switzerland), про- и противовоспалительных цитокинов интерлейкина (ИЛ)-6, ИЛ-10 («Bender-Medsystems» GmbH, Austria), лейкоцитарному индексу интоксикации (ЛИИ).
Профилактика ранней гипогалактии во II группе проводилась комплексным немедикаментозным методом, включающим дородовое сцеживание молозива и светотерапию ВИП-светом лампы «Bioptron Compact» («Zepter», Switzeland; регистрационное удостоверение ФС №2006/372 от 30.03.2006). Первый компонент метода — сцеживание молозива – проводили в условиях женской консультации или отделения патологии беременности с 37 недель до родов ежедневно 3 раза в день по 5–10 мин. из каждой молочной железы. Данный компонент формирует рефлекторную составляющую, индуцирует секреторную и молоковыделительную функции [10]. Светотерапия назначалась со 2-х суток пуэрперия 3 раза в день с интервалом не менее 4 часов: после обработки окси-спреем свет лампы направляется под прямым углом на расстоянии 3–4 см от участка ареолы выше соска левой, затем правой молочной железы, экспозиция – 8 мин. на каждую точку. Курс составил от 10 до 16 сеансов.
В работе использованы методы дескриптивной статистики, корреляционного анализа по Спирмену, логистической регрессии, ROC-анализа. Прогностическая ценность предикторов ранней гипогалактии рассчитывалась с применением одномерной логистической регрессии. Для формирования группы высокого риска по нарушенному становлению лактации среди женщин с МС построена модель логистической регрессии с помощью многомерного анализа данных. Для оценки эффективности профилактических мероприятий использованы методологические стандарты доказательной медицины.
Результаты исследования и их обсуждение
Средний возраст женщин I, II, III групп составил 26,5±4,2 года, 27,5±3,6 года, 25±3,8 года, p>0,05. I и II группы были сопоставимы (р>0,05) по профессиональной принадлежности (работающие 74,4 и 70,9%), паритету (первородящие 67,8 и 71,8%), частоте соматических (97,8 и 99,1%) и гинекологических (19,0 и 21,1%) заболеваний, осложнений беременности, способу родоразрешения (роды «per vias naturales» 55,6 и 61,8%), состоянию новорожденных (гипотрофия – 28,4 и 28,1%, асфиксия – 18,2 и 18,8%). Масса тела женщин с МС до беременности колебалась от 84 до 114 кг. Средняя масса тела составила 92,5±7,4 и 94,3±6,5 кг соответственно I и II группам (p>0,05). Индекс массы тела (кг/м2) у женщин с МС варьировал от 30 до 35, средний показатель составил 33,2±1,6 и 33,6±1,1 (p>0,05). Окружность талии колебалась в пределах 89–114 см, при этом средняя величина составила 101,5±5,2 см и 103,2±6,4 см (p>0,05). У 48% женщин (42/88) I группы и 49% (47/96) II была контролируемая артериальная гипертензия. АД (мм рт. ст.) в I и II группах характеризовалось соответственно: систолическое АД колебалось от 126 до 135 (среднее АДс 128±5) и от 127 до 136 (среднее АДс 129±4); диастолическое АД – от 65 до 82 (среднее АДд 77±4) и от 67 до 84 (среднее АДд 77±5) – p>0,05. У женщин I и II групп исходно наблюдались атерогенные изменения липидного профиля крови: общий ХС (ммоль/л) – 6,1 [5,2–7,0] и 6,2 [5,3–6,9], ТГ (ммоль/л) – 1,84 [1,77–2,67] и 1,86 [1,76–2,69], ЛПВП (ммоль/л) – 1,0 [0,88–1,16] и 0,98 [0,9–1,12], показатель ТГ/ ХС ЛПВП – 1,62 [1,33–2,61] и 1,60 [1,35–2,58]; КА – 5,1 [4,7–5,5] и 5,3 [4,9–5,8] – p>0,05. Следовательно, основу I и II групп составили пациентки с ожирением, нарушением липидного спектра крови, контролируемой АД.
Частота осложнений беременности в IВ и IIВ подгруппах была сопоставима: ПН различной степени тяжести – 81% (34/42) и 79,5% (35/44); задержка роста плода – 59,5% (25/42) и 61,4% (27/44); хроническая гипоксия плода – 38,1% (16/42) и 40,9% (18/44); умеренная ПЭ – 23,8% (10/42) и 27,3% (12/44); преждевременные роды – 11,9% (5/42) и 13,6% (6/44) — p˃0,05.

Отсутствие значимых клинико-лабораторных различий между I и II группами обосновывает корректное сравнение частоты реализации ранней гипогалактии у женщин с МС в зависимости от проводимых профилактических мероприятий.
Анализ особенностей предлактационной перестройки на фоне МС проведен в I группе беременных (табл. 1).
Содержание трофоадаптивных гормонов, отражающих состояние гормонально-метаболической активности фето-плацентарного комплекса (ФПК) и являющихся индукторами структурных изменений в эпителиальной и соединительной ткани молочных желез, подтвердило состояние ФПК, диагностированное с применением балльной шкалы тяжести ПН. Уровни ПЛ, прогестерона и НЭ были снижены в 1,6 раза, 1,8 раза, 1,6 раза, по сравнению с контролем, что свидетельствует о дисбалансе нейроэндокринной регуляции гестационного маммогенеза.
Общий реактивный потенциал организма, липидный профиль и связанный с ним лептин у беременных с МС в III триместре показали однонаправленность изменений при изолированном МС (IА, IIА) и при его сочетании с акушерской патологией (IВ, IIВ), относительно контроля. Увеличение общего ХС на 20%, ТГ на 50%, снижение ХС ЛПВП на 26%, рост показателя ТГ/ХС ЛПВП в 1,9 раза, КА – в 1,6 раза, лептина – в 2,8 раза, их высокая положительная ассоциативная связь с маркерами сосудисто-эндотелиальной дисфункции, неспецифической воспалительной реакцией, апоптоза и уровнем гормонов (r от 0,85 до 0,96, при p<0,05) доказывает роль нарушенного липидного и энергетического обменов и МС в целом, в патогенезе неблагоприятных гестационных и перинатальных исходов и может служить важным звеном нарушений реципрокных связей в системе «плацента-гипоталамус-гипофиз-молочные железы».
УЗИ молочных желез у беременных I группы выявило «репродуктивный» УЗ-морфотип в 76,1% наблюдений (IА – 63% (29/46), IВ – 90,5% (38/42)), УЗ-морфотип «беременности» в 23,9% (IА – 37% (17/46), IВ – 9,5% (4/42)). У родильниц преобладающим был морфотип «беременности с расширенными протоками» – 71,6% (IА – 65,2% (30/46), IВ – 78,6% (33/42)), при этом «лактационный» морфотип диагностирован лишь в 28,4% (25/88). УЗДГ латеральных грудных артерий выявила статистически значимое превышение S/D у женщин с МС по обеим молочным железам как до родоразрешения, так и в послеродовом периоде. Данное обстоятельство является проявлением характерной для МС эндотелиальной дисфункции, затрагивающей и сосуды молочных желез, лишая их приоритетного принципа кровоснабжения. Данные УЗИ и УЗДГ подтверждают снижение нейроэндокринной поддержки маммогенеза, ухудшение гемоциркуляции молочных желез и свидетельствуют об отсутствии их полноценной морфофункциональной перестройки к последующей лактации при МС. Выявленная закономерность согласуется с исследованиями А.Н. Стрижакова с соавт. [11], S.M. Anderson [12].
 Выявлено наличие сильной ассоциативной связи (r от 0,81 до 0,92, при p<0,05) между маркерами липидного обмена, клеточного энергообеспечения, эндотелиально-гемостазиологической дисфункции, провоспалительного и общего реактивного потенциала, состояния ФПК и показателями предлактационной подготовки молочных желез (УЗ-морфотип, S/D латеральных грудных артерий). Этот факт свидетельствует о патогенетической роли в задержке их структурно-функциональной перестройки в период гестации (незавершенный маммогенез) и после родоразрешения (патологический лактогенез) изменений, характерных для МС – дисбаланса эндокринной регуляции, дезадаптации эндотелиальной системы, нарастания дислипидемии и общего реактивного потенциала с нарушением микроциркуляции в молочных железах, активации иммунопатологических процессов, проявляющихся индуцированной трофобластом запрограммированной клеточной гибелью лимфоцитов, провоспалительного состояния, изменений регуляции клеточной трансформации и энергообмена. Сопоставимость результатов лабораторно-инструментального обследования беременных I и II групп (табл. 1) укладывается в заключение о схожести сформированных клинических групп женщин с МС.
Выявлено наличие сильной ассоциативной связи (r от 0,81 до 0,92, при p<0,05) между маркерами липидного обмена, клеточного энергообеспечения, эндотелиально-гемостазиологической дисфункции, провоспалительного и общего реактивного потенциала, состояния ФПК и показателями предлактационной подготовки молочных желез (УЗ-морфотип, S/D латеральных грудных артерий). Этот факт свидетельствует о патогенетической роли в задержке их структурно-функциональной перестройки в период гестации (незавершенный маммогенез) и после родоразрешения (патологический лактогенез) изменений, характерных для МС – дисбаланса эндокринной регуляции, дезадаптации эндотелиальной системы, нарастания дислипидемии и общего реактивного потенциала с нарушением микроциркуляции в молочных железах, активации иммунопатологических процессов, проявляющихся индуцированной трофобластом запрограммированной клеточной гибелью лимфоцитов, провоспалительного состояния, изменений регуляции клеточной трансформации и энергообмена. Сопоставимость результатов лабораторно-инструментального обследования беременных I и II групп (табл. 1) укладывается в заключение о схожести сформированных клинических групп женщин с МС.
Оценка секреторной активности молочных желез выявила снижение суточного объема молока в I группе женщин как на 4-е (182±29 мл), так и на 6-е (265±42 мл) сутки пуэрперия. Разница с группой здоровых родильниц (532±32 мл) на 6-е сутки составила: в IА подгруппе – 1,8 раз (304±38 мл, р<0,05), в IВ подгруппе – 2,6 раза (205±34 мл, р<0,05). С учетом потребности новорожденного, дефицит молока наблюдался у 75% женщин I группы (у 67,4% (31/46) IА подгруппы и у 83,3% (35/42) IВ); при этом, от необходимого объема молока дефицит по IА подгруппе составил 23%, по IВ – 38%. Аналогичная закономерность получена при анализе содержания в секрете молочных желез белка, молочного жира и лактозы: у женщин с МС было выявлено статистически значимое снижение уровня макронутриентов в 1,4 раза, 1,3 раза и 1,2 раза соответственно, по сравнению с контролем (2,6% [2,4–2,8], 3,3% [3,1–3,5], 5,1% [4,7–5,5]), с наиболее выраженными изменениями в IВ подгруппе. Диагностика клинического течения лактации в I группе выявила в 72,7% наличие объективных (отсутствие нагрубания желез, у новорожденного – число мочеиспусканий менее 6 раз в сутки, «голодный стул») и в 59% — субъективных (отсутствие чувства «прилива» молока, ощущения «потепления» молочных желез, засыпания новорожденного после кормления, промежуток между кормлениями менее 1 часа) симптомов патологического лактогенеза. Статистические различия между аксиллярной и маммарной температурой выявлены только в контрольной группе на 5–6-е сутки после родоразрешения, что является доказательством нарушенных микроциркуляторных и обменных процессов в неподготовленных к лактации в молочных железах при МС.
Исследование уровня ПРЛ выявило резкое повышение к 5–6-м суткам у здоровых родильниц (табл. 2). У женщин с МС изменения в динамике ПРЛ были значительно менее существенными: разница с контролем на 5–6-е сутки составила 1,4 раза в IА подгруппе, 1,7 раз в IВ. Нарушение выработки ведущего регулятора лактации объясняется нами недостаточностью синтезирующего и рецепторного звеньев при гипоталамо-гипофизарной дисфункци, что проявляется в количественной и качественной недостаточности секрета молочных желез.
В послеродовом периоде (2-е, 5–6-е сутки) у родильниц I группы отмечено наличие провоспалительного статуса с увеличением ИЛ-6 (68 пг/мл [53–77] и 53 пг/мл [41–62]), ЛИИ (2,09 [1,89–2,16] и 1,56 [1,43–1,62]) на фоне снижения противовоспалительного цитокина ИЛ-10 (12,8 пг/мл [9,6–14,9] и 16,4 пг/мл [14,7–18,8]), что отражает нарушение хрупкого баланса между воспалительными и пролиферативными процессами в тканях молочных желез [13, 14].
 Частота нарушенного становления лактации на фоне МС в I группе составила 75% (66/88), в IА подгруппе – 67,4% (31/46), в IВ – 83,3% (35/42). Определение дефицита молока по отношению к потребностям новорожденного позволило провести анализ структуры степени тяжести ранней гипогалактии: при МС без сочетания с акушерской патологией преобладала гипогалактия I ст. тяжести (77,4% против 22,6% наблюдений гипогалактии II ст.), при МС в сочетании с акушерской патологией частота II ст. и III ст. тяжести гипогалактии была сопоставима с частотой I ст. (54,3% против 45,7%). Проведенный корреляционный анализ показал убедительную сильную (IА) и средней силы (IВ) положительную корреляционную связь между наличием/отсутствием акушерской патологии при МС и степенью тяжести гипогалактии (для IА r=0,84; для IВ r=0,72, р<0,05). Полученные данные объективизируют клинико-патогенетические параллели между характером течения беременности на фоне МС и функциональной недостаточностью молочных желез, при ведущей его роли в нарушении гестационного маммо- и лактогенеза.
Частота нарушенного становления лактации на фоне МС в I группе составила 75% (66/88), в IА подгруппе – 67,4% (31/46), в IВ – 83,3% (35/42). Определение дефицита молока по отношению к потребностям новорожденного позволило провести анализ структуры степени тяжести ранней гипогалактии: при МС без сочетания с акушерской патологией преобладала гипогалактия I ст. тяжести (77,4% против 22,6% наблюдений гипогалактии II ст.), при МС в сочетании с акушерской патологией частота II ст. и III ст. тяжести гипогалактии была сопоставима с частотой I ст. (54,3% против 45,7%). Проведенный корреляционный анализ показал убедительную сильную (IА) и средней силы (IВ) положительную корреляционную связь между наличием/отсутствием акушерской патологии при МС и степенью тяжести гипогалактии (для IА r=0,84; для IВ r=0,72, р<0,05). Полученные данные объективизируют клинико-патогенетические параллели между характером течения беременности на фоне МС и функциональной недостаточностью молочных желез, при ведущей его роли в нарушении гестационного маммо- и лактогенеза.
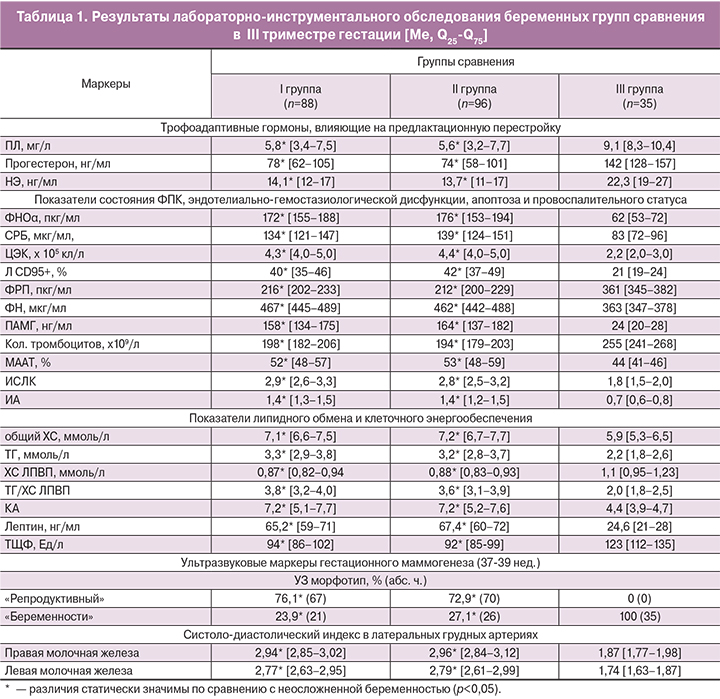
Существующие предикторы нарушенного становления лактации обладают низкой прогностической значимостью, так как отражают лишь отдельные механизмы патологической предлактационной перестройки молочных желез. Повышение информативности прогноза ранней гипогалактии следует искать в едином стандартизованном многокомпонентном подходе к прогнозированию [2, 5]. С применением методов одномерной логистической регрессии, ROC-анализа рассчитана прогностическая ценность выделенных показателей предлактационной перестройки. Наибольшую информационную ценность в конце III триместра гестации в отношении влияния на развитие ранней гипогалактии имели следующие показатели: повышение S/D в латеральных грудных артериях (AUC=0,72, ОШ=8,94 (95%ДИ 1,57–50,87), р=0,014), выявление «репродуктивного» УЗ-морфотипа (AUC=0,66, ОШ=3,69 (95% ДИ 1,09–12,48), р=0,035), повышение уровня лептина (AUC=0,68, ОШ=3,94 (95% ДИ 1,46–8,27), р=0,013), снижение уровней ПЛ (AUC=0,71, ОШ=1,75 (95% ДИ 1,13–2,69), р=0,011) и НЭ (AUC=0,70, ОШ=1,40 (95% ДИ 1,10–1,78), р=0,006). Кроме этого, информативным является использование комплексной балльной шкалы степени тяжести ПН с расчетом итогового показателя (AUC=0,71, ОШ=1,45 (95% ДИ 1,02–2,05), p=0,039). С помощью многомерного анализа, включающего показатели гестационной предлактационной перестройки, МС, провоспалительного статуса и состояния ФПК, построена модель множественной бинарной логистической регрессии. Алгоритм расчета интегративной результирующей модели (Z) по лабораторно-инструментальным данным обследования беременной и регрессионным коэффициентам имеет следующий вид: Z= – 4,263 ЗРП + 0,098Лептин +1,426 ТГ/ХС ЛПВП + 0,042ФНОα – 0,853ПЛ + 2,077 Репродуктивный УЗ-морфотип + 2,634 S/D латеральных грудных артерий – 33,246.
Высокую прогностическую значимость модели подтверждают: AUC=0,74; Standard Error AUC=0,08; р=0,006. Качество прогнозирования ранней гипогалактии с использованием гестационной модели при точке разделения d=0,78: Se=74%, Sp=81% (р<0,05). Исходя из значения Z, осуществляется расчет вероятности реализации ранней гипогалактии (Р = ez/1 + ez): значение d>0,79 свидетельствует о высоком риске развития данной патологии и необходимости начала проведения профилактических мероприятий. Информативность отдельных предикторов и прогностической модели патологического лактогенеза представлена на рис. 1.
Полученные данные расширяют научно-практические знания о реализации адаптационно-трофической функции в послеродовом периоде при МС: нарушение предлактационной перестройки реализуется через недостаточность системы «плацента-молочные железы» на фоне гипоталамо-гипофизарной дисфункции.
Исходя из патогенеза МС и особенностей неонатального периода, очевидным является немедикаментозный подход к профилактике ранней гипогалактии. Метод должен отличаться доступностью, безопасностью и эффективностью. Контроль лактогенеза у родильниц II группы, получавших комплексный немедикаментозный метод, проводили по алгоритму обследования I группы родильниц.
УЗИ молочных желез на 4–6-е сутки показало выраженную положительную динамику на фоне проведения превентивной терапии: «лактационный» морфотип имел место у 91% (87/96) женщин (против 28,4% (25/88) в I группе); S/D в латеральных грудных артериях (правая молочная железа – 1,62 [1,49–1,72], левая – 1,63 [1,52–1,74]) был приближен к значениям группы контроля (правая – 1,51 [1,43–1,62], левая – 1,55 [1,47–1,64]) и – p>0,05 и достоверно отличался от показателей I группы (правая – 2,14 [1,79–2,63], левая – 2,19 [1,84–2,71]), что свидетельствует о благоприятном воздействии превентивного комплекса на эндокринную регуляцию, метаболические, пролиферативные процессы, кровоснабжение в молочных железах и выражается в их полноценной структурно-функциональной перестройке.
У женщин II группы было выявлено значительное повышение секреторной активности молочных желез, как на 4-е (303±30 мл), так и на 6-е сутки (501±36 мл) послеродового периода. На 4-е сутки объем молока во II группе превышал значение I группы в 1,6 раза (p<0,05), на 6-е сутки – в 1,8 раз (p<0,05), и был максимально приближен к уровню секреторной активности в контрольной группе (p>0,05).
Изучение качественного состава секрета молочных желез выявило статистически значимые различия по уровням содержания белка, молочного жира и лактозы в I и II группах сравнения, при отсутствии достоверных различий II группы с контролем. Также нами отмечена выраженная положительная динамика в клиническом течении периода лактогенеза: на 5–6-е сутки у родильниц II группы, по сравнению с родильницами I группы, были достоверно менее выражены все субъективные (4,2% против 59%) и объективные (3,1% против 72,7%) клинические признаки патологического лактогенеза. Результаты термометрии на 5–6-е сутки подтвердили значительное потепление молочных желез, по сравнению с температурой в подмышечных впадинах, у женщин II группы, аналогичное группе контроля. Данные результаты свидетельствуют об активной функциональной перестройки молочных желез, осуществившейся благодаря гормональному, пролиферативному, метаболическому, микроциркуляторному направлениям действия комплекса коррекционных мероприятий.
Исследование базального уровня ПРЛ (табл. 2) выявило статистически значимые различия в группах сравнения в пользу II группы женщин, при этом разница стимулированного ВИП-светом уровня ПРЛ с I группой на 5–6-е сутки составила 1710 мМЕ/л, разница во II группе между показателями 2-х и 5–6-х суток составила 3093 мМЕ/л (повышение на 98% против 72% в I группе). Это объясняется синергическим положительным действием компонентов метода профилактики ранней гипогалактии на уровень данного гормона. При этом, исследование базального и индуцированного уровней ПРЛ подтвердило физиологичность предлагаемого метода светотерапии ВИП-светом, так как его стимулирующее влияние проявляется только при низких показателях базального уровня ПРЛ и не проявляется – при нормальном базальном уровне данного гормона.
Оценка провоспалительного статуса и реактивного потенциала организма родильниц на 5–6-е сутки подтвердила ярко выраженное проявление терапевтического действия ВИП-света, что проявлялось снижением уровня ИЛ-6 и ЛИИ во II группе (разница с I группой составила по ИЛ-6 – 2,4 раза, по ЛИИ – 1,3 раза (р<0,05)), при этом уровень противовоспалительного ИЛ-10 превысил значения I группы в 3,2 раза (р<0,05) и контроля – в 4,4 раза (р<0,05). Это подтверждает значимое противовоспалительное и иммуномодулирующее влияние ВИП-света в составе разработанного профилактического комплекса.
Частота ранней гипогалактии у родильниц с МС во II группе составила 10,4% (10/96) наблюдений (χ2=78,59, р<0,01, по сравнению с I группой), в IIА подгруппе – 5,8% (3/52) наблюдений (χ2=42,79, р<0,01, по сравнению с IА), в IIВ – 15,9% (7/44) наблюдений (χ2=36,38, р<0,01, по сравнению с IВ). В целом, снижение частоты реализации ранней гипогалактии в II группе составило 64,6% – 7,5 раз (в IIА – 61,6% – 11,6 раз, в IIВ – 67,4% – 5,2 раз). При этом, во II группе гипогалактия I ст. тяжести была отмечена у 8,4% женщин (против 60,6% в I группе), а гипогалактия II ст. – всего у 2% (против 28,8%), гипогалактии III ст. тяжести диагностировано не было (в I группе – 10,6%), что демонстрирует значительное улучшение становления лактационной функции при МС на фоне этапной комплексной немедикаментозной профилактики. Обращает на себя внимание снижение частоты лактостаза у родильниц II группы (2% против 22,7% в I группе – в 11 раз).
Следовательно, дородовое сцеживание и светолечение ВИП-светом у родильниц с МС на этапе лактогенеза способствует нормализации как количества, так и качественного состава молока, снижению частоты и степени тяжести ранних нарушений лактации. Усиление секреторной активности происходит в результате нейро-гормонального, метаболического, иммуномодулирующего и рефлекторного механизмов действия профилактического немедикаментозного комплекса, что подтверждают данные о динамике базального и стимулированного уровня ПРЛ, термометрии молочных желез, субъективных и объективных клинических симптомов гипогалактии, балансе про- и противововспалительных цитокинов; причем, не только за счет увеличения водного компонента, что подтверждают результаты исследования белка, жира и лактозы. В целом, данный результат обнадеживает в отношении благоприятного течения лактопоэза у родильниц с МС.
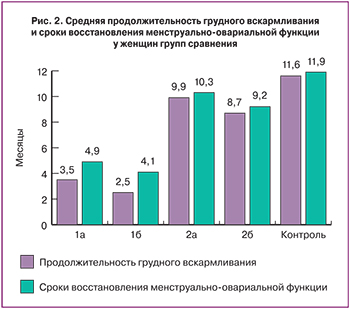
Во II группе подавляющее большинство женщин (95,8%) продолжали естественное вскармливание дольше 6-ти месяцев. Причинами отказа от продолжения кормления грудью выступали, в основном (72,9%), выход матери на работу или учебу, или достижение ребенком возраста одного года. Средняя продолжительность вскармливания у матерей II группы (рис. 2) составила 9,4±1,3 мес. (увеличилась на 6,4 мес. по сравнению с I группой).
Сроки восстановления менструально-овариальной функции во II группе составили 9,8±0,6 мес. (в I – 4,5±0,5 мес.). Полученные данные свидетельствуют о физиологичности и неагрессивности метода превентивной терапии ранней гипогалактии и отсутствии его отрицательного влияния на взаимообусловленные нейрогормональные процессы организма.
Оценка состояния здоровья детей от матерей, получавших комплекс коррекционных мероприятий, в течение первого года жизни выявила значительное снижение частоты заболеваний респираторного тракта (в 1,7 раза) и проявлений специфической иммунологической чувствительности (в 2,4 раза).
Применение методологических стандартов доказательной медицины для оценки эффективности разработанного метода профилактики ранней гипогалактии позволило получить следующие характеристики. На этапе лактогенеза: ЧИЛ=10%, ЧИК=75%, СОР=87% (ДИ 95% 76-94, р<0,05), САР=65% (ДИ 95% 53–77, р<0,05), ЧБНЛ=2 (ДИ 95% 1–2, р<0,05), ОШ=0,04 (ДИ 95% 0,02–0,1, р<0,05). На этапе лактопоэза (с учетом продолжительности естественного вскармливания более 6-ти мес.): ЧИЛ=4%, ЧИК=90%, СОР=95% (ДИ 95% 86–98, р<0,05), САР=86% (ДИ 95% 79–95, р<0,05), ЧБНЛ=1 (ДИ 95% 1–1,17, р<0,05), ОШ=0,004 (ДИ 95% 0,0008–0,009, р<0,05). Более высокие ключевые показатели эффекта превентивного вмешательства на этапе лактопоэза неоспоримо доказывают ведущую роль в полноценной реализации естественного вскармливания этапов становления лактационной функции – завершенности маммогенеза и физиологического течения лактогенеза.
Заключение
Лактация – филогенетическая реакция секреторной активности молочных желез после распада системы «мать-плацента-плод», при этом изменение адаптационных механизмов гармоничного своевременного восстановления диады «мать-новорожденный» на фоне МС по основному жизненно-важному звену – естественному вскармливанию – свидетельство серьезной нейро-эндокринно-метаболической дисфункции, реализующейся нарушением становления лактации. Женщины с МС, несомненно, относятся к группе высокого риска по патологии лактационной функции, что связано как с недостаточной предлактационной перестройкой молочных желез, так и с задержкой или неполноценным становлением секреторной активности в период лактогенеза. Высокой информативностью для обоснования начала превентивных мероприятий обладает построенная прогностическая модель риска реализации ранней гипогалактии. На основании полученных результатов обследования женщин с МС, можно констатировать, что разработанный комплексный немедикаментозный метод поэтапной превентивной терапии ранних нарушений лактации показал высокую эффективность по сравнению со стандартными базовыми мероприятиями по поддержке грудного вскармливания при данной патологии. Метод позволяет воздействовать на основные звенья патогенеза ранней гипогалактии (формирование рефлекторной составляющей, стимуляция молокообразования и молоковыделения, улучшение микроциркуляции, нормализация базального и индуцированного уровней ПРЛ, провоспалительное, иммуномодулирующее и метаболическое действие), значительно улучшая показатели лактации у женщин с таким действующим фактором высокого риска ранней гипогалактии, как МС; является доступным, безопасным и может быть рекомендован для широкого применения.



