Дефект аорто-легочной перегородки (ДАЛП) является редким врожденным пороком сердца, который представляет собой сообщение между восходящей аортой и легочным стволом, расположенное над двумя нормально сформированными полулунными клапанами [1, 2].
В изолированном виде ДАЛП встречается в 0,2% случаев врожденных пороков сердца [3, 4], причем соотношение женщин и мужчин составляет 1:3 [5]. В 52% случаев ДАЛП может сочетаться с другими сердечными аномалиями [6]. Наиболее частым сопутствующим крупным поражением сердца является перерыв дуги аорты (ПДА). Сочетание ДАЛП и ПДА встречается редко, а накопленный опыт постнатальной диагностики и хирургической коррекции данной комбинации поражений ограничивается отдельными сообщениями о случаях заболевания [3, 4, 7–11]. Сочетание с ПДА является фактором риска высокой смертности у пациентов с ДАЛП [2].
При несвоевременном вмешательстве изолированный ДАЛП может привести к сердечной недостаточности и легочной гипертензии с необратимыми изменениями легочного сосудистого русла [12]. Поэтому ранняя диагностика, особенно пренатальная, очень важна для оптимизации терапевтического и хирургического подходов. В случаях с сопутствующими пороками развития клиническая картина и время вмешательства будут зависеть от характера дополнительных аномалий. Куче и Ван Мироп сообщили о дополнительных пороках развития в 52% из 188 случаев ДАЛП [6]. Они были представлены как простыми поражениями, такими как дефекты межжелудочковой и межпредсердной перегородок, функционирующий артериальный проток, аортальный и легочный стеноз, так и более сложными аномалиями, такими как ПДА, коарктация аорты, атрезия аортального клапана, тетрада Фалло и транспозиция магистральных артерий.
Предыдущие публикации по пренатальной диагностике ДАЛП ограничиваются сообщениями о случаях изолированных или сочетанных аномалий. Во многих из данных работ диагноз был поставлен пренатально [5, 13–17]. В большинстве случаев ДАЛП можно было визуализировать в проекции трех сосудов на уровне верхнего средостения. В сложных случаях, например, с сопутствующей атрезией легочной артерии и дефектом межжелудочковой перегородки, а также транспозицией магистральных артерий, ДАЛП был выявлен только постнатально [18, 19]. Авторы утверждали, что аномальные условия ретроградного потока в легочной артерии способствовали невозможности выявления ДАЛП пренатально. Точно так же аномальное пространственное взаиморасположение магистральных артерий может существенно затруднять возможность пренатальной диагностики данного порока [19]. Авторы смогли визуализировать дефект только на серии сагиттальных срезов путем ретроспективного анализа сохраненных в памяти УЗ-аппарата данных.
Richardson et al. предложили наиболее удобную классификацию, согласно которой ДАЛП можно разделить на три типа [19]. При типе 1 имеется простой дефект, расположенный между восходящей аортой и стволом легочной артерии, непосредственно над синусами Вальсальвы. При типе 2 дефект располагается более дистально между восходящей аортой и легочным стволом с распространением в устье правой легочной артерии. При 3-м типе наблюдается аномальное отхождение правой легочной артерии от восходящей аорты. Наиболее частой формой ДАЛП является тип 1 [21].
Хотя ДАЛП можно считать конотрункальным пороком, мы не смогли найти никаких сообщений о его ассоциации с микроделецией 22q11 (синдромом Ди Джорджи) или другими генетическими синдромами, включая велофациокардиальные синдромы. В отличие от других конотрункальных пороков развития, таких как общий артериальный ствол с ПДА, риск ассоциированных хромосомных аномалий при ДАЛП, включая микроделецию 22q11, кажется низким [20, 21].
В данной статье нам хотелось бы представить два случая пренатальной диагностики ДАЛП за последние 3 года в двух крупных федеральных центрах пренатальной диагностики – ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» Минздрава России и ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Случай 1
22-летняя женщина (беременность 1, роды 0) была направлена в Перинатальный кардиологический центр ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» Минздрава России на 25-й неделе беременности с подозрением на врожденный порок сердца (ВПС) у плода – тетраду Фалло.
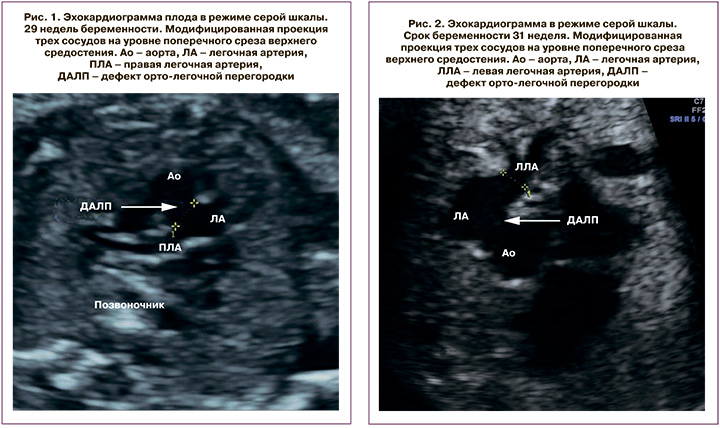
Семейный анамнез пациентки не был отягощен. Толщина воротникового пространства в I триместре составила 1,6 мм. Анатомическое исследование плода на сроке 21 недели гестации было нормальным, за исключением анатомии сердца, после чего женщину направили на экспертную эхокардиографию (ЭхоКГ) плода. Фетальная ЭхоКГ в нашем Центре показала нормальное расположение внутренних органов (situs solitus) и нормальное положение оси сердца в грудной клетке. Атриовентрикулярные и вентрикулоартериальные соединения были конкордантными. Проекция четырехкамерного сечения была без особенностей, в пятикамерной проекции был выявлен перимембранозный дефект межжелудочковой перегородки. Проекция трех сосудов и трахеи выявила нормальное соотношение легочной артерии, аорты и верхней полой вены. Тем не менее поперечные срезы выводного тракта правого желудочка на уровне восходящей аорты позволили выявить немалый дефект (3,9 мм) между восходящей аортой и легочной артерией (рис. 1). Обе ветви легочной артерии были визуализированы в типичном месте и выглядели нормально. Дефект артериальной стенки был тотальным и распространялся до устья правой легочной артерии (ДАЛП 1 типа по классификации Richardson et al. [19]). Цветовое допплеровское картирование (ЦДК) показало двунаправленный поток крови через дефект, что подтвердило наличие ДАЛП. Семья была проконсультирована кардиохирургом, проинформирована о необходимости проведения кардиохирургического вмешательства после рождения и вероятности хорошего долгосрочного прогноза для жизни и здоровья ребенка.
Проведенная после рождения ребенка мультиспиральная компьютерная томография с контрастной ангиографией подтвердила диагноз ДАЛП. Ребенок был успешно прооперирован в Центре и выписан в удовлетворительном состоянии домой на 11-е сутки под наблюдение кардиолога по месту жительства.
Случай 2
34-летняя женщина (беременность 1, роды 0) была направлена в отделение ультразвуковой диагностики ФГБУ «НМИЦ АГП имени академика В.И. Кулакова» Минздрава России на 31-й неделе беременности из‐за аномальных срезов на уровне четырех камер и выводных трактов желудочков во время рутинного сканирования. Семейный анамнез пациентки был без особенностей. Комбинированный скрининг I триместра был нормальным. УЗ-скрининг II триместра выявил гиперэхогенный фокус диаметром 1,5 мм в правом желудочке сердца. В 30 недель беременности по месту жительства заподозрен критический ВПС, выявлено многоводие.
Экспертная эхокардиография плода на 31-й неделе беременности показала situs solitus с конкордантными атриовентрикулярными и вентрикулоартериальными соединениями. Сердце плода было нормального размера, четко визуализировались два правильно сформированных сосудистых клапана без признаков стеноза и препятствия на уровне выходных трактов желудочков. На срезе трех сосудов и трахеи наблюдалось широкое сообщение между аортой и стволом легочной артерии (рис. 2).
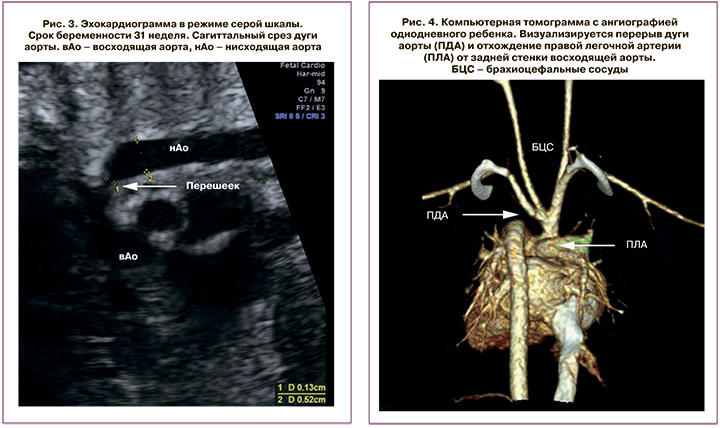
ЦДК показало двунаправленное шунтирование, подтверждающее наличие ДАЛП. Левая легочная артерия была выделена отдельно и выглядела нормально (тип 3). Визуализация устья правой легочной артерии не представлялась возможной. На уровне Y-соединения перешейка аорты и артериального протока перешеек был представлен в виде тонкого тяжа (рис. 3), практически не картирующегося в режиме ЦДК. На сагиттальных срезах дуги аорты был заподозрен диагноз сопутствующего ПДА. Оценка экстракардиальных структур не выявила сочетанной патологии. Последующее сканирование в 36–37 недель беременности подтвердило диагноз ПДА. Женщина была родоразрешена через естественные родовые пути на сроке 39+6 недель беременности. Новорожденная девочка весом 3880 г была оценена по шкале Апгар в 8/9 баллов в 1-е минуты жизни. Для дальнейшего лечения и дообследования ребенок был переведен в отделение экстренной хирургии новорожденных ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» Минздрава России.
Мультиспиральная компьютерная томография с контрастной ангиографией ребенка подтвердила диагноз ДАЛП в сочетании с ПДА, но также было установлено отхождение правой легочной артерии от восходящей аорты (рис. 4).
Ребенку была выполнена пластика дефекта аорто-легочной перегородки ксеноперикардиальной заплатой, коррекция ПДА в условиях искусственного кровообращения, гипотермии и фармакохолодовой кардиоплегии. К сожалению, ребенок погиб на 5-е сутки после операции на фоне полиорганной недостаточности.
Обсуждение
ДАЛП можно лучше всего продемонстрировать с помощью плоскости, перпендикулярной плоскости самого отверстия, т. е. через боковую стенку грудной клетки плода, а не прямо через переднюю или заднюю стенки. Эта плоскость сканирования также позволяет лучше продемонстрировать поток крови через дефект в режиме ЦДК. Менее вероятно, что ДАЛП будет идентифицироваться на уровне трехсосудистого среза в случаях с сопутствующими сердечными аномалиями, которые, по сути, не позволят одновременно визуализировать аорту и легочную артерию в трехсосудистом срезе. В некоторых случаях могут быть полезными и информативными сагиттальные срезы.
В наших двух наблюдениях плоды имели нормальную толщину воротникового пространства при ультразвуковом скрининге в I триместре и низкие риски комбинированного теста на хромосомную патологию. Кариотип, включая оценку микроделеции 22q11, был нормальным у обоих плодов. Это очень важное обстоятельство для семейного консультирования.
Прогноз для жизни при изолированном ДАЛП в целом благоприятный [2], а операционная смертность низкая. Исход хирургического вмешательства зависит главным образом от наличия сопутствующих пороков развития сердца и от того, насколько своевременно выполнена операция [2, 22, 23]. Сопутствующие сложные врожденные пороки сердца могут быть плохим прогностическим фактором [23]. Например, в одной из серии наблюдений [11] ПДА был независимо ассоциирован с повышением смертности. В то же время полная коррекция ДАЛП с ПДА может быть выполнена при низкой летальности в неонатальном периоде.
Пациенты со сложными ассоциированными поражениями также подвергаются большему риску поздней смерти. Повторные вмешательства иногда показаны при стенозах как легочной артерии, так и аорты, а также связаны со специфическими сопутствующими поражениями [2, 23]. При последующем наблюдении остаточные поражения чаще наблюдаются у пациентов с ДАЛП 3 типа и могут потребовать ранней повторной операции [24].
Без пренатальной диагностики смерть может наступить до хирургической коррекции порока в случаях критической обструкции путей оттока левого желудочка. Как правило, изолированный дефект бывает большим, что приводит к шунтированию крови слева направо и вызывает сердечную недостаточность, что связано с высоким систолическим давлением в легочной артерии. Если постнатальная диагностика запаздывает, то существует риск развития легочно-сосудистых заболеваний с повышенной заболеваемостью и смертностью. Показанием к ранней оперативной коррекции порока является сам факт наличия данного ВПС, даже при наличии сопутствующих сердечно-сосудистых аномалий [24]. В случае пренатальной диагностики ВПС, при небольших размерах дефекта аорто-легочной перегородки и отсутствии сопутствующего критического поражения операция может быть выполнена в плановом порядке в неонатальном периоде.
Заключение
Как показывает наш опыт и опыт зарубежных коллег, пренатальная диагностика ДАЛП возможна. Связь между аортой и легочной артерией может быть определена с помощью стандартного трехсосудистого среза и заподозрена во время рутинного скрининга II триместра.



