В современных условиях внедрение в акушерскую практику комбинированного биохимического скрининга позволило прогнозировать развитие ряда осложнений при беременности. В клинической практике изначально маркеры сыворотки крови изучались для скрининга хромосомных аномалий плода. При этом в настоящее время они также используются в качестве метода диагностики нарушений плацентации, таких как преэклампсия и синдром задержки роста плода [1].
Известно, что в сыворотке крови матери низкие уровни ассоциированного с беременностью протеина А (PAPP-A) в I триместре беременности связаны с повышенным риском развития задержки роста плода или рождения маловесного плода [2–4].
Ряд проведенных исследований показал прямую корреляцию высокого уровня содержания РАРР-А в I триместре беременности и макросомии плода [5–8]. Chełchowska М. et al. обнаружили корреляцию концентрации РАРР-А в плазме крови беременной и веса плода как в I, так и во II и III триместрах беременности [9]. По данным Schwartz N. et al., размер плаценты при родах коррелирует с массой тела новорожденного, указывая на ее роль в развитии макросомии плода [10]. В то же время между содержанием этого гликопротеина в пуповинной крови и весом плода имелась реципрокная связь [11].
Вместе с тем, в других исследованиях не удалось подтвердить связи макросомии с уровнем РАРР-А и/или β-субъединицы хорионического гонадотропина человека (β-ХГЧ) в I триместре беременности [12, 13]. По данным Monari F. et al. (2021), точность прогнозирования повышает одновременный учет таких факторов, как паритет родов и индекс массы тела [14].
Таким образом, имеющиеся в настоящее время данные о связи биохимических маркеров I триместра беременности и макросомии плода противоречивы, и требуются дальнейшие исследования для уточнения возможности прогнозирования формирования крупного плода с их помощью.
Цель исследования: определение взаимосвязи показателей пренатального скрининга I триместра с развитием крупного плода.
Материалы и методы
Нами проведено ретроспективное когортное исследование с анализом 9672 историй родов с 2022 г. по 2023 г. из электронной базы ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Критериями включения в исследование явились: первые роды, возраст от 18 до 40 лет, одноплодная беременность, наступившая самопроизвольно, головное предлежание плода, доношенный срок беременности, нормальные значения индекса массы тела, прибавка массы тела за период беременности менее 12 кг, родоразрешение, произошедшее в ФГБУ «НМИЦ АГП им. В.И. Кулакова».
Критериями невключения служили: ожирение, прибавка массы тела за период беременности более 12 кг, тяжелая соматическая патология женщин, осложненное течение беременности (преэклампсия, гестационная артериальная гипертензия, гестационный сахарный диабет), аномалии развития женских половых органов, пороки развития плода, многоплодная беременность.
Клинико-анамнестические данные, характер течения беременности женщин, а также состояние детей при рождении были получены из архивных записей историй родов и историй новорожденных.
Все женщины прошли комбинированный пренатальный скрининг I триместра на сроке беременности 11+1–13+6 недель. Мы произвели оценку уровней β-ХГЧ, PAPP-A, плацентарного фактора роста (PlGF). После забора крови из локтевой вены беременной показатели β-ХГЧ, PAPP-A, PlGF определяли в сыворотке крови методом иммуноферментного анализа (DELFIA Хpress, США) и соответствующими наборами реагентов DELFIA Xpress kit (Wallac Oy, Турку, Финляндия). Поскольку на концентрацию плацентарных гормонов оказывает влияние срок гестации, определяемый по копчико-теменному размеру плода, возраст и антропометрические данные матери, данные ее анамнеза, при помощи программы Astraia Software Version 2.8 (Германия) был проведен перевод абсолютных значений в значения, кратные медианам. Показатели считались референсными в диапазоне от 0,5 до 2,0 МоМ.
Критериям включения соответствовали 408 женщин. Все обследованные женщины после прохождения отбора по критериям включения были разделены на две группы: 1-я группа, основная (n=298), включала новорожденных с массой тела до 4000 г; 2-я группа, сравнения (n=110), – новорожденных с массой тела 4000 г и более.
В качестве первичного изучаемого исхода служило определение различий изучаемых маркеров между группами; в качестве вторичного изучаемого исхода – определение связи между содержанием маркеров скрининга I триместра и крупными размерами плода.
Проведение исследования было одобрено локальным этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Статистический анализ
Статистическую обработку полученных результатов проводили с помощью статистических программ IBM SPSS Statistics 22 for Windows и MedCalc Statistical version 22.007 for Windows. Проверку гипотезы о нормальном распределении осуществляли, используя критерий Шапиро–Уилка. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1; Q3). Для проверки равенства дисперсий перед применением параметрических методов статистики использовали критерий Фишера. Категориальные данные описывались с указанием абсолютных значений и процентных долей. Качественные показатели описывались с помощью абсолютных значений и процентов, для сравнения групп между собой использовали критерий хи-квадрат (χ2) Пирсона. Различия считали статистически значимыми при р<0,05. Корреляционный анализ выполняли с помощью рангового коэффициента Спирмена, различия считали значимыми при р<0,05.
Результаты
Нами не было выявлено различий при сравнении исследуемых групп по возрастным показателям, средним значениям индекса массы тела и общей прибавке массы тела за период беременности.
Нами не было выявлено различий между группами в частоте и структуре соматических заболеваний, данных гинекологического анамнеза и течения беременности, что представлено в таблице 1.
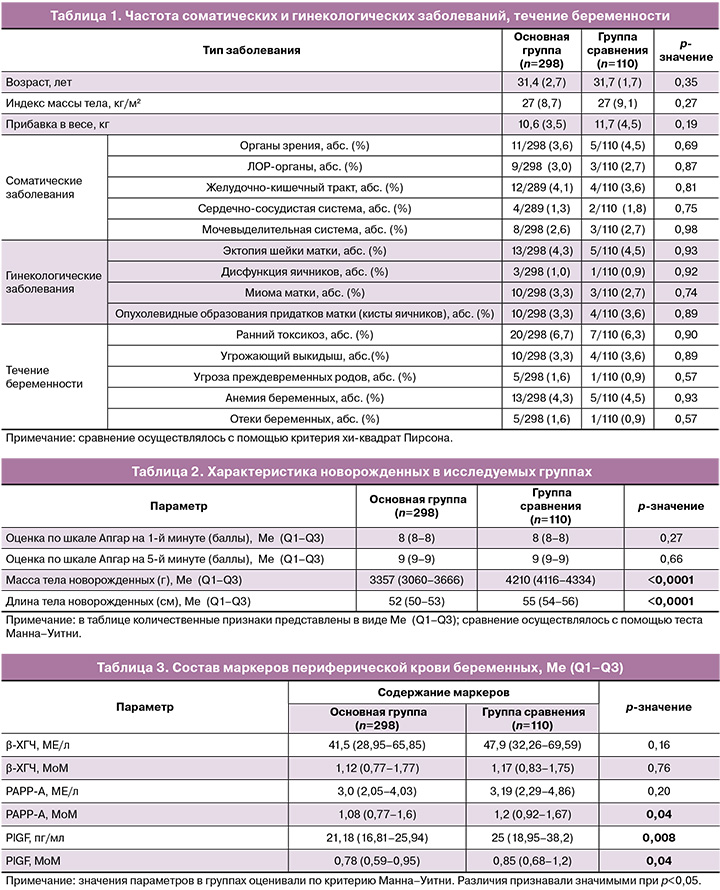
Срок беременности на момент родоразрешения не отличался в группах, и в основной группе составил 278,3 (2,7) дня – 39 недель 5 дней против 278,8 (1,9) дня, или 39 недель 5 дней, в группе сравнения (р=0,32).
Во всех наблюдениях родились живые дети. Оценка по шкале Апгар на 1-й минуте значимо не различалась (р=0,27). На 5-й минуте различия между группами также не обнаружены (р=0,66). Оценка антропометрических данных новорожденных закономерно выявила значимо большую массу и длину тела в группе крупного плода (р<0,0001). Характеристика групп новорожденных представлена в таблице 2.
На первом этапе мы провели сравнительный анализ содержания β-ХГЧ, PAPP-A, PlGF в основной группе и группе сравнения. Полученные нами данные показали, что содержание PAPP-A (МоМ), PlGF (пг/мл) и PIGF (МоМ) было значительно выше в группе с крупными размерами плода (табл. 3).
Для оценки взаимосвязи биохимических показателей с массой тела при рождении проведен корреляционный анализ (табл. 4).
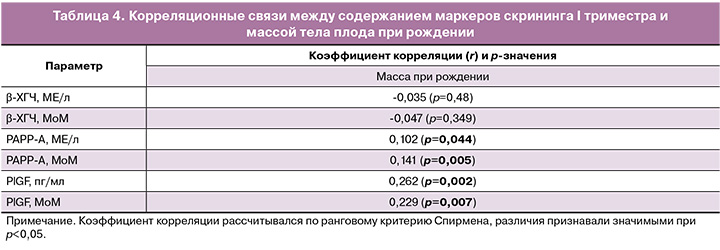
Анализ обнаружил очень слабую связь между крупными размерами плода и PAPP-A (МоМ), PlGF (МоМ) и слабую связь с PlGF (пг/мл). Оценка взаимосвязи биохимических показателей с массой плода показала очень слабую связь с PAPP-A (МЕ/л) и PAPP-A (МоМ), и слабую связь с PlGF (пг/мл) и PlGF (МоМ).
Обсуждение
В нашем исследовании мы изучили взаимосвязь показателей пренатального скрининга I триместра с риском развитием крупного плода. Известно, что возраст беременной старше 35 лет, индекс массы тела более 29 кг/м2, прибавка за период беременности в весе более 10 кг, паритет родов более двух являются факторами риска формирования крупного плода [15–17]. В связи с чем в нашем исследовании были целенаправленно взяты первородящие женщины с нормальными значениями индекса массы тела и прибавки в весе за период беременности, что позволило исключить влияние этих факторов и изучить только плацентарные факторы риска.
Из литературы известно, что уровень PAPP-A <0,4 ммоль и β-ХГЧ <0,3 МоМ коррелирует с высоким риском рождения плода, маловесного к сроку гестации [18]. В нашем исследовании мы не обнаружили различий в содержании β-ХГЧ в исследуемых группах. Однако нами выявлены различия в содержании PAPP-A (МоМ), PlGF (пг/мл) и PlGF (МоМ).
PAPP-A представляет собой цинксодержащую металлопротеиназу, принадлежащую к суперсемейству метцинцина. Концентрация PAPP-A увеличивается с течением беременности до родов. Низкие уровни протеазы в течение I триместра беременности у беременных без хромосомных аномалий связаны с неблагоприятными перинатальными исходами, включая задержку внутриутробного развития, выкидыш и низкий вес при рождении [19]. Ozdemir S. et al. в своем исследовании показали, что уровень PAPP-A (MoM) положительно коррелировал с массой плода при рождении (p=0,04) [20]. Полученные нами данные демонстрируют, что уровень PAPP-A (МоМ) у женщин с крупными размерами плода составлял 1,2 и был значительно выше, чем у женщин с нормальными размерами плода (1,08) (р=0,04). Похожие результаты приводят Tul N. et al., которые показали, что содержание PAPP-A (МоМ) в диапазоне 0,76 МоМ характерно для маловесных новорожденных (р=0,002), а 1,12 МоМ – для крупного плода (р=0,03) [21].
Особый интерес вызвало изучение PlGF, поскольку плацента является основным его источником [22]. Известно, что циркулирующие уровни PlGF заметно повышаются во время беременности; при этом PlGF индуцирует пролиферацию, миграцию и активацию эндотелиальных клеток, играя тем самым центральную роль в развитии и созревании плацентарной сосудистой системы и кровообращения [23]. Кроме того, показано, что PlGF играет роль в развитии и функционировании сосудистой сети плаценты [24]. Уровень PlGF увеличивается с ранних сроков беременности до 29–32 недель и в дальнейшем снижается. Это отражает снижение выработки PlGF синцитиотрофобластом и трофобластом в III триместре беременности, поскольку плацента становится «старее» и понижает свои функциональные способности [25]. Ранее проведенные работы показали, что в I триместре беременности очень низкие показатели PlGF в сыворотке крови матери 111,5 мкмоль/л способствуют развитию декомпенсированных форм плацентарной недостаточности и преждевременному прерыванию беременности (r=0,89, р<0,01) [26]. Полученные нами данные показали, что при крупных размерах плода содержание PlGF значительно выше, чем при нормальных (25 против 21,18 пг/мл, р=0,008 или 0,85 против 0,78 МоМ, р=0,04). Похожие результаты приводят в своем исследовании Zbucka-Kretowska M. et al., которые показали, что у крупных плодов отмечено более высокое содержание PlGF (р=0,04) [27].
Кроме того, нами обнаружена прямая корреляционная связь изучаемых нами маркеров с массой при рождении.
Заключение
Полученные данные показали, что уже на этапе первой волны инвазии трофобласта формируются ассоциации для развития макросомии. Однако, по-видимому, для ее реализации необходимо сочетание с другими предрасполагающими факторами (индекс массы тела более 29 кг/м2, прибавка за период беременности в весе более 10 кг, гестационный сахарный диабет, паритет родов более двух).
К сильной стороне настоящего исследования относится то, что это первое отечественное исследование, показавшее взаимосвязь указанных маркеров с макросомией плода. Одним из основных ограничений настоящего исследования является то, что размер выборки был относительно небольшим.
Таким образом, дальнейшее изучение показателей пренатального скрининга I триместра поможет выделить группу риска для разработки мер профилактики макросомии плода у первородящих женщин.



