Нарушение репродуктивной функции у женщин – бесплодие и невынашивание беременности – является не только медицинской, но и социальной проблемой. Первичное бесплодие в России охватывает 1,9% всех женщин 20–44 лет, что совпадает со среднемировым показателем. Вторичным бесплодием страдают 3,2% женщин (для сравнения: в США, Норвегии и Финляндии эта доля составляет 1%, то есть втрое ниже) [1]. В 2013 году самопроизвольно прервалось 207 667 беременностей, то есть каждая 10-я желанная беременность оказалась нереализованной [2].
Среди причин бесплодия и невынашивания беременности основным является инфекционно-воспалительный фактор, нередко приводящий к хроническому течению заболевания, что сопровождается окклюзией маточных труб, хроническим эндометритом, снижением функциональной активности яичников, формированием «тонкого» эндометрия.
Наличие самопроизвольных абортов в анамнезе, особенно повторных, снижает шансы на рождение ребенка более чем в 2 раза (после 2 и более выкидышей ОР=2,27: 95% ДИ: 1,98-2,81) [3], а эффективность различных методов лечения бесплодия невысока: при трубно-перитонеальном не превышает 10–25%, при эндокринных формах – 50–80%, при использовании методов вспомогательных репродуктивных технологий на один лечебный цикл – 20–35% [4]. Это диктует необходимость поиска новых направлений в лечении нарушений репродуктивной функции у женщин.
Одним из наиболее эффективных немедикаментозных методов лечения гинекологических больных является пелоидотерапия [5–7], особенно ее интравагинальное применение [8, 9]. В связи с этим были разработаны одноразовые инъекторы с гелем на основе лечебной грязи Мертвого моря (ЛГММ) для амбулаторного применения во внекурортных условиях.
Отчеты о первых клинических исследованиях (КИ) по использованию вагинальных тампонов с ЛГММ при гинекологических заболеваниях появились в отечественной литературе 10 лет назад. Они носили описательный характер, были основаны на исследовании серии случаев и отличались небольшим количеством наблюдений. Обобщение результатов этих исследований сделано коллективом авторов в 2008 году [10], где были представлены данные о клинической эффективности ЛГММ [8].
Публикации за последние 5 лет свидетельствуют о высоком интересе исследователей к внекурортному лечению с помощью ЛГММ и существенном улучшении качества исследований. Большинство из них имеют уровень доказательности В (отдельные рандомизированные контролируемые и проспективные сравнительные КИ), что по классификации надежности доказательств (Формулярный комитет РАН, российская система стандартизации в здравоохранении) характеризуется средним уровнем (есть достаточно доказательств в пользу того, чтобы рекомендовать данное предложение) [11], в отличие от предшествующих КИ.
Цель: провести анализ отечественных исследований, выполненных среди женщин с нарушениями репродуктивной функции, в восстановительном лечении и реабилитации которых использовалась ЛГММ, и определить ее клиническую эффективность, лечебные эффекты и механизмы действия.
Материал и методы исследования
Источники данных. Поиск работ осуществлялся в электронных базах данных свободного доступа и eLIBRARY.RU по ключевым словам, а также на сайте научной электронной библиотеки диссертаций и авторефератов disserCat.
Выбор исследований. Были отобраны КИ, касающиеся применения ЛГММ в гинекологической практике, включая отчеты, диссертации, опубликованные статьи о клинических и экспериментальных исследованиях.
Методика лечения. Интравагинальное введение геля на основе ЛГММ из инъекторов по 60 мл с помощью катетеров, входящих в комплект («БиЛайфМед», Израиль), экспозиция 20 мин, на курс 10–12 процедур, начиная с 6–8-го дня менструального цикла (по окончании процедуры препарат удаляется из влагалища путем спринцевания кипяченой водой t=36–37°С). В плацебо-контролируемых исследованиях – использование плацебо-препарата (индифферентный водорастворимый гель на основе гидроксиэтилцеллюлозы и красителя, по консистенции, цвету и запаху идентичный оригинальному).
Критерии включения в обзор. КИ, содержащие результаты применения геля на основе ЛГММ в виде инъекторов для внекурортного применения по стандартной методике у больных гинекологического профиля, содержащих по крайней мере один симптом (показатель) конкретного клинического критерия оценки, опубликованные в 2010–2015 гг.
Для анализа были отобраны 8 КИ, отвечающие заданным критериям, из них опубликованные в рецензируемых изданиях – 5, в не рецензируемых – 1, диссертационных – 2. Из них рандомизированных слепых плацебо-контролируемых – 2, когортных простых, сравнительных или плацебо-контролируемых – 6.
Материал. Общее количество наблюдений составило 826. Из них: количество пациентов, получавших лечение с применением ЛГММ – 455, другое лечение (группы сравнения) – 237, плацебо (контроль) – 60, не получавшие (контроль) – 74.
Изучаемые заболевания и состояния: хронические воспалительные заболевания органов малого таза (ХВЗОМТ), синдром хронической тазовой боли, трубно-перитонеальная форма бесплодия (ТПБ), бесплодие эндокринного генеза, хронический эндометрит (ХЭ), недостаточность лютеиновой фазы (НЛФ), состояние после потери беременности в ранние сроки (самопроизвольного выкидыша), состояние после реконструктивно-пластических операций на маточных трубах. Во всех случаях диагноз был подтвержден с помощью лапароскопии, гистеросальпингографии, биопсии эндометрия, тестами функциональной диагностики, неполноценной секреторной трансформацией эндометрия по данным гистологического исследования.
Исследуемые клинико-функциональные и лабораторные показатели: объективные данные гинекологического осмотра, болевой синдром, параметры менструального цикла (безболезненность, цикличность, отсутствие мажущих кровянистых выделений), кровоток в сосудах малого таза, содержание гонадотропных и стероидных гормонов в сыворотке крови, частота овуляторных циклов, секреторная трансформация эндометрия, соответствие эндометрия фазе цикла, морфологическая структура эндометрия, частота наступления беременности, результаты ЭКО, биоценоз влагалища.
Изучаемые лечебные эффекты. На основании полученных результатов оценки данных судили о противовоспалительном, обезболивающем, дефиброзирующем (адгезиолитическом), трофическом, улучшающем гормональную функцию яичников, бактерицидном действии ЛГММ.
Статистическая обработка. Во всех исследованиях использовалась стандартная методика оценки различий относительных величин с помощью параметрического t-критерия Стьюдента, анализ таблиц сопряженности (χ2). При частотах меньше 5 применялся двусторонний точный критерий Фишера р. За статистически значимые принимались различия при величине достоверности p≤0,05. В некоторых работах определялось отношение шансов (ОШ), которое описывает меру эффекта воздействующего фактора. Для демонстрации силы связи вычисляли 95% доверительный интервал (95% ДИ). Если значения ДИ были выше 1,0, то изучаемый признак являлся фактором эффективности применяемого воздействия.
Результаты исследования
Н.В. Артымук с соавт. [12] провели КИ (проспективное рандомизированное слепое плацебо-контролируемое) у женщин с НЛФ (n=40: 20 – получали ЛГММ и 20 – плацебо). ТПБ наблюдалось в I группе – у 55% женщин, во II – у 40%, эндокринное – у 45% и 60% соответственно (р>0,05).
Частота ановуляторных циклов после лечения в I группе составила 55% (80% – во II, р<0,05), через 3 мес – 40 и 90% соответственно (р<0,001).
Пелоидотерапия не оказывала влияния на уровни ФСГ, ЛГ, пролактина, тиреотропного гормона и тестостерона. Концентрация эстрадиола (пг/мл) в плазме крови была в I группе до лечения 30,5±7,5 (во II группе – 32,4±6,9; р<0,05), после лечения – 57,6±7,4 (р<0,05) (35,1±7,2; р<0,05), через 3 месяца – 43,5±8,6 (до лечения р<0,05, после лечения р<0,05) (39,1±8,1; р>0,05) соответственно. Концентрация прогестерона (нмоль/л) в I группе была до лечения 12,3±5,1 (во II группе – 12,8±5,5; р<0,05), после лечения – 25,7±5,5 (р<0,001) (13,5±5,3; р<0,05), через 3 месяца – до лечения – 17,1±4,8 (р<0,05), после лечения – 15,5±5,2 (р>0,05) соответственно.
То есть, у пациенток I группы после пелоидотерапии отмечалось увеличение содержания эстрадиола и прогестерона в 2 раза (при отсутствии динамики – во II группе). Через 3 месяца отмечалось снижение уровня обоих гормонов, однако их содержание оставалось значимо выше, чем до пелоидотерапии.
В этом же исследовании анализ кривых скоростей кровотока в средине II фазы до и после лечения показал, что ЛГММ способствует ускорению кровотока в яичниковых артериях на стороне формирования желтого тела, о чем свидетельствовало статистически значимое снижение систоло-диастолического отношения с 8,6±2,1 до 5,6±2,2 после лечения (р=0,019). С противоположной стороны имело место увеличение индекса резистентности: с 0,85±0,1 до 0,98±0,2 (р=0,013). Статистически значимого изменения других показателей не установлено.
Через 12 месяцев после однократного курса лечения ЛГММ наступила беременность у 60% пациенток, в группе сравнения – у 20% (p<0,001).
Эффективность ЛГММ в лечении бесплодия изучала Т.А. Устинова (рандомизированное сравнительное простое слепое плацебо-контролируемое КИ) (n=160) [13]. ЛГММ назначалась женщинам с ТПБ в сочетании с эндокринным фактором (СПКЯ и НЛФ, n=100 (после оперативного вмешательства) и только НЛФ, n=40; n=20 – контроль).
Частота ановуляции статистически значимо снижалась после применения ЛГММ с 42 до 15% (р<0,001), в группе плацебо – снижалась статистически незначимо и составила 35% (р=0,67; р=0,04), повышалась частота полноценной секреторной трансформации эндометрия с 34 до 72% (р<0,001) против с 25 до 45% (р=0,21; р=0,04) соответственно.
В течение 1 года после пелоидотерапии у 44% пациенток основной группы наступила беременность (против 20% в плацебо-группе, р=0,049). Более высокая частота наступления беременности наблюдалась у женщин с эндокринным бесплодием (66 и 75%), чем с ТПБ (34 и 25%). Около половины беременностей (47,7%) наступили в первые 3 месяца после лечения.
После оперативного вмешательства лечение ЛГММ приводит к статистически значимому увеличению частоты овуляторных циклов – 45% против 10% (р=0,03) соответственно. Частота наступления беременности при НЛФ составила 50% против 15% (р=0,04) соответственно. Расчеты показали, что повышение абсолютной пользы при применении интравагинальной пелоидотерапии составило 35%, повышение относительной пользы – 230%. ОШ вероятности получения положительного результата при использовании ЛГММ по сравнению с плацебо составило 5,7 (95% ДИ 1,3–24,6).
И.Н. Носковой (проспективное открытое когортное КИ) [14] ЛГММ применена в качестве преконцепционной подготовки женщин с потерей беременности в ранние сроки в анамнезе (n=40: 20 – получали лечение ЛГММ, 20 – контроль, не получали лечения). Через 3 месяца после выкидыша нормализация менструального цикла чаще была на фоне реабилитации пелоидами (в 1-м и 3-м цикле – 30,0 и 72,2%; р=0,022; между I и II группами в 3-м цикле – 72,2 и 27,8%; р=0,018).
По данным гистологического исследования на 20–22-й день 4-го менструального цикла после прерывания беременности у женщин, прошедших преконцепционную подготовку, чаще отмечалось соответствие эндометрия фазе цикла (55,5 и 16,7%; р=0,035) и уменьшилась частота ХЭ (16,7 и 55,5%; р=0,035). НЛФ также встречалась в 2 раза реже – 38,9 против 61,1%.
В течение года после завершения реабилитации беременность наступила у 85% женщин, применявших ЛГММ и у 40% – в контроле (р=0,008). Повышение абсолютной пользы при применении пелоида составило 45%, повышение относительной пользы – 113%. Чтобы достичь беременности у одной женщины в течение 1 года, необходимо лечить данным способом двух пациенток. ОШ вероятности получения положительного результата при использовании пелоида по сравнению с традиционным лечением составило 8,5 (95% ДИ: 1,88–38,47). Беременность завершилась срочными родами у 65% пациенток, применявших пелоиды и у 30% женщин в контроле (р=0,058).
В исследовании Т.Е. Белокриницкой с соавт. (когортное проспективное сравнительное КИ) [15] среди 118 пациенток преобладали ТПБ и/или маточная (ХЭ) причины бесплодия и НЛФ в различных сочетаниях. При этом часть женщин готовились к процедуре ЭКО. 44 женщины получили лечение ЛГММ, 47 – отказались от него и получали фонофорез с лидазой и ультразвуковую терапию, 27 – отказались от всех видов физиотерапии, мотивируя это тем, что они планируют ЭКО.
Исчезновение/уменьшение боли внизу живота и пояснично-крестцовой области было достигнуто у 73 и 60% женщин 1-й и 2-й групп (ОШ=1,8; 95% ДИ: 0,6–4,0); уменьшение болевых ощущений при физической нагрузке и при гинекологическом исследовании – у 41 и 32% соответственно (ОШ=1,5; 95% ДИ: 0,4–3,4). Отмечено значительное уменьшение или исчезновение тяжистости в сводах влагалища у 32 и 26% соответственно (ОШ=1,4; 95% ДИ: 0,3–3,3); нормализация консистенции и подвижности матки и придатков – у 43 и 17% (ОШ=3,7; 95% ДИ: 1,3–6,2); улучшение состояния эндометрия при ХЭ – у 57 и 6% соответственно (ОШ=19,3; 95% ДИ: 3,0–11,6).
Восстановление уровня гормонов произошло у 11 и 2% пациенток соответствующих групп (ОШ=5,9; 95% ДИ: 1,8–10,8); восстановление овуляции – у 16 и 2% соответственно (ОШ=8,7; 95% ДИ: 2,2–11,7).
Благодаря достигнутым первичным эффектам в течение 1 года после проведенного лечения наступление беременности констатировано у 39% женщин в I группе и 11% – во II (р=0,004), ОШ=5,3 (95% ДИ: (1,7–7,5), из них беременность наступила спонтанно у 21 и 2% (р=0,014).
Таким образом, один курс интравагинального введения грязей Мертвого моря повышал шанс наступления беременности в 5,3 раза.
Лечение бесплодия при помощи ЭКО проведено у 52% пациенток. В I группе беременность наступила у 40% пациенток против 29% во II (ОШ=1,7; 95% ДИ 0,5–5,4) и 15% – в III (ОШ=3,8; 95% ДИ 1,3–6,8).
Таким образом, применение ЛГММ повысило шансы наступления беременности при ЭКО в 1,7 раза по сравнению с применением фонофореза и ультразвука и в 3,8 раза – по сравнению с отказавшимися от физиотерапии.
Те же авторы (проспективное когортное КИ) [11] сравнили действие ЛГММ у женщин с ТПБ, планирующих ЭКО (n=56), из них 29 предварительно получали лечение ЛГММ, а 27 отказались от него.
Основными причинами бесплодия было сочетание ТПБ и ХЭ: 52 и 44% соответственно в I и II группах (р>0,05). На втором месте по частоте было только ТПБ – 31 и 41% (р=0,05), реже – ТПБ с НЛФ: 17 и 15% (р=0,05).
Частота морфологических признаков ХЭ после лечения снизилась в 2,5 раза: с 52 до 21% (p=0,0139). Восстановление параметров менструального цикла и секреторной трансформации эндометрия отмечено у 60% пациенток с НЛФ, уровней гормонов яичников: эстрадиола – у 30%, прогестерона – у 38%.
Беременность после ЭКО наступила у 59 против 15% у женщин соответствующих групп (p=0,002; OШ=4,0; 95% ДИ: 1,14–6,33). В подгруппе с ТПБ и ХЭ эффективность ЭКО после преконцепционной пелоидотерапии была в 2,7 раза выше – 40 против 15% (OШ=2,7; 95% ДИ: 0,15–5,55).
Показательные результаты также были получены и в КИ (проспективное сравнительное когортное), выполненном Г.И. Василенко с соавт. [16] у 80 женщин с ТПБ, в том числе после реконструктивно-пластических операций на маточных трубах, получавших реабилитацию (n=40 – стандартный курс был дополнен ЛГММ, n=40 – лечение без ЛГММ). После лечения отмечена положительная динамика со стороны эндометрия у 89% пациенток 1-й группы и у 62% – во 2-й. Гормональный ответ на воздействие ЛГММ состоял в статистически значимом увеличении содержания в сыворотке крови прогестерона (нмоль/л) – с 8,5±3,1 до 26,6±8,5 (р<0,001) (в контроле – с 7,8 до 15,6), а также эстрадиола (пмоль/л) – с 36,0±9,3 до 161,0±73,4 (р<0,001) (в контроле – с 29,0 до 122,1). Частота наступления беременности в этой группе возросла в 4 раза (53 против 13% соответственно).
Т.А. Устиновой (проспективное простое плацебо-контролируемое КИ, n=120) [13] проведена оценка уровня рН и микробной флоры влагалища у пациенток с ТПБ и эндокринным бесплодием (120 – получали ЛГММ, 20 – плацебо). Установлено повышение рН влагалища после курса вагинальной пелоидотерапии (с 4,51±0,40 до 5,5±0,38, р=0,001) с последующим снижением значения рН (4,0±0,34, р=0,001) и повышение уровня лактобактерий через 3 месяца. В группе сравнения таких изменений не происходило.
М.А. Царькова [17] провела сравнительное когортное КИ (n=212) по оценке эффективности различных методов комбинированного двухэтапного лечения хронического рецидивирующего бактериального вагиноза при сопутствующих инфекциях, передающихся половым путем и/или неспецифических инфекциях (65%) в настоящее время или в анамнезе, нейро-обменно-эндокринных нарушениях (20%) или ХВЗОМТ (14%). Причиной рецидивов установлена устойчивость флоры к основному препарату (метронидазол), который применяется при лечении заболевания и в образовании устойчивых ассоциаций гарднереллы с другими микроорганизмами в виде биопленки.
ЛГММ применяли 62 женщины на фоне приема метронидазола. Выздоровление наступило у 81–89% пациенток в целом в исследуемой серии случаев (в группе ЛГММ – 86%, р>0,05) и не зависело от схемы, то есть лечение было одинаково эффективным, равно как и устойчивость терапевтического эффекта в течение 1 года (отсутствие рецидивов) – 84,6–79,9% (р>0,05). Однако у женщин с сопутствующим ХВЗОМТ, спаечным процессом и болевым синдромом выявлено улучшение, что отмечено как дополнительное преимущество данной процедуры перед другими схемами лечения.
Обсуждение
ЛГММ относят к группе хлор-сульфидных илов. Они качественно отличаются от других пелоидов существенно более высокой минерализацией (242,4 г/л) [7] и в физико-химическом отношении представляют собой сложную динамическую систему, состоящую из нерастворимых минералов и труднорастворимых солей. Уникальная особенность их заключается в структуре — малой величине зерен (45 микрон), что обеспечивает мелкодисперсную, коллоидную консистенцию.
Грязевой отжим образца грязи по ионно-солевому составу – бромный хлоридный натриевый. В обобщенном виде химическая формула состава отжима следующая:
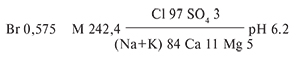
В составе отжима выявлены биологически активные компоненты: бром – 575,0 мг/дм³, метакремниевая кислота – 22,3 мг/дм³.
Содержание растворенных солей в составе жидкой фазы исследуемой грязи составило 8,1% на сырое вещество. Твердая фаза (52,1%) представлена силикатными частицами (26,3% на сырое вещество), карбонатами кальция (22,8%) и магния (2,96%). Гидрофильный коллоидный комплекс грязи содержит сульфиды железа (FeS – 0,134% на сырое вещество), окислы алюминия (0,89%), железа (1,34%) серы (0,04%), фосфора (0,23%). Содержание органических веществ в исследуемой пробе грязи составило 1,26% (на сырое вещество) в том числе углерода – 0,73%.
По основным физико-химическим критериям ЛГММ соответствует среднесульфидным соленасыщенным иловым лечебным грязям Карачинской разновидности [7].
Конечной «точкой» результативности (клинической эффективности) лечения больных с нарушением репродуктивной функции была выбрана частота наступления беременности в течение 1 года после проведенного лечения. Прежде всего, мы оценили частоту спонтанного наступления беременности у женщин с ТПБ (в том числе с ХЭ, НЛФ и/или после реконструктивно-пластических операций) и прошедших курс лечения с использованием ЛГММ. В этой группе беременность наступала в 4 раза чаще по сравнению с теми, кто получал другое физиотерапевтическое лечение или воздержался от него. У женщин с ТПБ и эндокринным фактором этот показатель был в 2 раза выше по сравнению с другими группами. В целом у больных с ТПБ в сочетании с другими состояниями спонтанного наступления беременности удалось добиться у 40–60%.
Частота наступления беременности в циклах ЭКО среди женщин с ТПБ, получавших преконцепционную подготовку с использованием ЛГММ, составила также 40–60% и была выше в 3,8 раза, а у женщин с ХЭ – в 2,7 раза по сравнению с теми, кто такого лечения не получал.
Оценка первичных клинических эффектов применения ЛГММ у женщин с нарушением репродуктивной функции позволила дополнить сведения к пониманию механизмов действия этого лечебного фактора
На основании проведенного анализа можно констатировать, что обезболивающее и дефиброзирующее (адгезиолитическое) действие ЛГММ превосходит другие физиотерапевтические воздействия в 1,8 и 1,5 раза соответственно. Особенно выражен адгезиолитический эффект в отношении эндометрия – частота морфологических признаков ХЭ у женщин с ТПБ снижается в 2,5 раза после проведенного лечения, а у женщин с выкидышами в анамнезе – в 3,3 ниже по сравнению с плацебо.
На анальгезирующее действие пелоидов указывают и другие авторы [18, 19]. Например, у больных с ХВЗОМТ, осложненным синдромом тазовой боли, получавших комплексное лечение с использованием соленасыщенных сульфидно-иловых грязей, был продемонстрирован выраженный анальгетический эффект (снижение интенсивности боли по визуально-аналоговой шкале (с 4,28±0,2 см до 0,63±0,2 см после лечения, р<0,05) [20]. Противовоспалительный и анальгетический эффекты лечебных грязей обусловлены подавлением простагландинового каскада, что обусловлено действием содержащихся в грязях активных субстанций: витаминов, микроэлементов, органических соединений [9].
Улучшение гормональной функции яичников и восстановление овуляции отмечают все авторы за счет повышения уровней эстрадиола и прогестерона в среднем в 2 раза, равно как и наступление беременности – в 5,3 раза чаще.
Полученные результаты позволяют предположить, что грязелечение оказывает не только прямое нормализующее влияние на гормонообразование в яичниках, но и, по-видимому, воздействует на рецепторный аппарат половых органов и восстанавливает его чувствительность к половым стероидам [21].
Нормализация параметров менструального цикла и восстановление секреторной трансформации эндометрия отмечается у 60% пациенток с НЛФ у женщин с ТПБ. НЛФ также встречалась в 2 раза реже у женщин со спонтанными абортами после лечения ЛГММ. Беременность у женщин с НЛФ после лечения ЛГММ наступает у 60%, что в 2 раза чаще, чем в плацебо-группе. После спонтанного выкидыша она достигает 85%.
Исследование кривых скоростей кровотока в бассейне малого таза свидетельствует об улучшении кровообращения в органах малого таза – происходит ускорение кровотока в яичниковых артериях на стороне формирования желтого тела на фоне терапии ЛГММ с улучшением его трофики. Увеличение индекса резистентности с противоположной стороны позволяет предположить развитие «синдрома обкрадывания». При отсутствии овуляции и формирования желтого тела, по данным литературы, не установлено значимого изменения скоростей кровотока в органах малого таза [22, 23].
О действии, нормализующем микробиоценоз влагалища, свидетельствует увеличение количества лактобактерий к 3-му месяцу после лечения ЛГММ. Отмечается снижение рецидивов при хроническом бактериальном вагинозе, сопоставимое с другими видами лечения, предлагаемыми фармацевтической промышленностью с дополнительным преимуществом ЛГММ перед другими схемами лечения за счет воздействия на сопутствующие хронические воспалительные процессы в органах малого таза.
О действии соленасыщенных сульфидно-иловых грязей на влагалищный биоценоз сообщается также в КИ М.А. Кузьминой [24], где было показано снижение рН влагалищного содержимого, повышение высеваемости лактобактерий и снижение роста некоторых штаммов условно-патогенной микрофлоры (отмечено увеличение частоты микроскопии лактофлоры (71%) относительно группы плацебо почти в 3 раза). Частота микроскопии условно-патогенной микрофлоры в основной группе через 3 месяца после лечения составила лишь 11%, что в 4 раза ниже против контроля. Аналогичные результаты получены в КИ, выполненном Т.А. Кондратьевой с соавт. [25] (серия случаев с ТПБ, n=16).
Антимикробное, противовоспалительное и антиоксидантное действие ЛГММ ученые связывают с влиянием на пролиферацию клеток, миграцию фибробластов и клеточную активность, что было показано в исследованиях на лабораторных животных [26]. Кроме того, доказано прямое подавляющее влияние ЛГММ в экспериментах на тестовые микроорганизмы (Propionibacterium и Candida аlbicans). Они быстро теряли свою жизнеспособность при добавлении ЛГММ – в посевах на чашках с агаром, инокулированных Candida или Propionibacterium, зоны ингибирования роста наблюдалось вокруг дисков с грязью Мертвого моря [27]. Выраженное антимикробное действие объясняется высоким содержанием сульфидных групп, ионов брома и цинка.
Объяснение механизма лечебного действия пелоидов на организм в настоящее время базируется на теориях обратной связи, рефлекторного кольца и функциональных систем адаптации [9], которые дополняются механическим фактором: пелоиды воздействуют на рецепторный аппарат слизистых оболочек, усиливают отток крови и лимфы, рефлекторно влияют на нервно-эндокринные и нервно-сосудистые механизмы, что улучшает функциональные и метаболические сдвиги в тканях, обусловливая конечные саногенетические эффекты.
Ограничения
В исследованиях, включенных в обзор, наблюдение выполнялось среди небольших групп пациентов, критерии первичной оценки были неоднородны, период наблюдения продолжался не более 1 года, критерии вторичной оценки содержали только один показатель – частоту наступления беременности без констатации других исходов заболевания (выздоровление, рецидив, ухудшение), отсутствуют сведения о безопасности вагинального применения ЛГММ, наличии или отсутствии физиобальнеореакции или побочных реакций и осложнений.
Выводы
С учетом полученных результатов и ограничений анализируемых исследований можно с большой вероятностью достоверности утверждать, что применение ЛГММ в программах восстановительного лечения и реабилитации женщин с нарушениями репродуктивной функции (ТПБ, ХЭ, НЛФ, спонтанными абортами в анамнезе и их сочетаниях) является эффективным и способствует преодолению бесплодия, улучшению результатов ЭКО и исходов беременностей.
Требуется проведение дополнительных рандомизированных клинических исследований с достаточным количеством наблюдений.



