Тяжелая преэклампсия (ПЭ) связана с развитием перинатальных и неонатальных осложнений. Лежащие в основе сосудистые проявления, наличие окислительного стресса и повреждения эндотелия могут привести к задержке роста плода (ЗРП). Грозным осложнением, требующим большого внимания, эффективного прогнозирования и профилактики ПЭ, является внутриутробная гибель плода. В странах с низким и средним уровнем дохода антенатальная гибель плода в 3 раза выше, чем в странах с высоким уровнем дохода у женщин с ПЭ [1]. Беременные, имевшие раннюю тяжелую ПЭ, намного чаще подвержены риску преждевременных родов, поскольку родоразрешение является единственным «лекарством» от текущих осложнений. Около 25% случаев развития ПЭ требуют родоразрешения до 37 недель беременности [2, 3]. Дети, рожденные недоношенными, подвержены более высокому риску неонатальной смертности и заболеваемости, включая некротизирующий энтероколит, ретинопатию недоношенных, бронхолегочную дисплазию, внутрижелудочковое кровоизлияние и нарушения развития нервной системы. Плохие неонатальные исходы могут быть связаны с недоношенностью, либо быть прямым следствием ПЭ. Чаще всего действуют оба фактора, особенно в случаях тяжелой ПЭ с ранним ее началом. Osmond C. и Barker D.J. в своей публикации 2000 г. высказали предположение о влиянии внутриутробной среды на здоровье взрослых. Их гипотеза утверждает, что недостаточное внутриутробное поступление питательных веществ, наблюдаемое при плацентарной недостаточности, может привести к повышенному риску развития инсулинорезистентности, сахарного диабета, ишемической болезни сердца и гипертонии во взрослой жизни [4].
Все больше новых данных указывает на повышенный риск развития долгосрочных неблагоприятных исходов для здоровья женщин, перенесших ПЭ [5]. Американская кардиологическая ассоциация отмечает повышенный риск развития сердечно-сосудистых заболеваний у матерей, перенесших ПЭ, и рекомендует тщательный сбор акушерского анамнеза для оценки сердечно-сосудистого риска [6, 7]. Мета-анализ 2007 г., который включал почти 200 000 беременных с ПЭ, показал относительный риск 3,7, 2,16 и 1,81 для развития гипертонии, ишемической болезни сердца и инсульта, через 10–15 лет после данной беременности. Последующий мета-анализ 2016 г. показал трехкратное увеличение риска хронической гипертензии и двукратное увеличение риска сердечно-сосудистых заболеваний и инсульта у матерей с ПЭ, по сравнению с женщинами с неосложненной беременностью [8]. Al-Nasiry S. et al. в своем исследовании показали, что женщины, перенесшие ПЭ, в 2 раза чаще подвержены развитию в будущем метаболического синдрома [9].
Ингибин-А представляет собой гликопротеиновый гормон, продуцируемый плацентарными трофобластами [10, 11]. Применяется для комбинированного скрининга хромосомных аномалий [12]. Несколько исследований показали, что женщины, у которых развилась ПЭ, имеют более высокий уровень ингибина-А уже в I триместре. Однако, было обнаружено, что его чувствительность слишком низка для использования в качестве единственного маркера для прогнозирования ПЭ [13].
Ассоциированный с беременностью плазменный протеин А (РАРР-А) в основном продуцируется плацентарными синцитиотрофобластами [14]; его снижение связано с такими осложнениями беременности, как ПЭ, задержка роста плода, преждевременные роды и самопроизвольный выкидыш [15, 16]. PAPP-A2 является гомологом PAPP-A, имеющим 46% аминокислотного сходства. PAPP-A2 также экспрессируется синцитиотрофобластами и специфически расщепляет белок 5, связывающий инсулиноподобный фактор роста (IGFBP-5); в то время как PAPP-A расщепляет IGFBP-4. В отличие от PAPP-A, расщепление IGFBP-5 с помощью PAPP-A2 не требует присутствия IGF, который необходим для нормальной плацентации. Было показано, что концентрация PAPP-A2 в материнской сыворотке значительно выше при развившейся ПЭ, чем при неосложненной беременности. РАРР-А2 играет важную роль в нормальной плацентации, и изменения его концентрации могут быть связаны с плацента-ассоциированными осложнениями беременности [17].
В отечественной и зарубежной литературе имеются данные о предикции ПЭ с помощью белков материнской плазмы крови [18, 19]. Tarca A.L. et al. в своем исследовании 2019 г. обнаружили, что мультибелковые модели, полученные с 16-й по 22-ю недели беременности могут предсказывать раннюю ПЭ с чувствительностью 71% при частоте ложноположительных результатов 10% [20]. В статье 2017 г. Сергеевой В.А. и соавт. также были обнаружены 12 пептидов, позволяющих однозначно отличить здоровых пациенток от группы ПЭ или ПЭ на фоне хронической артериальной гипертензии [21]. Starodubtseva N. et al. обнаружили в моче пептид SERPINA1, который имеет сходную диагностическую картину с ранее известными маркерами ПЭ, такими как sFlt-1/PLGF. Оценку пептида SERPINA1 в моче можно использовать в качестве диагностического теста тяжести ПЭ для определения дальнейшей тактики ведения беременности или необходимости срочного хирургического родоразрешения [22].
Одним из актуальных вопросов современного акушерства является вопрос предикции плацента-ассоциированных осложнений. Предложенные в разное время методы прогнозирования можно подразделить на 2 группы: биохимические и ультразвуковые. Биохимические маркеры преимущественно представлены пептидами, выделяемыми плацентой. Среди биомаркеров следует выделить про- и ангиогенные факторы: плацентарный фактор роста (PlGF) и растворимую fms-подобную тирозинкиназу 1 (sFlt-1), РАРР-А РАРР-А2, N-концевой натрийуретический пептид про-В-типа (NT-proBNP), который является чувствительным маркером сердечной недостаточности, а также маркером ПЭ на поздних сроках беременности [23–25].
На сегодняшний день, определение липидного профиля плазмы крови беременных женщин для предикции больших акушерских синдромов является перспективным направлением. Исследования липидного профиля плазмы крови женщин в I триместре беременности продемонстрировали изменения уровня некоторых классов липидов плазмы крови женщин, особенно триглицеридов, у которых развилась ПЭ. Индуцированная гиперлипидемия, в свою очередь, вызывает дисфункцию эндотелиальных материнских сосудов. Женщины с плацента-ассоциированными осложнениями в анамнезе имеют существенные различия липидных показателей и повышенную восприимчивость к окислению липопротеинов, по сравнению с женщинами, у которых предыдущая беременность протекала без осложнений. Таким образом, измерение профиля липидов в сыворотке крови может иметь хорошую прогностическую ценность [26, 27]. Гипертриглицеридемия возникает в результате физиологического повышения эстрогенов во время беременности. Эстрогены вызывают печеночный биосинтез эндогенных триглицеридов. Также гипертриглицеридемия может иметь место в патогенезе гипертонических расстройств во время беременности [28]. Yu L. et al. сообщают, что женщины с повышенным уровнем триглицеридов имеют в 4 раза выше риск развития ПЭ, чем женщины с нормальными лабораторными показателями [29]. Gofman J.W. et al. в своем исследовании 2011 г. предположили, что изменение уровня липидов между 28-й и 32-й неделями беременности поможет предсказать развитие ПЭ. Уровень триглицеридов в сыворотке крови у женщин с тяжелой ПЭ был выше (210,57±14,09 мг/дл) по сравнению с женщинами, развившими умеренную ПЭ (195,33±14,38 мг/дл), и по сравнению с группой контроля (152,30±9,22 мг/дл). Повышение уровня триглицеридов в сыворотке было достоверно выше (p<0,01) у пациенток с развившейся ПЭ [30]. В исследовании 2018 г. Ahmed A.A.M. et al. отметили, что ПЭ связана с гипертриглицеридемией и повышенным уровнем холестерина липопротеидов низкой плотности (ЛПНП) и очень низкой плотности (ЛПОНП) и снижением уровня липопротеидов высокой плотности (ЛПВП). Чем больше тяжесть ПЭ, тем выше уровень триглицеридов сыворотки, холестерина, ЛПНП и ЛПОНП и снижение уровня ЛПВП. Авторы отмечают, что крайне важно, чтобы липидный профиль сыворотки исследовался на протяжении всего периода беременности, так как это может помочь в раннем выявлении акушерских осложнений [31].
Можно предположить, что детальное изучение липидного профиля беременных женщин позволит выявить маркеры раннего прогнозирования плацента-ассоциированных заболеваний для более пристального наблюдения акушером-гинекологом, мониторинга клинико-лабораторных и функциональных методов исследований и своевременного назначения терапии.
Целью данного исследования было оценить взаимосвязь между липидами плазмы крови, изменением их концентрации на ранних сроках беременности и риском ПЭ у беременных, входящих в группу высокого риска развития, плацента-опосредованных осложнений.
Материалы и методы
Было проведено проспективное исследование «случай–контроль». Всего в исследование было включено 66 беременных: группа высокого риска развития ПЭ по данным анамнеза (n=12) и первому скринингу (n=34) – 38 беременных женщин (группа 1), группа контроля (группа 2) – 28 беременных женщин. Отбор пациенток и получение образца плазмы крови проводился по обращаемости в поликлиническое отделение ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России для первого скрининга беременности. Критериями включения являлись: возраст пациенток 18–45 лет; одноплодная беременность; гестационный возраст при рандомизации 7–13 недель; отягощенный акушерский анамнез (развитие ПЭ, ЗРП и HELLP-синдрома в предыдущей беременности); риск развития ПЭ и ЗРП, выявленных по первому пренатальному скринингу. В критерии невключения входили беременные с многоплодной беременностью; трансплантированными органами; аутоиммунными и онкологическими заболеваниями. Критериями исключения было наличие хромосомной аномалии у плода; врожденные пороки развития плода; отказ от продолжения участия в исследовании. Диагноз ПЭ и ЗРП были установлены на основании критериев, регламентированных отечественными клиническими рекомендациями [32].
Все пациентки подписали добровольное информированное согласие на участие в исследовании. Наблюдение проводилось в соответствии с приказом МЗ РФ от 20.10.2020 № 1130н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» и осуществлялось с момента первого обращения до родов.
Выделение липидов из образцов плазмы крови осуществлялось модифицированным методом Фолча: к 40 мкл плазмы добавлялось 480 мкл CHCl3/CH3OH (1/1) и выдерживалось в ультразвуковой ванне 10 минут. После этого смесь перемешивалась 10 секунд и центрифугировалась 5 минут при 15000 G. Хлороформ-метанольный слой, содержащий липиды, отбирался в отдельную виалу. К водному слою добавлялось 250 мкл CHCl3/ CH3OH (1/1) и центрифугировалось 5 мин при 15000 G. Повторно отбирался нижний хлороформ-метанольный слой и объединялся с отобранным ранее. Липидный раствор высушивался в потоке азота и перерастворялся в 200 мкл изопропанол/ацетонитрила (1/1) для дальнейшего жидкостного хромато-масс спектрометрического анализа.
Липидные экстракты анализировали методом высокоэффективной жидкостной хромато-масс-спектрометрии на жидкостном хроматографе Dionex UltiMate 3000 (Thermo Scientific, Германия), соединенном с масс-анализатором Maxis Impact qTOF с ЭРИ источником ионов (Bruker Daltonics, Германия). Разделение образцов осуществлялось методом обращенно-фазовой хроматографии на колонке Zorbax C18 (150×2,1 мм, 5 мкм, Agilent, США) с линейным градиентом от 30 до 90% элюента В (раствор ацетонитрил/изопропанол/вода, 90/8/2 о/о/о, с добавлением 0,1% муравьиной кислоты и 10 ммоль/л формиата аммония) за 20 минут. В качестве элюента А использовали раствор ацетонитрил/вода (60/40, о/о) с добавлением 0,1% муравьиной кислоты и 10 ммоль/л формиата аммония. Скорость потока элюирования составляла 40 мкл/мин, вводимый объем – 3 мкл. Масс-спектры получали в режиме положительных ионов в диапазоне m/z 100–1700 и режиме отрицательных ионов в диапазоне m/z 100–1000 со следующими установками: напряжение на капилляре 4,1 кВ для режима положительных ионов и 3,0 кВ для режима отрицательных ионов, давление распыляющего газа 0,7 бар, скорость потока осушающего газа 6 л/мин, температура осушающего газа 200◦C.
Липиды идентифицировали с использованием R-скрипта Lipid Match по точной массе с помощью базы данных Lipid Maps и по характерным тандемным масс-спектрам (МС/МС).
Статистический анализ
Уровни липидов в плазме крови проверялись на наличие статистически значимой корреляции с клинической принадлежностью, результатом скрининга, анамнезом, численным значением скрининга, индексом массы тела, номером беременности, длительностью последней беременности, биохимическими параметрами в III триместре: уровнями в крови, креатинина, аланинаминтрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ), лактатдегидногеназы (ЛДГ), уровнем протеинурии, уровнем тромбоцитов, отношением концентраций sFlt-1/PLGF, тестом Спирмена. На основе липидов, которые были определены как имеющие статистически значимую корреляцию, была построена модель проекций на скрытые структуры с использованием двух предсказательных осей. Была построена дискриминационная модель с использованием ортогональных проекций на скрытые структуры «группа, в которой не произошло ПЭ»/«группа, в которой произошла ПЭ». Из липидов со значением проекции переменной больше 1 в модели выбирались липиды, с которыми модель на основе логистической регрессии имела наименьший информационный критерий Акаике и статистически значимо отличные от нуля коэффициенты. Оценка чувствительности и специфичности модели производилась с использованием кросс-валидации по отдельному объекту с выбором порога отсечки по максимальной сумме значений чувствительности и специфичности.
Для результатов с использованием модели на основе липидного профиля, полученных в ходе кросс-валидации и на основе скрининга были построены функции выживаемости на основе оценки Каплан–Мейера и вычислены логарифмические ранговые критерии значимости.
Для статистической обработки данных использовались средства языка R 4.1.3 в среде Rstudio 1.1.463 с подключенными пакетами ropls, survival, survminer. ggplot2, pROC, corrplot.
Результаты и обсуждение
В работе были задействованы образцы плазмы крови, полученные как часть образца первого скрининга с 7-й по 13-ю недели гестации от 66 женщин, 38 из которых составили группу пациенток с высоким риском плацента-ассоциированных заболеваний (группа 1) и 28 – группу контроля (группа 2). Из 38 пациенток с высоким риском у 11 ПЭ развилась в сроки 22–37 недель беременности. Все пациентки, входящие в группу высокого риска развития плацента-опосредованных заболеваний, получали в целях профилактики ацетилсалициловую кислоту в суточной дозировке 150 мг с 12–16 недель беременности до 36 недель гестационнного срока, согласно клиническим рекомендациям [32].
12/38 (31,5%) беременных, входящих в первую группу, имели ПЭ и/или ЗРП в анамнезе. Данные пациентки были подразделены на подгруппы: с развитием ранней тяжелой ПЭ (ртПЭ) – 5/38 (13,2%) и поздней тяжелой ПЭ (птПЭ) – 4/38 (10,5%). ЗРП наблюдалась у 3/38 (7,9%) женщин.
У 7/38 (18,4%) пациенток первой группы была хроническая артериальная гипертензия в стадии медикаментозной коррекции (табл. 1). У 11/38 (28,9%) беременных развились ПЭ и ЗРП. Данные пациентки были подразделены на подгруппы: с развитием ртПЭ – 6/38 (15,7%), птПЭ – 1/38 (2,6%) и поздней умеренной ПЭ (пуПЭ) – 4/38 (10,5%). ЗРП наблюдалась у 5/38 (13,1%) пациенток с развившейся ПЭ, и у 1/38 (2,6%) пациентки без ПЭ (табл. 1). Следует отметить, что у 7/38 (18,4%) повторно беременных данная беременность снова осложнилась плацента-опосредованными заболеваниями. Гестационная артериальная гипертензия развилась у 2/38 (5,3%) пациенток первой группы.

Досрочное родоразрешение выполняли в связи с нарастанием тяжести ПЭ и/или при ухудшении состояния матери и плода. Оно было произведено у 7/38 (18,4%) пациенток первой группы. Преждевременные роды произошли у 7/38 (18,4%) беременных данной группы: ранние преждевременные роды – у 3/38 (7,9%), у остальных 4/38 (10,5%) женщин произошли поздние преждевременные роды.
Во вторую группу входило 28 здоровых беременных женщин. В этой группе не наблюдалось развития плацента-ассоциированных заболеваний и преждевременного родоразрешения.
В образцах плазмы крови I триместра беременности было идентифицировано 149 липидов в режиме положительных ионов и 160 липидов в режиме отрицательных ионов. Из них 60 липидов в режиме положительных ионов, относящихся преимущественно к классам фосфатидилхолинов и лизофосфатидилхолинов, в том числе и с простой эфирной связью, фосфатидилэтаноламинов, триглицеридов и сфингомиелинов, и 59 липидов в режиме отрицательных ионов, относящихся к классам фосфатидилхолинов, в том числе с простой эфирной связью, лизофосфатидилхолинов, фосфатидилэтаноламинов, лизофосфатидилэтаноламинов, окисленных липидов, фосфатидилинозитолов, сфингомиелинов, имели статистически значимую корреляцию с принадлежностью к клинической группе.
Корреляционный анализ по группам высокого риска позволил выявить 48 липидов, для которых уровень корреляции хотя бы с одним клиническим параметром был средний или выше среднего (R>0,6), относящихся к классам фосфатидилхолинов, фосфатидилинозитолов, сфингомиелинов и триглицеридов (рис. 1).
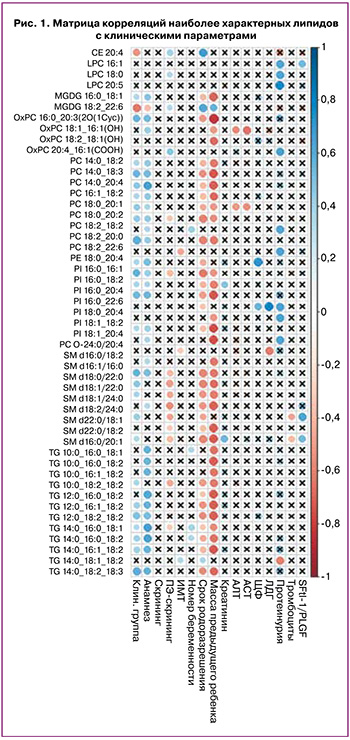
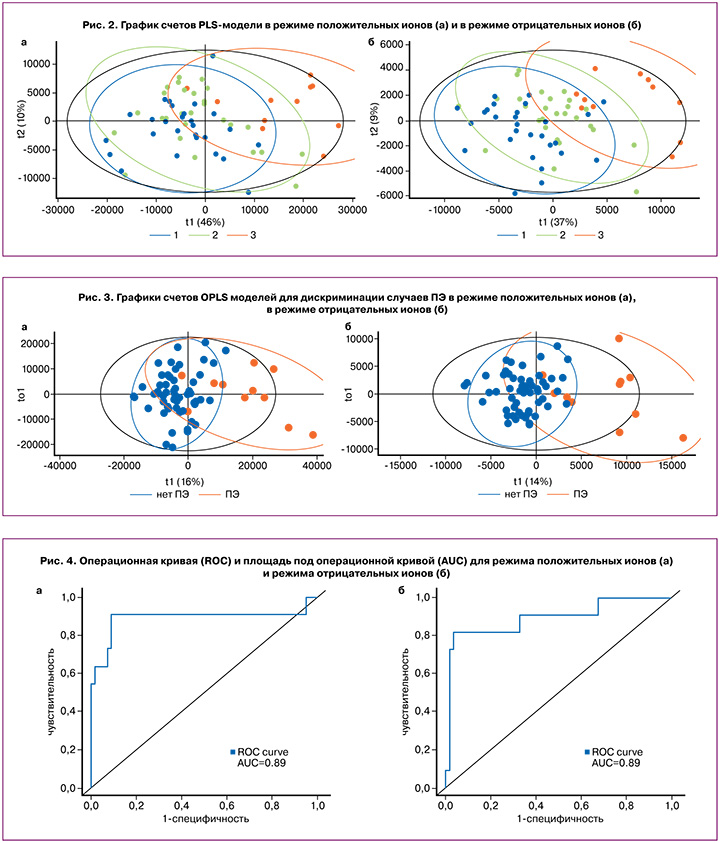
На основе липидов, статистически значимо коррелирующих с клинической группой, были построены PLS модели, график счетов которых демонстрирует лучшее перекрытие точек из группы риска ПЭ, у которых ПЭ в ходе беременности ПЭ не случилась, с группой контроля, нежели с группой риска, у которых ПЭ случилась (рис. 2).
Учитывая близкое положение кластеров группы контроля и группы высокого риска ПЭ, для которого ПЭ не случилась, были построены OPLS модели для дискриминации случаев ПЭ от остальных, с долей описанных переменных отклика R2Y 0,55 и 0,59 и долей предсказанных переменных отклика Q2Y 0,32 и 0,46 для режима положительных ионов и режима отрицательных ионов, соответственно (рис. 3).
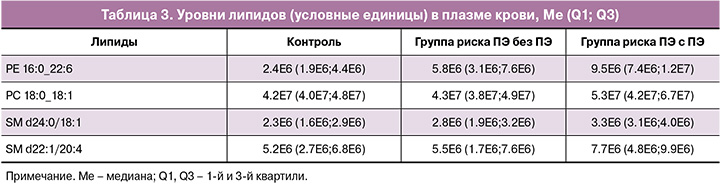
В финальную модель (табл. 2) вошли липиды, приведенные в таблице 3, которые позволили построить модель на основе логистической регрессии с оптимальными чувствительностью и специфичностью 0,91 и 0,91, соответственно, для режима положительных ионов и оптимальными чувствительностью и специфичностью 0,82 и 0,96, соответственно, для режима отрицательных ионов (рис. 4).
Анализ функций выживания позволил определить относительный риск для группы, определенной как группа повышенного риска с использованием модели на основе липидного профиля в режиме положительных ионов, равным 33,5 с ДИ 4,7–241, и относительный риск для группы, определенной как группа повышенного риска с использованием модели на основе липидного профиля в режиме отрицательных ионов, равным 20,5 с ДИ 5,1–82,2 (рис. 5а). Анализ функций выживания, построенных на основе информации о результатах скрининга, показал относительный риск для результата скрининга «ПЭ/ЗРП» 2,67 с ДИ 0,74–9,64 и для результата скрининга «ПЭ+ЗРП» – 2,78 с ДИ 0,53–14,12 (рис. 5б).

Ранняя диагностика и прогнозирование на молекулярном уровне таких грозных и жизнеугрожающих осложнений для матери и плода является предметом активного взаимодействия клиницистов и ученых. На сегодняшний день основной проблемой современного акушерства является отсутсвие надежных скрининговых маркеров для выявлния беременных, входящих в группу высокого риска развития ПЭ, что делает невозможным своевременно начать превентивную терапию до манифестации симптомов. За последние несколько десятилетий было предпринято множество попыток выявления механизмов, лежащих в основе развития ПЭ. Было показано, что сывороточные маркеры, специфические белки, пептиды, длинные некодирующие РНК, микроРНК вносят свой вклад в развитие заболевания. Тем не менее, все открытия остаются теоретическими, что объясняет колоссальное расстояние между лабораторными находками и их клиническим применением. Были тщательно проанализированы течение и исход не только данной беременности, но и предыдущей беременности, а также был проведен поиск панели липидов, способных спрогнозировать развитие ПЭ в настоящую беременность.
Была отмечена статистически значимая корреляционная связь между дислипидемией у беременных (особенно фосфатидилхолинов, лизофосфатидилхолинов, фосфатидилэтаноламинов, триглицеридов, сфингомиелинов, окисленных липидов и фосфатидилинозитолов) и клиническими и лабораторными параметрами развития ПЭ. В частности, более 80% липидов плазмы крови первого триметра беременности, идентифицированных как маркерные, демонстрируют положительную корреляционную связь (rs>0,7) cо степенью тяжести ПЭ, наличием акушерских осложнений в анамнезе, и высокий уровень отрицательной корреляции с весом ребенка при предыдущей беременности (для повторнородящих женщин) и сроком родоразрешения. Обращает на себя внимание группа маркерных сфингомиелинов, уровень которых в крови статистически значимо отрицательно коррелирует с результатами биохимического скрининга первого триместра беременности. Для ряда маркерных липидов (форфатидилхолинов, лизофосфатидилхолинов, фосфатидилинозитолов) в крови I триместра беременности обнаружена корреляционная связь с изменением основных клинических маркеров ПЭ при манифестации патологии (в частности, АЛТ, АСТ, ЩФ, креатинин, sFlt-1/PLGF, уровень протеинурии и тромбоцитопении).
Значения относительного риска для групп, определенных при помощи предложенной модели на основе липидного профиля плазмы крови, значительно превышают значения относительного риска для групп, сформированных на основе информации о результатах скрининга, что показывает более высокую способность моделей на основе липидома плазмы к прогнозированию развития ПЭ, по сравнению со скринингом и позволяет говорить о перспективности дальнейших исследований, связанных с созданием и валидацией диагностических тестов для скрининга ПЭ на основе липидного профиля плазмы крови.
Заключение
На основании полученных результатов можно сделать вывод, что изменения липидного спектра плазмы крови I триместра беременности, преимущественно фосфатидилхолинов, лизофосфатидилхолинов, фосфатидилэтаноламином, триглицеридов и сфингомиелинов, ассоциировано с риском развития ПЭ в текущую беременность для группы высокого риска данного осложнения. Это позволяет предложить разработанные модели логистической регрессии на базе уровней маркерных липидов плазмы крови I триместра, как уточняющие после проведения скрининга I триместра. Полученные данные в будущем смогут поспособствовать совершенствованию мер профилактики плацентаассоциированных заболеваний и своевременному мониторингу их развития.



