Привычный выкидыш – сложная и полиэтиологичная проблема современного акушерства. Вклад генетических составляющих в реализацию повторных потерь беременностей обсуждается в основном с позиций хромосомной патологии эмбриона. В то же время родительский вклад в реализацию привычных потерь плода возрастает с увеличением числа прервавшихся беременностей.
В последние годы внимание исследователей привлекает вопрос о генетической предрасположенности к привычному выкидышу, в том числе через реализацию воспалительного ответа. В то же время данные о полиморфизмах генов цитокинов родителей при привычных потерях плода крайне немногочисленны и противоречивы.
Так, японские исследователи из Саппоро определяли полиморфизмы гена интерлейкина-2 (IL-2) у женщин с преждевременными родами инфекционно-воспалительного генеза. После обследования 414 женщин с преждевременными родами установлено, что изучаемый полиморфизм IL-2 -384T/G не является доказанным фактором риска, однако имеет место повышенная частота носительства IL-1A -889 С/С, C/T генотипов и +4845G/G генотипа у женщин с преждевременными родами [1].
Интерлейкин-2 (IL-2) является одним из наиболее важных цитокинов, участвующих в развитии иммунного ответа. Он продуцируется Т-клетками (преимущественно Т-хелперами) в ответ на антигенную и митогенную стимуляцию, состоит из 133 аминокислот и имеет молекулярную массу около 15,4 kDa. Изначально он синтезируется в виде предшественника. IL-2 действует через гетеротримерный комплекс рецептора IL-2, состоящего из трех субъединиц: рецептор IL-2α (CD25), рецептор IL-2β (CD122) и рецептор IL-2γ (CD132). Впервые IL-2 был выделен из культуральной жидкости лимфоцитов, стимулированной митогенами в 1976 г. и первоначально назван Т-клеточным ростовым фактором [2].
Позже было показано, что на синтез IL-2 влияют не только митогены и антигены, но и уровни других цитокинов IL-1, IL-6, фактор некроза опухолей (TNF), интерфероны (IFN). Гормоны тимуса (тимозин, сывороточный фактор тимуса) обеспечивают дифференцировку незрелых тимоцитов в клетки-продуценты IL-2. Мишенями IL-2 являются различные субпопуляции Т-клеток, В-клетки, натуральные киллерные клетки, макрофаги. IL-2 играет ключевую роль в пролиферации Т-клеток и натуральных киллерных клеток, увеличивая цитолитическую активность, а также регулирует апоптоз среди активированных Т-клеток [3].
В настоящее время доказана роль IL-2 в развитии острых инфекционных заболеваний, формировании онкологических образований, аллергических и аутоиммунных процессах, иммунодефиците.
В 2005 г. группа японских ученых предположила, что наличие генотипа -330 Т/Т IL-2 было связано с атрофией слизистой оболочки желудка, что является предраковым поражением. При обследовании 454 пациентов было показано, что при серопозитивном тесте на H.pylory у носителей такого генотипа значимо повышается риск атрофии слизистой оболочки желудка [4]. В настоящее время онкологами активно изучается роль полиморфизмов генов IL-2 в генезе злокачественных процессов, в частности, в формировании противоопухолевого иммунного ответа [5].
В настоящее время нет единого мнения о роли полиморфизмов гена IL-2 в предрасположенности к повторным потерям беременности. В этой связи целью данного исследования стала оценка роли полиморфизма гена IL-2 у женщин с привычными ранними выкидышами и неоднократными очень ранними преждевременными родами.
Материал и методы исследования
В ходе исследования были обследованы 90 женщин. I группу составили пациентки с привычными ранними гестационными потерями (до 22 недель беременности, n=30). Во II группу вошли пациентки с очень ранними преждевременными родами (с 22-й по 28-ю неделю беременности, n=30). Группу сравнения (III группу) составили женщины с неосложненным течением беременности и наличием не менее двух своевременных родов в анамнезе (n=30). Средний возраст обследуемых составил 35±3,8 года. Количество беременностей в I группе составило 4,1±0,6, во II группе – 3,8±0,7, в III группе – 3,1±0,5.
Критерием включения пациенток в I группу исследования стало наличие в анамнезе не менее 2 самопроизвольных последовательных потерь беременности в срок до 22 недель, не связанных с аномалиями развития или хромосомной патологией плода; II группу составили пациентки с аналогичными критериями и 2 и более очень ранними преждевременными родами с 22-й по 28-ю неделю беременности.
Критериями исключения из исследования были: наличие анатомических причин привычных потерь беременности (врожденные пороки развития половой системы, наличие миомы матки больших размеров или миома с центрипетальным ростом узла, значительно деформирующим полость матки, наличие внутриматочных синехий), аномалии кариотипа родителей, наличие совместимости супругов по системе HLA II класса по 3 и более аллеям, наличие высоких титров антифосфолипидных антител, признаков тромбофилии по данным лабораторных исследований.
В работе проводилось исследование полиморфизма гена IL-2: -330 T>G (rs 2069762) и +166 G>T (rs 2069763). Выделение ДНК проводили по методу Higuchi (R. Higuchi, H. Erlich, 1989) с некоторыми модификациями. Полимеразную цепную реакцию и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Результаты исследования и обсуждение
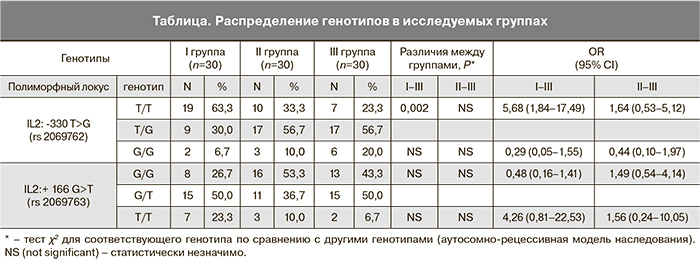
Частота генотипа Т/Т в положении -330 IL-2 была статистически значимо выше в группе с привычными ранними потерями (I) и составила 63,3%, а в группе с физиологическим течением беременности (III) – 23,3% (p=0,007, OR 5,68, CI 1,84–17,49). Напротив, полиморфизм T/G выявлялся в I группе достоверно реже – 30,0% против 56,7% в III группе (p=0,007, OR 0,33, CI 0,11–0,95). При сравнении частоты генотипа G/G в обеих группах достоверных различий не получено, возможно, в связи с небольшим количеством пациенток – носительниц этого генотипа.
Статистически значимые различия получены по частотам аллелей: частота аллеля Т IL-2 -330 Т/G в I группе была достоверно выше, чем в III, и составила 78 против 52% (p=0,004, OR 3,38, CI 1,54–7,45), частота аллеля G – достоверно ниже – 22 против 48% (p=0,004, OR 0,30, CI 0,13-0,65).
В нашем исследовании мы не получили достоверных различий в частотах генотипов полиморфного гена IL2 +166 G>T (р=0,14) и частотах его аллелей (р=0,093). Также не получено достоверных различий при исследовании генетических полиморфизмов IL-2: -330 Т>G и +166 G>T у пациенток с поздними гестационными потерями (p>0,05).
Данные о распределении генотипов в исследуемых группах приведены в таблице.
Проанализировав полученные данные, можно сделать заключение о возможной роли аллеля T IL-2-330 Т/G в качестве фактора риска и протективном значении аллеля G в отношении ранних гестационных потерь. Не выявлено влияния полиморфизмов гена IL-2 +166 G>T на риск привычного невынашивания беременности ранних сроков. Не выявлено влияния полиморфизмов генов IL-2: -330 Т>G и +166 G>T на частоту очень ранних преждевременных родов.
Аналогичные работы зарубежных авторов немногочисленны. Так, китайские ученые исследовали полиморфизм IL-2:-330 А>С (rs 2069762). В I группу вошло 189 женщин с тремя и более выкидышами до 20 недель гестации, II группа насчитывала 187 здоровых беременных женщин. Согласно полученным данным, частота генотипа -330С/С была значимо выше в группе здоровых беременных, чем у пациенток с невынашиванием беременности, в то время как частота аллеля -330А была значимо выше в основной группе, что можно рассматривать как фактор риска привычного невынашивания беременности ранних сроков [6]. Есть сообщения о том, что аллель G полиморфизма -330 T>G коррелирует со снижением продукции IL-2 in vivo, тогда как Т-аллель ассоциирован с атопическими заболеваниями за счет поляризации иммунного ответа по Th2-пути.
Заключение
Можно предположить, что воздействие описанных генетических факторов во время беременности реализуется через регуляцию пролиферации Т-клеток, натуральных киллерных клеток, процессов апоптоза активированных Т-клеток при непосредственном участии системы IL-2.
Требуются дальнейшие исследования для определения роли полиморфизмов цитокинов в реализации привычных потерь беременностей.



