Новое вирусное заболевание и ассоциированный с ним тяжелый острый респираторный синдром в настоящее время являются самым значительным мировым кризисом общественного здравоохранения со времен пандемии гриппа 1918 г. В конце 2019 г. в Ухане идентифицировали новый коронавирус, который стал причиной вспышки тяжелой пневмонии. Заболевание быстро распространилось по всей территории Китая, затем увеличилось число случаев заболевания и в других странах. В марте 2020 г. Всемирная организация здравоохранения объявила пандемию заболевания, обусловленного новым коронавирусом. Впоследствии возбудитель распространился на более чем 205 стран и территорий.
Коронавирусы (Coronaviridae) – это большое семейство РНК-содержащих вирусов, способных инфицировать как животных (их естественных хозяев), так и человека [1]. У людей коронавирусы могут вызвать целый ряд заболеваний – от легких форм острой респираторной инфекции до тяжелого острого респираторного синдрома (ТОРС). В настоящее время известно о циркуляции среди населения четырех коронавирусов (HCoV-229E, -OC43, -NL63 и -HKU1), которые круглогодично присутствуют в структуре острой респираторной вирусной инфекции (ОРВИ) и, как правило, вызывают поражение верхних дыхательных путей легкой и средней степени тяжести. Новый коронавирус SARS-CoV-2 представляет собой одноцепочечный РНК-содержащий вирус, относящийся к семейству Coronaviridae, к линии Beta-CoV B. Вирус отнесен ко II группе патогенности, как и некоторые другие представители этого семейства (вирус SARS-CoV, MERS-CoV) [1].
Клинические симптомы и пути передачи инфекции
Клинические проявления новой коронавирусной инфекции сходны с симптомами ОРВИ:
- повышение температуры тела (>90%);
- кашель (сухой или с небольшим количеством мокроты) в 80% случаев;
- одышка (55%);
- утомляемость (44%);
- ощущение тяжести в грудной клетке (>20%).
К специфичным симптомам относятся:
- нарушение обоняния и вкусовой чувствительности;
- сыпь (ангииты, папуло-сквамозные сыпи, инфекционные эритемы, артифициальные поражения; требуется уточнение причины);
- признаки конъюнктивита (редко);
- неврологические нарушения (атаксия, судороги, некротизирующие (геморрагические) энцефалопатии);
- «ковидные» пальцы (у детей, внешне похожи на обморожение).
Основным источником инфекции является больной человек, в том числе находящийся в инкубационном периоде заболевания. Передача инфекции осуществляется воздушно-капельным, воздушно-пылевым и контактным путями. Ведущим путем передачи SARS-CoV-2 является воздушно-капельный, который реализуется при кашле, чихании и разговоре на близком (менее 2 м) расстоянии. Контактный путь передачи осуществляется во время рукопожатий и других видах непосредственного контакта с инфицированным человеком, а также через пищевые продукты, поверхности и предметы, контаминированные вирусом.
Патогенез. Патоморфологические и гистологические находки
COVID-19-ассоциированное повреждение тканей в первую очередь опосредовано не вирусной инфекцией, а, скорее, является результатом воспалительного иммунного ответа «хозяина», который вызывает гиперцитокинемию и агрессивное воспаление, которые влияют на клетки паренхимы легких, уменьшая перфузию [2].
Ангиотензинпревращающий фермент 2 (АСЕ2) был идентифицирован как основной рецептор для ТОРС коронавируса (SARS-CoV 2), который обильно экспрессируется в легких, респираторном эпителии и альвеолярных моноцитах и может объяснить многие случаи быстро возникающей легочной недостаточности [3]. Однако ACE2 также экспрессируется эндотелиальными клетками в сердце и макрососудистой системе, кишечнике, почках, печени, центральной нервной системе и жировой ткани. Поскольку плотность ACE2 различна в различных тканях (очень высока в легких), то плотность рецепторов может коррелировать с тяжестью заболевания. В физиологическом состоянии ACE2 через свою карбоксипептидазную активность генерирует фрагменты ангиотензина (Ang 1-9 и Ang 1-7) и играет существенную роль в ренин-ангиотензиновой системе (RAS), которая является критическим регулятором сердечно-сосудистого гомеостаза. SARS-CoV-2 через свой поверхностный спайковый гликопротеин взаимодействует с ACE2 и вторгается в клетки хозяина. Оказавшись внутри клеток хозяина, SARS-CoV-2 индуцирует острый респираторный дистресс-синдром (ОРДС), стимулирует иммунный ответ (т.е. цитокиновый шторм) и повреждение сосудов.
Основной причиной смерти является прогрессирующая дыхательная недостаточность из-за диффузного повреждения альвеол. Обобщая результаты исследований из разных стран, включающих данные аутопсии, можно выделить, что наиболее часто со стороны дыхательной системы обнаруживаются:
- макроскопические повреждения – неоднородные диффузные участки консолидации, застой в паренхиме легких;
- гистологические данные: капиллярный застой, наличие гиалиновых мембран, геморрагический некроз эндотелиальных клеток [4].
 В исследовании, опубликованном в The New England Journal of Medicine, проводится сравнительный анализ данных, полученных во время аутопсии пациентов, умерших от COVID-19, и пациентов, умерших от ОРДС, ассоциированного с вирусом гриппа H1N1 [5]. Легкие пациентов с COVID-19 и больных гриппом имели общую морфологическую картину диффузного повреждения альвеол и инфильтрации периваскулярными лимфоцитами. У COVID-19 было три отличительных ангиоцентрических признака. Первой особенностью было тяжелое повреждение эндотелия, связанное с внутриклеточным вирусом SARS-CoV-2 и разрушением мембран эндотелиальных клеток. Во-вторых, в легких пациентов с COVID-19 наблюдался распространенный сосудистый тромбоз с микроангиопатией и окклюзией альвеолярных капилляров (9-кратное увеличение распространения микротромбов). В-третьих, легкие пациентов с COVID-19 имели значительный рост новых сосудов через механизм инвагинационного ангиогенеза.
В исследовании, опубликованном в The New England Journal of Medicine, проводится сравнительный анализ данных, полученных во время аутопсии пациентов, умерших от COVID-19, и пациентов, умерших от ОРДС, ассоциированного с вирусом гриппа H1N1 [5]. Легкие пациентов с COVID-19 и больных гриппом имели общую морфологическую картину диффузного повреждения альвеол и инфильтрации периваскулярными лимфоцитами. У COVID-19 было три отличительных ангиоцентрических признака. Первой особенностью было тяжелое повреждение эндотелия, связанное с внутриклеточным вирусом SARS-CoV-2 и разрушением мембран эндотелиальных клеток. Во-вторых, в легких пациентов с COVID-19 наблюдался распространенный сосудистый тромбоз с микроангиопатией и окклюзией альвеолярных капилляров (9-кратное увеличение распространения микротромбов). В-третьих, легкие пациентов с COVID-19 имели значительный рост новых сосудов через механизм инвагинационного ангиогенеза.
На рисунках 1, 2 представлена морфологическая картина повреждения ткани легких пациентов, умерших от COVID-19.

Хотя вирус первоначально поражает респираторный эпителий, это, вероятно, просто ворота входа инфекции, и основные этапы повреждения альвеол опосредованы главным образом повреждением эндотелия, что приводит к высвобождению цитокинов и хемокинов, рекрутированию иммунных клеток и активации системы свертывания и тромбоза. Вирус проникает в эндотелиальные клетки путем эндоцитоза через связывание своего спайкового гликопротеина с клеточным рецептором, что облегчает прикрепление вируса к поверхности клеток-мишеней. Эти события происходят в легких, но могут распространяться и на другие органы, о чем свидетельствуют сообщения о развитии у пациентов с тяжелой коронавирусной болезнью мультиорганных повреждений, включая повреждение сердца и острое повреждение почек.
Недавние наблюдения показывают, что дыхательная недостаточность при COVID-19 обусловлена не только развитием ОРДС, но и влиянием макрососудистых, а также микрососудистых тромботических процессов. Становится очевидным, что тяжелые случаи COVID-19 характеризуются гипервоспалением и тромботическим феноменом. Такие серьезные неблагоприятные клинические события, по-видимому, предполагают, что на поздних стадиях этого заболевания одной из мишеней является эндотелий, один из самых крупных органов в человеческом организме [6].
Пациенты с COVID-19 обычно демонстрируют нарушения гемостаза, что согласуется с наличием тяжелой коагулопатии, которая предрасполагает к тромботическим явлениям и напрямую коррелирует с тяжестью заболевания. В когорте из 183 пациентов с COVID-19 у 21 пациента с летальным исходом (11,5%), в отличие от выживших, было выявлено значительное повышение уровня Д-димера (фрагмента фибринового белка; ~3,5 раза) и других продуктов распада фибрина (~1,9 раза) [4]. В группе из 22 пациентов с COVID-19, поступивших в отделение реанимации и интенсивной терапии, повышение уровня фибриногена и Д-димера в плазме крови, а также более короткое время свертывания крови и другие нарушения свертывания были достоверно более частыми по сравнению со здоровыми контрольными группами.
Интерлейкин-6 (IL-6), часто аномально повышенный в циркуляции у больных с тяжелым COVID-19, представляет собой провоспалительный цитокин, продуцируемый активированными моноцитами, макрофагами, эндотелиальными клетками и другими клетками, обладающий плейотропным действием, и играет критическую роль в гемостазе. Действуя на гепатоциты, IL-6 способствует синтезу таких факторов свертывания крови, как фибриноген, тканевой фактор и фактор VIII; действуя на костный мозг, стимулирует дифференцировку мегакариоцитов в тромбоциты; действуя на эндотелиальные клетки, индуцирует проницаемость сосудов. Связь между IL-6 и повышенным риском сосудистых тромбозов и тромбоэмболий подтверждается экспериментальными результатами и наблюдательными исследованиями [7]. Кроме того, вследствие связывания рецептора SARS-CoV-2 и ACE2, проникновения в любые клетки клеточная поверхность снижается из-за повышения уровня ангиотензина II, который придает эндотелиальным клеткам провоспалительный, прокоагулянтный и проапоптотический фенотип.
Эндотелий, как еще одна мишень для вируса COVID-19, привлек внимание многих ученых. Z. Varga et al. публикуют исследования, результаты которых показывают наличие вирусных элементов в эндотелиальных клетках и накопление воспалительных цитокинов, что говорит о гибели эндотелиальных и воспалительных клеток [8]. Эти данные свидетельствуют о том, что инфекция SARS-CoV-2 способствует индукции эндотелиита в нескольких органах, как прямому следствию вирусного поражения (как отмечается при наличии вирусных тел) и воспалительной реакции хозяина. Кроме того, индукция апоптоза и пироптоза может играть важную роль в повреждении эндотелиальных клеток у пациентов с COVID-19. COVID-ассоциированный эндотелиит может объяснить системные нарушения микроциркуляторной функции в различных сосудистых руслах и их клинические последствия у пациентов.
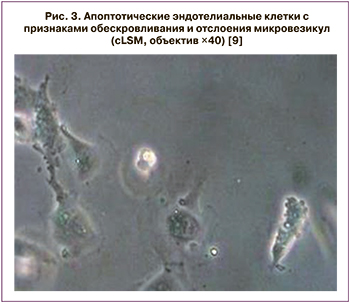 Эндотелиальная дисфункция относится к системному состоянию, при котором эндотелий теряет свои физиологические свойства, включая тенденцию способствовать вазодилатации, фибринолизу и антиагрегации. Сужение артерий некоторых органов, а также микроциркуляторные нарушения в печени, селезенке и почках у пациентов с тяжелой формой COVID-19 неоднократно были описаны. Во время воспалительной активации или апоптоза эндотелиальные клетки становятся прокоагулянтами и высвобождают микровезикулы, которые могут влиять на функцию клеток-мишеней через поверхностное взаимодействие и активацию рецепторов, слияние клеток и доставку внутривезикулярного груза. В частности, было описано, что эндотелиальные микровезикулы влияют на гемостаз.
Эндотелиальная дисфункция относится к системному состоянию, при котором эндотелий теряет свои физиологические свойства, включая тенденцию способствовать вазодилатации, фибринолизу и антиагрегации. Сужение артерий некоторых органов, а также микроциркуляторные нарушения в печени, селезенке и почках у пациентов с тяжелой формой COVID-19 неоднократно были описаны. Во время воспалительной активации или апоптоза эндотелиальные клетки становятся прокоагулянтами и высвобождают микровезикулы, которые могут влиять на функцию клеток-мишеней через поверхностное взаимодействие и активацию рецепторов, слияние клеток и доставку внутривезикулярного груза. В частности, было описано, что эндотелиальные микровезикулы влияют на гемостаз.
На рисунке 3 представлены эндотелиальные клетки пациентов, умерших от COVID-19.
Патологические, а также визуализирующие исследования подтвердили болезнь COVID-19 как ассоциированный с тромбозом воспалительный процесс, который первоначально поражает легкие [9]. На вебинаре Bin Cao из Национального клинического исследовательского центра респираторных заболеваний в Пекине описал диффузные тромбы в мелких сосудах всех органов не только легких, но и сердца, печени и почек в обзоре вскрытия умерших от COVID-19 пациентов [10]. Это утверждение согласуется с опубликованными гистологическими исследованиями аутоптических тканей пациентов с COVID-19. Фибриновые тромбы мелких артериальных сосудов наблюдались в посмертной легочной ткани у 33 из 38 итальянских пациентов, половина из которых имели >25% поражения тканей, связанного с высоким уровнем Д-димера в крови.
При гистологическом исследовании 5 пациентов из США сообщалось о повреждении микрососудов и тромбозе с васкулопатией в септальных капиллярах легких, а также о проникновении нейтрофилов и моноцитов в поврежденные капилляры. В австрийском посмертном исследовании 11 пациентов с COVID-19 имели тромбы в мелких и средних легочных артериях. В аутопсийном исследовании D. Wichmann et al. у 12 пациентов, умерших от COVID-19, обнаружили высокую частоту тромбоза глубоких вен (58%). У трети пациентов непосредственной причиной смерти была легочная эмболия. Кроме того, диффузное повреждение альвеол было подтверждено гистологией у 8 пациентов (67%) [11].
В целом приведенные выше данные свидетельствуют о том, что атипичная тромботическая микроангиопатия, ассоциированная с SARS-CoV-2, может прогрессировать до пролиферативного васкулита с тромбозом артериол и средних и крупных артериальных и венозных сосудов, которые могут развиваться в направлении диссеминированного внутрисосудистого свертывания (ДВС) крови. Несколько факторов могут способствовать активации свертывания крови у пациентов с COVID-19. Повреждение эндотелия приводит к повышению экспрессии тканевого фактора, который активирует внешний путь свертывания крови, и снижению экспрессии антикоагулянтного тромбомодулина. Цитокины, продукты нейтрофилов и патогенные молекулы усиливают синтез прокоагулянтных белков и подавляют фибринолиз. Продукты активации комплемента индуцируют экспрессию тканевого фактора и секрецию фактора фон Виллебранда, а также способствуют секреции тромбоцитарного фактора V и сборке функционального комплекса FXa/FVa. Конечным результатом является циркуляция свободного тромбина, который может активировать тромбоциты и стимулировать фибринолиз с повышенным уровнем Д-димера и продуктов распада фибриногена. Поэтому на заключительной стадии заболевания были зарегистрированы высокие уровни Д-димера и продуктов деградации фибриногена; заметно повышенные уровни Д-димера также коррелировали с более тяжелыми заболеваниями и смертностью [12].
Двадцать один пациент с инфекцией SARS-CoV-2, прошедшие посмертное обследование в исследовании в Базеле, имели перегруженные легкие с гистопатологическими изменениями в виде выраженного застоя капилляров, гиалиновых мембран и диффузного повреждения альвеол. У 4 имела место тромбоэмболия легочной артерии, а у одного – признаки васкулита. У 3 из 18 пациентов гистологическое исследование почек показало наличие фибриновых тромбов, связанных с ДВС-синдромом. Полиорганная недостаточность сопровождает пациентов с тяжелым течением COVID-19 [13].
Еще одним органом-мишенью становятся почки, что подтверждается лабораторными и патогистологическими данными. В опубликованной статье Y. Cheng et al. констатируют, что из 701 COVID-инфицированного пациента, госпитализированного в Ухане, у 44% была протеинурия, а у около 27% – гематурия при поступлении [14]. После корректировки на возраст, пол, тяжесть заболевания и количество лейкоцитов пациенты с повышенным исходным уровнем сывороточного креатинина или повышенной исходной протеинурией имели в 2 и 5 раз более высокий риск госпитальной смерти соответственно, чем пациенты с нормальными параметрами почек.
Патогистологической находкой стали признаки почечного шока. Гистологически эти данные соответствуют диффузному острому повреждению канальцев с расширением просвета, уплощением эпителия и интерстициальным отеком. В образцах почек было обнаружено большое количество вирусной РНК; в двух образцах, исследованных с помощью просвечивающей электронной микроскопии, были обнаружены вирусоподобные частицы в подоцитах, гломерулярных эндотелиальных клетках и особенно в проксимальных канальцевых эпителиальных клетках. У некоторых пациентов развились микротромбы, отмечают T. Menter и J.D. Haslbauer [13].
Случай, описанный Z. Varga et al., о реципиенте почечного трансплантата, заболевшем коронавирусной инфекцией с летальным исходом, у которого с помощью электронной микроскопии в аутопсийном материале пересаженной почки были выявлены вирусные структурные включения в эндотелиальных клетках, еще раз подтверждает, что инфекция SARS-CoV-2 способствует индукции эндотелиита в нескольких органах как прямого следствия вирусного поражения [8].
Все вышеприведенные пункты и недавнее аутопсийное наблюдение эндотелиального повреждения почек и кишечника у пациентов с COVID-19 убедительно свидетельствуют о важности вирусиндуцированной сосудистой дисфункции в прогрессировании заболевания.
В дополнение к лабораторным и гистопатологическим доказательствам нарушения свертывания крови и повреждения эндотелия несколько сообщений предполагают, что пациенты с COVID-19 подвергаются высокому риску развития клинически значимого тромбоза крупных сосудов [15]. Ранее неподтвержденная венозная тромбоэмболия (ВТЭ) у больных в критическом состоянии была подтверждена в нескольких исследованиях, описывающих высокие показатели ВТЭ у пациентов с COVID-19. Сообщения о крупнососудистых инсультах у пациентов, в том числе моложе 50 лет, инфицированных SARS-CoV-2, также свидетельствуют о гиперкоагуляции. Согласно результатам посмертного исследования, среди 12 пациентов с положительным результатом на COVID-19 тромбоз был выявлен в 58% случаев, что привело к 25% летальных исходов.
Специфичная картина поражения COVID-19 отмечается у детей и подростков. «Ковидные» пальцы – симптом, сходный с другими видами обморожения. Однако при исследовании биоптата у 7 педиатрических пациентов были обнаружены следующие гистологические данные: различная степень лимфоцитарного васкулита – от эндотелиального отека и эндотелиита до фибриноидного некроза и тромбоза [16]. Иммуногистохимия SARS-CoV-2 была положительной в эндотелиальных клетках и эпителиальных клетках эккриновых желез. Частицы коронавируса были обнаружены в цитоплазме эндотелиальных клеток при электронной микроскопии. Несмотря на сходство с другими видами обморожения, подтверждена причинно-следственная связь микроангиопатических повреждений с наличием COVID-19 ввиду обнаружения вирусных частиц в биоптатах.
Все вышеперечисленные патологические изменения способствуют ухудшению дыхания и развитию полиорганной недостаточности и являются важными причинами заболеваемости и смертности, о чем свидетельствуют данные, показывающие, что среди 191 пациента с COVID-19, наблюдавшихся в 2 больницах Уханя, уровень Д-димера более 1 мкг/л при поступлении предсказывал 18-кратное увеличение рисков смертельного исхода до выписки [17]. По этим причинам недавно было предложено использовать антикоагулянты как потенциально необходимую терапию у пациентов с тяжелой формой COVID-19, хотя их эффективность и безопасность не были продемонстрированы.
Механизм гиперкоагуляции и гепарины
 Чрезвычайно повышенный уровень Д-димера является результатом гиперактивного фибринолиза, связанного с плазмином, и роли системы плазминоген/плазмин в болезни COVID-19, что было исследовано в ряде работ. Повышенная восприимчивость к инфекции SARS-CoV-2 и летальность были зарегистрированы у пациентов с уже существующими сопутствующими заболеваниями, включая гипертонию, диабет, ишемическую болезнь сердца, цереброваскулярные заболевания, хроническую обструктивную болезнь легких и хроническую болезнь почек. Повышенный уровень плазминогена/плазмина часто встречается у людей с несколькими соматическими заболеваниями, и было обнаружено, что плазмин усиливает вирулентность и инвазивность вируса SARS-CoV-2, расщепляя его спайковые белки [6].
Чрезвычайно повышенный уровень Д-димера является результатом гиперактивного фибринолиза, связанного с плазмином, и роли системы плазминоген/плазмин в болезни COVID-19, что было исследовано в ряде работ. Повышенная восприимчивость к инфекции SARS-CoV-2 и летальность были зарегистрированы у пациентов с уже существующими сопутствующими заболеваниями, включая гипертонию, диабет, ишемическую болезнь сердца, цереброваскулярные заболевания, хроническую обструктивную болезнь легких и хроническую болезнь почек. Повышенный уровень плазминогена/плазмина часто встречается у людей с несколькими соматическими заболеваниями, и было обнаружено, что плазмин усиливает вирулентность и инвазивность вируса SARS-CoV-2, расщепляя его спайковые белки [6].
На рисунке 4 представлены механизмы нарушения свертывания крови при COVID-19.
Повышенные уровни плазминогена/плазмина обнаруживаются при различных заболеваниях, включая гипертонию, диабет, сердечно-сосудистые заболевания, цереброваскулярные заболевания и хронические заболевания почек [18]. Кроме того, при сепсисе и других воспалительных состояниях показано повышенное высвобождение гистонов и нуклеосом (ДНК+гистоны), токсичных элементов для эндотелия.
Гепарины – это антикоагулянтные препараты, которые в настоящее время используются для профилактики и терапии ВТЭ и классифицируются по их молекулярной массе [6]. Гепарин обратимо связывает антитромбин III и усиливает его последующее ингибирующее действие на активированный фактор Х и тромбин (фактор Ха). Гепарин также обладает противовоспалительными свойствами. Как описано ранее, гистоны, высвобождаемые из поврежденных клеток, могут повреждать эндотелиальные клетки, а гепарин, как было показано, антагонизирует гистоны и таким образом «защищает» эндотелий. Другой механизм действия гепарина характеризуется его влиянием на метилирование гистонов и на митоген-активированные сигнальные пути протеинкиназы. Таким образом, гепарин может защитить от микроциркуляторной дисфункции и, возможно, уменьшить повреждение органов. Экспериментальные модели показывают потенциальную противовирусную роль гепарина: действительно, его полианионные полисахаридные нити могут связываться с различными белками, и поэтому гепарин может действовать как эффективный ингибитор вирусной адгезии.
Конструктивность применения гепарина в качестве антикоагулянта при COVID-19 впервые была подтверждена ретроспективным отчетом о 449 пациентов из Уханя, 99 из которых получали гепарин (в основном низкомолекулярный (НМГ)) в течение 7 дней и более. Показатели Д-димера, протромбинового времени и возраста были положительными, а количество тромбоцитов – отрицательным, что коррелировало со смертностью в течение 28 дней при многомерном анализе [18]. Не было обнаружено разницы в смертности в течение 28 дней между пациентами, использовавшими гепарин, и не применяющими его (30,3% против 29,7%, Р=0,910). Но смертность в течение 28 дней при терапии пациентов гепарином была ниже, чем у пациентов, не употреблявших его, с SIC-score ≥4 (40,0% против 64,2%; Р=0,029) с уровнем Д-димера, в 6 раз превышающим верхнюю границу нормы (32,8% против 52,4%; Р=0,017) [19].
Наконец, в недавнем докладе Tang et al. был отмечен благоприятный исход при использовании НМГ у пациентов с тяжелым течением COVID-19, отвечающим критериям сепсис-индуцированной коагулопатии или с заметно высокими уровнями Д-димера [19]. Было изучено 99 пациентов, которые получали гепарин в течение не менее 7 дней; почти у всех пациентов (n=94) эноксапарин применялся подкожно (40–60 мг/сут); 5 пациентов получали нефракционированный гепарин (НФГ; 10 000–15 000 ЕД/сут).
НМГ эффективно ингибируют активированный фактор X (фактор Xa), оказывая при этом меньшее ингибирующее действие на тромбин по сравнению с НФГ. Было показано, что препараты НМГ сохраняют свою эффективность в отношении тромбоэмболий и по сравнению с НФГ демонстрируют повышенную биодоступность и необходимость менее частого введения.
НМГ обладают некоторыми противовирусными свойствами in vitro и обычно используются у пациентов с COVID-19 для предотвращения или обхода активации коагуляционного каскада, индуцированного воспалением [20]. В ретроспективном исследовании терапия НМГ снижала высвобождение и активность IL-6, который отвечает за «цитокиновый шторм», и у пролеченных пациентов также был более высоким процент лимфоцитов. Терапия НМГ также ассоциируется с лучшими исходами у тяжелых пациентов с сепсис-индуцированной коагулопатией и заметно повышенным уровнем Д-димера [21].
Также в ретроспективном обзоре 245 COVID-положительных пациентов, поступивших в отделения реанимации и интенсивной терапии с механической вентиляцией легких, было отмечено преимущество в выживаемости (57% против 25%) через 35 дней у пациентов, получавших терапевтическую дозу антикоагулянтов минимум в течение 5 дней, по сравнению с теми, кто получал профилактическую терапию [22]. После корректировки исходных различий было выявлено снижение смертности на 79% у пациентов, получавших терапевтическую дозу антикоагулянтов. Осложнения в виде кровотечений были одинаковы в обеих группах.
Терапевтические эффекты гепарина при COVID-19 представлены на рисунке 5.

Классическая функция гепарина как антикоагулянта, благодаря его взаимодействию с антитромбином-III (АТIII), может оказаться полезной из-за высокой распространенности коагулопатии и клинически значимого тромбоза при этом заболевании.
Считается, что проникновение коронавируса SARS-CoV-2 во время ТОРС как в эндотелиальные, так и в эпителиальные клетки зависит от его взаимодействия с клеточной поверхностью гепарансульфата; таким образом, гепарин (или тщательно разработанные синтетические гепариноподобные препараты) может ингибировать это взаимодействие и блокировать проникновение вируса.
Известные противовоспалительные эффекты гепарина могут оказать положительный эффект в лечении COVID-19.
Заключение
Многочисленные исследования, включающие данные аутопсии и гистологического исследования, подтверждают эндотелиальную дисфункцию при заболевании коронавирусной инфекцией и отмечают повышенный риск ВТЭ у пациентов с тяжелым течением. Основными прогностически важными лабораторными критериями остаются повышение уровней Д-димера и продуктов деградации фибриногена, что коррелирует с более высоким риском тяжелого течения заболевания и смертностью. Учитывая наличие коагулопатии, гепарин может быть эффективным и доступным препаратом для снижения рисков развития ТОРС. Кроме того, следует учитывать его противовирусную и противовоспалительную активность, что немаловажно для нивелирования высвобождения провоспалительных цитокинов и уменьшения повреждающего действия вируса на эндотелий.
Необходимо учитывать, что терапия НМГ снижала высвобождение и активность IL-6, который отвечает за цитокиновый шторм; это ассоциируется с лучшими исходами лечения у пациентов с тяжелым COVID-19 с сепсис-индуцированной коагулопатией. Также применение терапевтических доз оказалось более рациональным для снижения смертности у пациентов с тяжелым течением. Таким образом, на данном этапе понимания патофизиологии коронавирусной инфекции такое антикоагулянтное лечение является наиболее оправданным и эффективным.



