Сохранение здоровья матери и плода – основная цель акушерства и важная задача социально-экономической политики государств, так как репродуктивные потери определяют показатели общей смертности и рождаемости, отражая негативные тенденции прироста населения [1–4]. К осложнениям беременности с высокими перинатальными потерями относят: преэклампсию (ПЭ) – возможную причину материнской смертности (ежегодно в мире 50–60 тыс. смертей) [5, 6] и синдром задержки роста плода (СЗРП) – причину плодовой и младенческой смертности (более 1 млн в год на планете) [7, 8]. Эти акушерские заболевания – результат двух контрнаправленных путей «катастрофы» в организме беременной. Один вызывает срыв адаптации в функциональных системах матери, а другой – плода, хотя патогенетически ПЭ и СЗРП схожи [1, 9–11], поскольку в обоих случаях формируются «редуцированная» сосудистая сеть и «синдром обкрадывания» в системе «мать–плацента–плод» из-за функциональной несостоятельности эндотелия [12].
Возможным фоном для реализации такой функциональной декомпенсации сосудистой системы при беременности могут стать хронические соматические заболевания матери, например, актуальные в нынешнее время ожирение и сахарный диабет, частота распространения которых среди женщин репродуктивного возраста в ряде стран достигает 50% [13–16]. Этим может объясняться сохраняющийся стабильно высокий уровень ПЭ и СЗРП в структуре акушерской заболеваемости (2,4–31,1%) [1, 17], несмотря на имеющиеся знания о причинно-следственных механизмах их развития [18]. Поэтому изменившийся «биологический профиль» современной беременной диктует необходимость продолжать поиск и исследования в этой области патологического акушерства.
Цель исследования: изучить особенности изменений ряда показателей углеводного обмена и системы гемостаза при ПЭ и СЗРП у женщин с гестационным сахарным диабетом (ГСД) в динамике беременности.
Материалы и методы
В ретроспективном когортном пятилетнем (2013–2018 гг.) исследовании, которое осуществлено в НИИ акушерства и педиатрии ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, принимали участие 1483 первобеременных женщин с одноплодной беременностью, осложненной ГСД, в возрасте от 18 до 40 лет (критерии включения). ГСД выставлялся по диагностическим критериям, изложенным в Национальном консенсусе и клинических рекомендациях (протокол лечения) «Гестационный сахарный диабет: диагностика, лечение, послеродовое наблюдение» (2013). По клиническому течению беременных распределили на группы: I группа (основная) – 65 женщин с ГСД и ПЭ; II (основная) – беременные с ГСД и СЗРП – 71 пациентка и III (контрольная) – 75 беременных с ГСД без акушерской патологии (бАП). Определение пациенток в группы с акушерскими заболеваниями производилось по критериям диагностики преэклампсии (Российские клинические рекомендации от 07.06.2016 г. №15-4/10/2-3483 «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия») и на основании данных УЗИ (фетометрия плода). Критерии исключения: все эндокринные заболевания, кроме ГСД; экстрагенитальная патология в стадии обострения или декомпенсации; беременность после программ вспомогательных репродуктивных технологий; многоплодная беременность; наличие онкологических и психических заболеваний; алкоголизм и наркомания; пороки развития у матери и плода.
Получены заключение Этического комитета и информированное согласие пациенток на проведение дополнительных методов исследования в рамках проводимой работы, соответствующие этическим принципам проведения медицинских исследований (Декларация Всемирной медицинской ассоциации, Хельсинки, Финляндия, 2013, 9-й пересмотр).
Ультразвуковое исследование проводилось на приборе Siemens Sonoline G 50 (Германия) (3,5 МГц) двумерным методом с цветным допплеровским картированием. Методом иммуноферментного анализа (ИФА) выполнялось определение активированного частичного тромбопластинового времени (АЧТВ), растворимых фибрин-мономерных комплексов (РФМК), фибриногена – наборами Siеmens (Германия) и Д-димера – наборами Technozym D-dimer ELISA (Австрия). В плазме крови определялись базальные уровни глюкозы (фотометрический метод, набор «Глюкоза», Biosystems (Испания)), иммунореактивного инсулина (ИРИ) (ИФА, DRG Insulin ELISA EIA-2935 (Германия)) и С-пептида (радиоиммунологический метод, Beringwerke-AG (Германия)). Индекс инсулинорезистентности (ИР) НОМА-IR (D. Matthews, 1985) рассчитывался по формуле: глюкоза×ИРИ/22,5. Значение НОМА-IR>2,77 расценивалось как ИР. Забор венозной крови осуществлялся натощак и у беременных с акушерской патологией (СЗРП и ПЭ) – до начала терапии.
Статистический анализ
Многие биологические характеристики распределены не по нормальному закону [19]. Большинство биологических характеристик не подчиняются нормальному закону распределения, поэтому в качестве дескриптивных статистик применялись процедуры описательной статистики, с помощью которых находились (оценивались) значения медианы и интерквартильного размаха (25%;75%). Обработка исходных признаков осуществлялась с использованием пакетов прикладных программ Excel 2010, IBM SPSS 25.0.0.2. Для сравнения межгрупповых различий использовали непараметрический критерий Краскела–Уоллиса для независимых выборок. Затем, при наличии статистически значимых различий, проводился апостериорный анализ (или попарное сравнение групп) с помощью критерия Манна–Уитни с поправкой Бонферрони. Статистическая значимость показателей (р) устанавливалась при значении меньше 0,05.
Результаты и обсуждение
Важным параметром оценки репродуктивного здоровья является возраст беременных женщин. Статистический анализ данных возраста в группах показал, что средний возраст беременных с ПЭ составил 28,51 года [20,41;38,02], с СЗРП – 26,05 года [21,30;29,12] и в группе бАП – 28,16 года [20,04; 33,18]. Для всех групп преобладающим явился возраст 24–29 лет, составивший для всей генеральной выборки 44,6%. Его доля в I группе составила 42,3%, во II группе – 43,2% и в III группе – 45,5%, то есть группы оказались однородными по возрасту.
Так как избыточный вес является одной из причин формирования ГСД и осложнений беременности, была проведена оценка ИМТ. Наибольший ИМТ выявлен в группе с ПЭ – 24,19 кг/м2 [23,71;26,05], наименьший – у беременных с СЗРП – 23,16 кг/м2 [19,04;24,18], а в группе бАП – 24,12 кг/м2 [18,28; 27,43], но статистически значимых межгрупповых различий установлено не было.

Используемые в настоящее время гестационные пороговые значения уровня гликемии основаны на международном консенсусе относительно риска неблагоприятных исходов беременности. Гипергликемия, впервые возникшая при беременности, характеризующаяся умеренным повышением уровня глюкозы в крови матери, прежде всего оказывает негативное влияние на плод – вызывает диабетическую фетопатию (гипо- или гипертрофный варианты), гибель плода/новорожденного, синдром дыхательных/церебральных расстройств новорожденного и др. [20, 21]. Но и здоровью матери ГСД может нанести непоправимый вред и стать провоцирующим фактором в инициации таких осложнений, как ПЭ/эклампсия, отслойка плаценты, HELLP-синдром, сахарный диабет 2-го типа и др. [20, 22, 23]. Однако непонятно, при каких условиях на фоне ГСД возникает срыв адаптации в плодовом организме и при каких – в материнском, следуя чему, в динамике трех триместров проанализированы уровни глюкозы, ИРИ, С-пептида, индекс HOMA-IR, отражающие выраженность гипергликемии и ИР в организме матери (таблица), и параметры гемостаза (Д-димер, АЧТВ, фибриноген, РФМК), указывающие на напряженность свертывающей системы крови (рис. 1, 2).
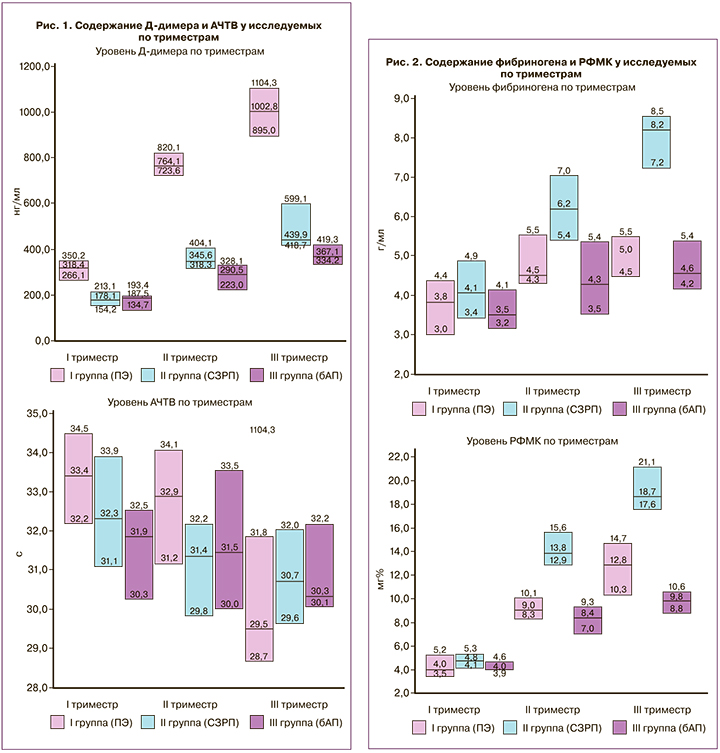
Уровень гликемии имел значимое повышение только в I группе: на 19,4% к родам, 11,3% – во II триместре и 18,5% – в III триместре к группе бАП, а также на 13,6% во II триместре к группе с СЗРП (таблица). Значения ИРИ в выборке колебались в пределах 8,8–16,4 мкЕд/мл. Наибольшие абсолютные значения (значимый максимальный пик на 29,6% к III триместру) определены в группе ПЭ, которые имели значимость в I (на 17,0%) и II триместрах (на 25,7%) по сравнению с бАП, а в III триместре (на 11,3%) – с СЗРП. Для группы СЗРП значимый прирост на 24,1% установлен к родам. Таким образом, по мере приближения срока родов уровень глюкозы и ИРИ увеличиваются. Причем все показатели соответствовали норме до 20–26 мкЕд/мл (согласно возрастным нормам). Однако значения ИРИ >12,5 мкЕД/мл уже связывают с присутствием ИР.
С-пептид является стойким фрагментом проинсулина, который не разрушается печенью, имеет больший период полужизни (до 30 минут), чем инсулин, выделяется в эквимолярных инсулину количествах и не дает с ним перекреста. Уровень С-пептида в группах соответствовал норме на протяжении беременности. Отмечалось его значимое повышение к родам при ПЭ и СЗРП на 53,3 и 43,0% соответственно и в III триместре на – 37,7% при ПЭ к бАП. Такая тенденция в содержании С-пептида, возможно, связана с более высокими уровнями ИРИ при ПЭ в сравнении с группой СЗРП и бАП.
Поскольку уровни глюкозы, ИРИ и С-пептида по отдельности не могут корректно отражать состояние ИР, произведен расчет индекса ИР с помощью малой модели гомеостаза HOMA-IR как наиболее оптимальной для случаев ГСД, где гипергликемия натощак в основном отмечалась до 7,0 ммоль/л. Ввиду того, что к родам во всех группах отмечалось увеличение уровня гликемии и ИРИ натощак, закономерно повышение и HOMA-IR. Он был значимо выше у беременных с ПЭ (на 14,7 и 23,1% соответственно) к СЗРП во II и III триместрах и к бАП – в I (на 29,5%) и III (на 36,6%) триместрах. При СЗРП значимое превышение индекса к бАП было в III триместре на 17,6%, а также к родам – на 35,1%. При ПЭ максимальное число беременных с ранних сроков имели ИР (26,1% – у 17 женщин); при СЗРП (30,9% – у 22) и бАП (8,0% – у 6) только со II триместра. В группе ПЭ и СЗРП ИР к родам составила 100%, а в бАП – всего 42,7% (у 32 беременных). Таким образом, при ПЭ отмечены статистически значимо более выраженные сдвиги в углеводном обмене, нежели при СЗРП и бАП.
Нередко развитие акушерских осложнений на фоне ГСД связывают с тромбофилией в результате нарушенной функции эндотелия сосудов в функциональной системе «мать–плацента–плод» [24], но неясно, какие изменения гемостаза и их выраженность сопутствуют ПЭ, а какие – СЗРП. У беременных с ГСД проведен анализ ряда показателей плазменного звена гемостаза, с учетом акушерской ситуации. Установлено, что при ПЭ уровень Д-димера значимо выше в I триместре – на 44,1% к СЗРП, во II триместре – на 61,9% к бАП и в III триместре – к обеим группам (на 56,1% – к СЗРП и на 63,4% – к бАП). Повышение значений этого продукта деградации фибрина имелось во всех группах к родам, что указывает на нарастание коагуляционного потенциала крови. Однако только у беременных с ПЭ имелось значимое увеличение уровня Д-димера (ко II триместру – на 58,3% и к III триместру – на 68,2%). Уровень АЧТВ во всех клинических группах оказался довольно стабильным и не имел значимых различий (рис. 1). Возможным объяснением такой устойчивости может стать то, что АЧТВ отражает время формирования кровяного сгустка (активацию внутреннего пути свертывания крови), и в условиях отсутствия источника кровотечения нет необходимости в выраженной активации гемостаза. Это мнение подтверждается Erhabor O. et al. (2013) [25], которые указывают, что уровень АЧТВ должен использоваться для мониторинга акушерских кровотечений.
Уровни фибриногена и РФМК значимо выше были при СЗРП (рис. 2). Фибриноген был выше на 30,8% во II триместре к бАП, на 38,6 и на 44,4% – в III триместре к ПЭ и к бАП соответственно и нарастал к родам (I–III триместр – на 50,5% и II–III триместр – на 24,5%). Уровень РФМК при СЗРП также преобладал к ПЭ и бАП во II (на 34,8 и 39,6% соответственно) и III (на 31,1 и 47,3% соответственно) триместрах, со значимым максимальным увеличением к родам на 74,4%. Между тем и в группе с ПЭ к родам уровни фибриногена и РФМК значимо увеличивались (на 24,1 и 68,6%).
Следовательно, при ПЭ система гемостаза отличается повышением уровня Д-димера, а при СЗРП – фибриногена и РФМК. То есть более выраженное напряжение коагуляции имеется при ПЭ. Hale S.A. et al. (2012) также сообщали, что при ПЭ имеет место более выраженная прокоагуляционная активность гемостаза, проявляющаяся высокими уровнями Д-димера. Только исследователи не учитывали фактор присутствия ГСД [26].
Зная, что функциональная полноценность эндотелия сосудов при избыточных концентрациях глюкозы в кровотоке нарушается за счет беспрепятственного проникновения последней в его инсулиннезависимые клетки [12, 14, 27], можно предположить следующее. На фоне декомпенсированного ГСД формируется эндотелиопатия в функциональной системе «мать–плацента–плод», активируется прокоагуляционное звено гемостаза, тем самым нарушая чувствительные механизмы материнско-плодового взаимодействия, приводя к ПЭ или СЗРП. Что и подтверждают результаты нашего исследования. В связи с чем возможно рассмотреть вопрос о профилактическом назначении данной группе пациенток препаратов, снижающих коагуляционный потенциал крови (антикоагулянтов, низкомолекулярных гепаринов и др.), разрешенных к применению во время беременности.
Для объективности оценки углеводного обмена и свертывающей системы крови при ГСД проведен анализ соматической заболеваемости исследуемых. В генеральной выборке на первый план вышли заболевания системы крови (57,1%), ведущий диагноз – анемия. Затем следуют заболевания глаз (31,9%), в основном миопии, и на третьей позиции – болезни желудочно-кишечного тракта (24,2%), в основном гастриты и холециститы. Имелись заболевания сердечно-сосудистой системы – 10,5% (варикозная болезнь вен нижних конечностей, пролапс митрального клапана без нарушения кровообращения, нарушения сердечного ритма), мочевыделительной системы (циститы и пиелонефриты) – 9,1% и дыхательных путей (тонзиллиты, бронхиты и пневмония) – 8,2%. Группы были сопоставимы по распределению соматической заболеваемости, значимых отличий выявлено не было.
Заключение
Установлено, что со II триместра у беременных с ГСД при ПЭ отмечаются значимо более высокие уровни гликемии – ≥6,03 [5,72;6,74] ммоль/л и ИР – ≥3,53 [2,98;4,21], наряду с повышением уровня Д-димера ≥764,08 [723,57;820,12] нг/мл; а в ситуации c ГСД и СЗРП имеет место преобладание значений фибриногена – ≥6,19 [5,40;7,04] г/л и РФМК – ≥13,84 [12,92;15,62] мг/%. То есть напряженность плазменного коагуляционного звена гемостаза косвенно свидетельствует о дисфункции эндотелия сосудистой сети в системе «мать–плацента–плод» у беременных с ГСД (на фоне нарастающих уровней гипергликемии), выраженность декомпенсации которой способствует локальной дезадаптации в системе плода в форме СЗРП или системной – в материнском организме с развитием ПЭ.
Беременных с некомпенсированной формой ГСД можно отнести к группе риска по развитию клинически значимых гестационных коагулопатий, способствующих развитию грозных акушерских осложнений со стороны матери (ПЭ) и плода (СЗРП). Наряду с контролем гликемии им целесообразно проводить динамический контроль уровня ИРИ (позволяющий судить о выраженности ИР и углеводных нарушений) и коагулограммы (включая определение таких параметров, как фибриноген, РФМК и Д-димер) не реже 1 раза в триместр.



