У эмбрионов человека хромосомный мозаицизм определяется как две или более отдельных клеточных линий внутри одного эмбриона и является достаточно частым явлением, которое широко обсуждается в области вспомогательных репродуктивных технологий (ВРТ) [1]. Мозаицизм может возникать в результате митотического кроссинговера, соматических мутаций в зиготе или на ранних стадиях дробления, ошибок сегрегации при делении клеточного ядра и генотерапии [2]. Традиционно считалось, что только генетические нарушения в ооцитах или сперматозоидах ответственны за возникновение аномальных эмбрионов. Тем не менее в настоящее время доказано, что мозаицизм также возникает во время первых митотических делений [3]. Во время преимплантационного периода мозацизм является относительно частым явлением, однако на различных стадиях развития эмбриона степень мозаицизма колеблется. Считается, что степень мозаицизма максимальна на 2–3-и сутки развития и уменьшается к 5–6-му дню после оплодотворения. Способность эмбрионов самостоятельно компенсировать мозацизм по мере своего развития отражает возможный физиологичный характер данного явления и необходимость более тщательной интерпретации результатов преимплантационного генетического тестирования (ПГТ) [4].
В литературе описано несколько моделей, объясняющих, почему происходит уменьшение уровня мозаицизма эмбриона на стадии бластоцисты. Естественный отбор чаще работает против мозаичных эмбрионов – in vivo может происходить элиминация эмбриона на основании доли анеуплоидных клеток в нем на разных этапах развития. Другая модель – это модель «клонального истощения», которая описывает апоптотические изменения клеток эмбриона и элиминацию анеуплоидных клеток у эмбрионов с мозаицизмом. И третья модель описывает коррекции анеуплоидий, которые позволяют клеткам с моносомией или трисомией разделяться на клетки с эуплоидным количеством хромосом [5, 6].
При биопсии трофэктодермы уровень мозаицизма, по разным данным, составляет от 4 до 32%. С введением высокопроизводительного секвенирования следующего поколения (NGS) теперь возможно диагностировать хромосомный мозаицизм на уровне от 20 до 80% [7]. Тем не менее в зависимости от степени выраженности мозаицизма и его локализации результат биопсии трофэктодермы эмбриона и последующая интерпретация данных ПГТ-А (преимплантационное генетическое тестирование на анеуплоидии) не всегда соответствует истинным показателям. Мозаицизм может затрагивать как весь эмбрион, так и отдельные его части: трофэктодерму, из которой образуется плацента, или внутриклеточную массу (ВКМ), которая дает начало эмбриону. Если мозаицизм затрагивает только ВКМ, то результат биопсии трофэктодермы у такого эмбриона будет соответствовать эуплоидному эмбриону. Если биопсия трофэктодермы была произведена у эмбриона, мозаичного по клеткам трофэктодермы, но в исследуемый образец попали эуплоидные клетки, результат ПГТ-А будет интерпретирован в пользу эуплоидного эмбриона. В таблице представлены точность диагностики различной степени и локализации мозаицизма у анализируемого эмбриона и возможные варианты диагностических ошибок. Представленные данные подтверждают, что процент мозаицизма в образце биопсии не всегда может быть прямым показателем процента мозаицизма во всем эмбрионе [8].
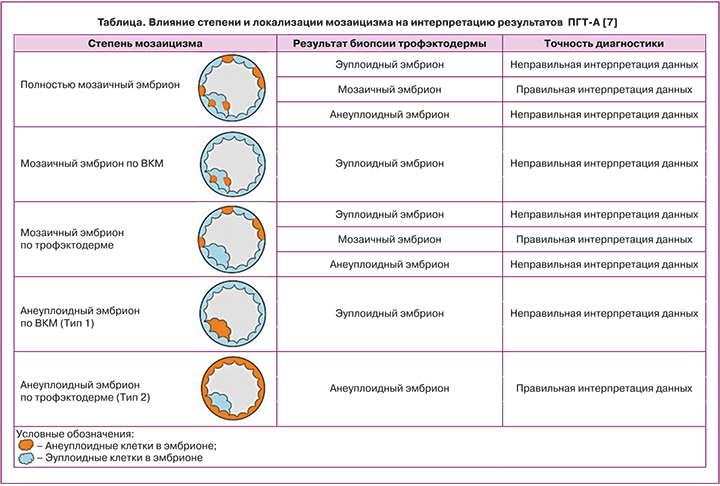
Несмотря на отсутствие определенного ограничения для определения мозаицизма, Международное общество преимплантационной генетической диагностики (PGDIS, 2019) предлагает эмбрион с более чем 20% анеуплоидных клеток считать мозаичным. Это означает, что эмбрионы с более низким уровнем мозаицизма следует рассматривать как нормальные (эуплоидные). Мозаичные эмбрионы отличаются по степени (низкая, средняя или высокая) и типу мозаицизма (сегментарный, одиночная хромосома, двойная хромосома или сложный мозаицизм) [9]. Результаты нескольких крупных исследований показали, что мозаичные эмбрионы могут имплантироваться и приводить к рождению здоровых детей в программах ВРТ [10]. В исследовании Spinella F. et al., опубликованном в 2017 г., было показано, что исход беременности при переносе мозаичного эмбриона зависит от степени мозаицизма и типа анеуплоидии [11].
Существуют предположения, что в случае соматических клеток мозаицизм обладает благотворным влиянием на организм. Например, в нейронах мозаицизм встречается очень часто, что позволяет разнообразить их функциональный статус [12–14]. Однако чаще всего мозаицизм связывают с очевидно отрицательными последствиями, например, с повышенной частотой прерывания беременности, появлением врожденных дефектов, задержками и расстройствами развития. Чем выше уровень мозаицизма эмбриона, тем ниже вероятность имплантации и выше риск выкидыша. В научной литературе сообщается о статистически значимом снижении частоты наступления клинической беременности, имплантации и живорождении при переносе эмбрионов с высоким уровнем мозаицизма по сравнению с мозаичными эмбрионами, имеющими более низкий процент анеуплоидии [11]. Стоит отметить, что частота встречаемости мозаицизма, в отличие от частоты анеуплоидий, не зависит от возраста матери [15].
Метод ПГТ-А, впервые представленный в конце 1980-х гг., осветил более широкое понимание частоты и характеристики анеуплоидии у эмбрионов человека [16]. Технологии ПГТ-А анализируют эуплоидный/анеуплоидный статус бластоцисты после процедуры биопсии трофэктодермы с целью определения и последующего переноса эуплоидного эмбриона, что увеличивает вероятность успеха программы ВРТ [17]. Изначально метод ПГТ-А проводился на единичных бластомерах эмбрионов на стадии дробления через 3 дня после оплодотворения, но результаты рандомизированных контролируемых исследований не показали улучшения показателей живорождения по сравнению с контрольной группой (без ПГТ) [18]. Согласно современным протоколам, ПГТ-А рекомендуют проводить на образцах из 5–10 клеток трофэктодермы, полученных от бластоцисты 5-го дня культивирования. Проведение ПГТ-А на 5-е сутки после оплодотворения рекомендовано в связи с более высоким потенциалом развития у таких эмбрионов, меньшим риском травматизации эмбриона и возможности биопсии большего числа клеток без вреда для дальнейшего развития, а также в связи с более низким уровнем мозаицизма на стадии бластоцисты [19].
Проведение ПГТ-А позволило оптимизировать выбор эмбрионов для переноса в полость матки в программах ВРТ, что, в свою очередь, привело к увеличению частоты наступления беременности, уменьшению репродуктивных потерь и снижению риска рождения детей с генетическими нарушениями [20]. Согласно утвержденным клиническим рекомендациям по диагностике и лечению бесплодия, опубликованным в 2019 г., проведение ПГТ-А рекомендовано в следующих ситуациях [21]: женщинам старшего репродуктивного возраста; при наличии 2 и более самопроизвольных прерываний беременности в анамнезе; при повторных неудачных попытках переноса «свежих» или размороженных эмбрионов; при наличии тяжелых нарушений сперматогенеза у мужчин.
Перенос мозаичного эмбриона в программах ВРТ
В 2015 г. Greco E. et al. впервые сообщили о рождении здорового ребенка после переноса мозаичного эмбриона [10]. Результаты последующих исследований показали, что перенос мозаичных эмбрионов приводит к снижению частоты имплантации и повышению риска самопроизвольного прерывания беременности по сравнению с переносом эуплоидных эмбрионов [22]. Согласно данным PGDIS, в программе ВРТ для переноса более предпочтительны эмбрионы с моносомией, чем с трисомией, даже учитывая, что такие эмбрионы могут быть нежизнеспособны (кроме 45, Х). При переносе эмбриона с трисомией по одной хромосоме необходимо учитывать степень мозаицизма и специфику самой хромосомы. Для переноса наиболее предпочтительными кандидатами служат эмбрионы с трисомией по хромосомам 1, 3, 4, 5, 6, 8, 9, 10, 11, 12, 17, 19, 20, 22, Х, Y. Беременность, наступившая после переноса бластоцисты с трисомией по хромосомам 2, 7, 16, ассоциирована с повышенным риском задержки внутриутробного развития плода. В программе ВРТ не рекомендовано выполнять перенос эмбрионов с мозаичной трисомией по хромосомам 13 (синдром Патау), 18 (синдром Эдвардса) и 21 (синдром Дауна) [23]. Стоит отметить, что мозаичные эмбрионы могут быть единственными эмбрионами, доступными для переноса. Несмотря на то что в исследовании Munne et al. было показано, что частота наступления беременности отличается при переносе эуплоидного и мозаичного эмбрионов (63 и 37% соответственно); эмбрионы с содержанием мозаичных клеток, не превышающим 50%, имеют более благоприятный прогноз в отношении наступления и развития беременности, чем эмбрионы с высоким уровнем мозаицизма [24, 25]. Тем не менее описаны и обратные ситуации, когда при переносе эуплоидного эмбриона по результатам ПГТ-А беременность прерывалась на ранних сроках или заканчивалась рождением ребенка с хромосомными нарушениями [26]. Таким образом, стоит подчеркнуть, что к результату ПГТ-А стоит относиться крайне дифференцированно, так как образец клеток, полученный при биопсии трофэктодермы, не всегда соответствует всему эмбриону.
Материалы и методы
На базе отделения вспомогательных технологий в лечении бесплодия им проф. Б.В. Леонова и лаборатории молекулярно-генетических методов было проведено исследование, включающее анализ трофэктодермы 17 эмбрионов, не подлежащих переносу в полость матки, с помощью метода NGS. Оплодотворение ооцитов проводилось методом ИКСИ, после чего оплодотворенные клетки были перенесены в культуральную среду CSCM (Irvine Sc., США) с целью дальнейшего культивирования. Оценку наступления стадии двух пронуклеусов (формирования зиготы) проводили через 14–16 ч после оплодотворения. Все этапы культивирования проводили в мультигазовых инкубаторах СООК (Ирландия) в каплях по 25 мкл под маслом (Irvine Sc., USA). Среду CSCM (Irvine Sc., США) не меняли в течение 5 суток культивирования. На 5-е сутки после оплодотворения была проведена процедура биопсии трофэктодермы с последующей криоконсервацией биопсированных эмбрионов. Полученные клетки трофэктодермы были перенесены в пробирки типа Эппендорф, содержащие лизирующий буфер, для проведения молекулярно-генетической диагностики исследуемых образцов. Процедура ПГТ-А состояла из нескольких этапов: на первом этапе были проведены полногеномная амплификация и подготовка библиотеки для нанесения на чип. Для создания библиотеки к фрагментам ДНК присоединялись специальные молекулярные метки-баркоды, уникальные для каждого образца в постановке. Далее было выполнено ионное полупроводниковое секвенирование с последующим биоинформатическим анализом результатов и подготовкой заключения на основании полученных данных согласно стандартной методике ПГТ-А [27].
Результаты
 Согласно результатам, полученным в ходе проведения NGS, было обнаружено, что все эмбрионы, включенные в настоящее исследование, соответствовали анеуплоидным и не были рекомендованы к переносу. После получения разрешения супружеской пары на использование эмбрионов в научных целях и подписания необходимых заявлений анеуплоидные эмбрионы в условиях эмбриологической лаборатории были разделены с помощью лазера и микроманипулятора на 3 части: ВКМ, образец трофэктодермы № 1, образец трофэктодермы № 2. Полученные клетки, соответствующие трем частям анализируемых анеуплоидных эмбрионов, согласно результатам ранее проведенной общей биопсии трофэктодермы, были отправлены на повторный анализ с помощью метода NGS. У 15 эмбрионов хромосомный набор в исходном образце клеток трофэктодермы совпадал с образцами клеток, полученными при разделении эмбриона на три части. Однако у двух эмбрионов были обнаружены дополнительные хромосомные нарушения в образце клеток из ВКМ и трофэктодермы № 1 и № 2, представленные на рисунках 1 и 2. У эмбриона № 1 при проведении NGS были обнаружены дополнительные хромосомные нарушения, не детектированные в общем образце клеток трофэктодермы (рис. 1). Клетки из ВКМ у эмбриона № 1 содержали делецию и дупликацию по одной из хромосом, а в образце трофэктодермы № 2 была обнаружена моносомия.
Согласно результатам, полученным в ходе проведения NGS, было обнаружено, что все эмбрионы, включенные в настоящее исследование, соответствовали анеуплоидным и не были рекомендованы к переносу. После получения разрешения супружеской пары на использование эмбрионов в научных целях и подписания необходимых заявлений анеуплоидные эмбрионы в условиях эмбриологической лаборатории были разделены с помощью лазера и микроманипулятора на 3 части: ВКМ, образец трофэктодермы № 1, образец трофэктодермы № 2. Полученные клетки, соответствующие трем частям анализируемых анеуплоидных эмбрионов, согласно результатам ранее проведенной общей биопсии трофэктодермы, были отправлены на повторный анализ с помощью метода NGS. У 15 эмбрионов хромосомный набор в исходном образце клеток трофэктодермы совпадал с образцами клеток, полученными при разделении эмбриона на три части. Однако у двух эмбрионов были обнаружены дополнительные хромосомные нарушения в образце клеток из ВКМ и трофэктодермы № 1 и № 2, представленные на рисунках 1 и 2. У эмбриона № 1 при проведении NGS были обнаружены дополнительные хромосомные нарушения, не детектированные в общем образце клеток трофэктодермы (рис. 1). Клетки из ВКМ у эмбриона № 1 содержали делецию и дупликацию по одной из хромосом, а в образце трофэктодермы № 2 была обнаружена моносомия.
В образце клеток ВКМ, полученном у эмбриона № 2, были также обнаружены дополнительные хромосомные перестройки, не описанные в результатах NGS клеток общей трофэктодермы. По одной из хромосом была обнаружена дупликация, представленная на рисунке 2.
Полученные данные еще раз подтверждают, что биопсия части трофэктодермы может быть нерепрезентативной относительно всех клеток трофэктодермы и ВКМ. Таким образом, несмотря на то, что в настоящее время разработаны рекомендации по оптимизации выбора мозаичных эмбрионов для переноса в программах ВРТ, до сих пор остается ряд нерешенных вопросов. Один из них – адекватная и полная диагностика мозаицизма в эмбрионах. Ограничения в диагностике связаны с методами получения биологического материала для генетического анализа, который зачастую не позволяет достоверно оценить наличие мозаицизма у анализируемого эмбриона.
Обсуждение
Одна из основных причин неправильной интерпретации результатов ПГТ-А заключается в наличии хромосомного мозаицизма. Хромосомный мозаицизм может встречаться у эмбрионов во время преимплантационного периода, однако в течение первых трех дней культивирования частота появления таких ошибок наиболее высокая, и по мере дальнейшего развития эмбрион способен самостоятельно компенсировать данные нарушения [2].
Наличие мозаицизма в клетках эмбриона может быть обнаружено с помощью флуоресцентной гибридизации in situ, полимеразной цепной реакции, сравнительной геномной гибридизации с использованием микроматриц (а-CGH) и методом NGS [28]. Технология NGS является наиболее специфичной и чувствительной методикой в отношении диагностики мозаицизма в эмбрионе, так как частота выявления данных нарушений при проведении NGS наиболее высокая по сравнению с a-CGH и составляет 10 и 3% соответственно [29]. Учитывая, что в литературе описаны случаи рождения детей со сбалансированным кариотипом после переноса мозаичных эмбрионов в программе ВРТ, наличие менее 50% анеуплоидных клеток при биопсии трофэктодермы у эмбриона на ранних стадиях преимплантационного развития имеет благоприятный прогноз в отношении дальнейшего наступления беременности [1, 10]. Однако существуют обратные ситуации, когда при более детальном анализе в эмбрионе могут быть обнаружены дополнительные хромосомные нарушения, влияющие на потенциал имплантации и дальнейшего развития эмбриона. Для снижения риска ложноотрицательных результатов проведение ПГТ-А рекомендовано выполнять на 5-е сутки после оплодотворения, когда частота выявления мозаицизма минимальна вследствие естественной элиминации эмбрионов с хромосомными аберрациями. Несмотря на то что не разработана методика, позволяющая решить проблему мозаицизма, активно изучаются дополнительные, перспективные маркеры, позволяющие повысить точность диагностики хромосомных аномалий у эмбриона при помощи ПГТ-А. Согласно результатам исследований данные, полученные при кариотипировании образцов внутриполостной жидкости бластоцисты и клеток трофэктодермы, совпадают. Фракция внеклеточной ДНК, идентифицированной во внутриполостной жидкости бластоцисты, позволяет проводить тестирование моногенных мутаций и, возможно, позволит в будущем решить ряд вопросов диагностики хромосомного мозаицизма [30, 31]. В исследовании Palini et al. (2013) было продемонстрировано, что во внутриполостную жидкость бластоцисты внеклеточная ДНК секретируется из клеток, подвергающихся апоптозу. Тем не менее неизвестно, попадает ли во внутриполостную жидкость ДНК всех клеток (и с эуплоидным, и с анеуплоидным набором хромосом) и зависит ли секреция внеклеточной ДНК от локализации клеток (ВКМ или трофэктодерма) [32]. Таким образом, вопрос применения внутриполостной жидкости бластоцисты в качестве нового источника материала для анализа хромосомного статуса эмбриона остается перспективным, но требует дальнейших исследований.
В 2021 г. Shitara et al. опубликовали результаты исследования по изучению внеклеточной ДНК в культуральной среде в качестве биомаркера хромосомного набора эмбриона. В исследование были включены 20 криоконсервированных бластоцист, полученных от 12 супружеских пар. На 6-е сутки после оплодотворения была выполнена биопсия трофэктодермы эмбриона. У эмбрионов на 6-е сутки была собрана культуральная среда для анализа внеклеточной ДНК методом NGS. После биопсии эмбрионы культивировались до 10 суток с последующим проведением NGS на 5 образцах 8-дневных эмбрионов, 5 образцах 9-дневных эмбрионов и 10 образцах 10-дневных эмбрионов. В зависимости от результатов биопсии трофэктодермы, анализа внеклеточной ДНК и полногеномной амплификации эмбрионов, культивируемых более 6 суток, все образцы были разделены на эуплоидные (группа I), анеуплоидные (группа II) и мозаичные эмбрионы (группа III). Было обнаружено, что чувствительность диагностики анеуплоидии неинвазивным методом определения внеклеточной ДНК в культуральной среде эмбриона составляет 100%, специфичность – 87,5%, что превышало аналогичные показатели при тестировании трофэктодермы (чувствительность – 87,5%, специфичность – 77,8%) [33]. Таким образом, определение внеклеточной ДНК в культуральной среде для диагностики хромосомного статуса эмбриона является высокоточной, неинвазивной и многообещающей технологией, требующей дальнейшего изучения.
Учитывая, что ПГТ-А в настоящий момент широко применяется и является отработанным, автоматизируемым методом, сочетающим в себе все основные качества наиболее объективных способов диагностики, правильная интерпретация полученных данных крайне важна. Стоит подчеркнуть, что в программах ВРТ при переносе эуплоидной бластоцисты и наступлении развивающейся беременности рекомендовано обязательное проведение скрининга I триместра на сроке 11–13 недель гестации. Скрининг I триместра включает в себя измерение толщины воротникового пространства с помощью аппарата УЗИ и исследование биохимических маркеров крови (хорионического гонадтропина, РАРР-А) с последующим индивидуальным анализом риска рождения ребенка с хромосомными нарушениями [34]. Пациенткам с высоким риском анеуплоидии плода по данным скрининга I триместра рекомендованы консультация врача-генетика и проведение пренатальной диагностики, включающей биопсию ворсин хориона или амниоцентез в зависимости от срока гестации. Для исключения анеуплоидии плода супружеской паре может быть дополнительно предложено проведение неинвазивного пренатального скрининга.
Результаты данного исследования показали, что хромосомный набор клеток, полученных из разных структур эмбриона, может отличаться. Эмбрионы с хромосомным мозаицизмом, с одной стороны, способны приводить к рождению здоровых детей со сбалансированным кариотипом, с другой стороны, в зависимости от степени и типа мозаицизма могут стать причиной потери беременности или рождения детей с пороками развития, задержкой роста или умственной отсталостью [35].
Заключение
Таким образом, проведение ПГТ-А не всегда гарантирует перенос эуплоидной бластоцисты, даже несмотря на неоспоримые преимущества данного метода в профилактике хромосомной патологии. Полученные данные подтверждают, что биопсия части трофэктодермы может быть нерепрезентативной относительно всех клеток трофэктодермы и ВКМ.
В настоящий момент активно изучаются дополнительные маркеры и методы диагностики мозаичных эмбрионов; тем не менее, обязательное проведение пренатального скрининга I триместра у пациенток с беременностью, наступившей после переноса эуплоидного эмбриона по результатам ПГТ-А, позволяет не только получить информацию об аномальной беременности, но и подготовиться к своевременной хирургической коррекции выявленных пороков.



