Развитие современной медицины, в первую очередь хирургии и реаниматологии, сопровождается увеличением числа инвазивных манипуляций с использованием искусственных имплантов и медицинских устройств (девайсов) из полимерных синтетических материалов (различные катетеры, протезы). В связи с этим значительно возрос риск девайс-ассоциированных инфекций, имеющих госпитальную природу происхождения. Катетер-ассоциированные инфекции (КАИ) кровотока – это одно из наиболее частых осложнений катетеризации центральных вен у пациентов, длительно пребывающих в стационаре. КАИ сопровождаются бактериемией и диссеминацией возбудителя и всегда связаны с оказанием медицинской помощи, поэтому часто этиологическим агентом выступают госпитальные штаммы условно-патогенных микроорганизмов (УПМ) [1]. Смертность от КАИ достигает 12–25% по данным различных авторов [2].
Одними из основных возбудителей КАИ являются коагулазо-отрицательные стафилококки (30–50% случаев), и в частности, Staphylococcus epidermidis [3, 4].
Бактерии этого вида вызывают по меньшей мере 22% инфекций кровотока в отделениях интенсивной терапии [3].
Важной особенностью S. epidermidis является способность образовывать биопленку на различных поверхностях, в том числе на катетерах. Бактериальная биопленка представляет собой сложную систему, состоящую из собственно бактерий и связанного с ними внеклеточного матрикса. Бактерии в составе биопленки обладают повышенной толерантностью к эффекторам иммунной системы и антибактериальным препаратам, что ведет к существенному снижению эффективности терапии. Так, устойчивость к антибактериальным препаратам бактерий, сформировавших биопленку, может превышать устойчивость бактерий в планктонном состоянии в 100–1000 раз [5]. Последнее объясняется рядом факторов: наличием в составе биопленки персистирующих форм с сильно замедленным метаболизмом; фильтрующей способностью биополимерного матрикса, затрудняющего диффузию антибиотиков к клеткам. При этом образование биопленок в очагах инфицирования в организме человека приводит к хронизации процесса, снижая эффективность лечения [6].
В составе внеклеточного матрикса биопленок можно выделить: экзополисахариды, белки, а также внеклеточную ДНК [7]. Для биопленок, образованных бактериями вида S. epidermidis, основным компонентом является полисахарид-полимер β-1,6-N-ацетилглюкозоамина, получивший название полисахаридный межклеточный адгезин [8, 9]. Также показана роль в формировании биопленок белков семейства микробных поверхностных компонентов, распознающих адгезивные матричные молекулы (MSCRAMM – «microbial surface components recognizing adhesive matrix molecules») [10], и аутолизинов [8].
Проблема образования биопленок на поверхности катетеров особо актуальна в неонатологии при выхаживании новорожденных детей с низкой и очень низкой массой тела [11]. В связи с тем, что у новорожденных имеется физиологический иммунодефицит, а у недоношенных новорожденных – еще и патологическая незрелость всех органов, систем и рецепторного аппарата (Toll-like рецепторы), это создает предпосылки к тому, что УПМ с низким патогенным потенциалом, такие как S. epidermidis, колонизируя центральные венозные катетеры (ЦВК), вызывают тяжелые инфекции. По данным крупного многоцентрового исследования, проведенного M. Miragaia и соавт. в 2007 г., известно, что госпитальная популяция S. epidermidis представлена родственными штаммами, относящимися по данным MLST к одному клональному комплексу, родоначальником которого является ST2 [12]. Это дает повод сделать предположение, что представители данного клонального комплекса имеют эволюционное преимущество перед другими штаммами этого вида, позволяющее выжить и занять главенствующую позицию в госпитальной среде. Учитывая то, что коагулазо-отрицательные стафилококки, в отличие от S. aureus, имеют очень небольшой набор факторов патогенности [3], способность выживать в госпитальной среде может быть связана с хорошей способностью к адгезии на поверхностях медицинских девайсов, без которых в современном госпитале не обходится лечение ни одного пациента. В связи с этим целью данного исследования было изучение способности госпитальной популяции S. epidermidis формировать биопленки на внутренней поверхности ЦВК.
Материал и методы исследования
Коллекция из 150 образцов ЦВК собрана на базе ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России.
Сразу после извлечения катетера непосредственно возле кювеза в отделении реанимации и интенсивной терапии (ОРИТ) новорожденных Центра, его дистальный конец разделяли на два фрагмента с помощью ножниц с соблюдением правил асептики. Кусочки ЦВК помещали в пробирки с сахарным бульоном (HiMedia, Индия) и 10% формалином. Пробирку с сахарным бульоном инкубировали 24 часа при 37°С, пробирки с формалином отправляли на микроскопическое исследование, хранение осуществляли при температуре 6–8°С. В случае помутнения сахарного бульона проводили высев на чашки Петри с Колумбийским агаром (Oxoid, Великобритания) с добавлением 5% бараньей крови. Колонии, выросшие на агаре, были идентифицированы методом прямого масс-спектрометрического профилирования бактериального лизата [13]. Масс-спектры получали с использованием времяпролетного масс-спектрометра AutoflexIII (Bruker Daltonics, Германия), оснащенного азотным лазером 337 нм. Идентификация проводилась с использованием программного обеспечения MALDI Biotyper 3.0 (Bruker Daltonics, Германия).

С помощью сканирующей электронной микроскопии (СЭМ) была визуализирована поверхность катетеров: 1. контроль – интактный катетер 24G (Vygon GmbH&Co.KG, Германия); 2. катетер, извлеченный у новрожденного ребенка после 6 суток катетеризации, не колонизированный микроорганизмами по результатам микробиологического исследования; 3. катетер, колонизированный S. epidermidis и извлеченный у ребенка после катетеризациии в течение 4 суток.
Для выделенных изолятов S. epidermidis проведено MLST, детекция генов, отвечающих за образование биопленок, оценена их способность образовывать биопленки in vitro и in vivo.
Для выделения ДНК бактериальных культур использовали набор «ДНК-экспресс» (ТУ–9398-450-17253567-03) (ООО НПФ Литех, Россия), в соответствии с прилагаемыми инструкциями). Пробы ДНК хранились при –20°C.
Типирование изолятов S. epidermidis было выполнено методом мультилокусного секвенирования типирования по стандартной схеме (http://sepidermidis.mlst.net).
Детекцию генов icaABCD оперона, ответственного за синтез полисахаридного межклеточного адгезина, для представителей рода Staphylococcus проводили методом амплификации соответствующих генов посредством полимеразной цепной реакции в соответствии с тремя различными методиками [14–16].
Наличие генов, кодирующих белки семейства MSCRAMM (Ebp, SdrH), а также белки AtlE, Aap и Ebh, подтверждали методом амплификации с использованием праймеров, представленных в таблице. Подбор праймеров осуществлялся с помощью программного обеспечения Oligo 6.71 (Molecular Biology Insights, Inc., США).
Способность изолятов прикрепляться к пластику и образовывать биопленки оценивали с помощью окраски биопленки кристаллическим фиолетовым (in vitro) и посредством СЭМ (in vivo).
Окраску биопленок кристаллическим фиолетовым проводили следующим образом: изоляты выращивали в жидкой питательной среде (триптон-соевый бульон (Oxoid)) в течение суток при 37оС. Из суточных культур исследуемых штаммов посредством добавления триптон-соевого бульона готовили суспензии с оптической плотностью 0,5 МакФарланд. Аликвоты бактериальных суспензий (10 мкл) вносили в лунки 96-луночного планшета (Greiner bio one, Австрия), заполненные триптон-соевым бульоном (200 мкл), и инкубировали при 37°С в течение 24 ч. После этого культуральную жидкость осторожно удаляли, однократно промывали лунки раствором 0,9% хлорида натрия и вносили в каждую лунку по 400 мкл 0,1% спиртового раствора кристаллического фиолетового для окрашивания сформировавшихся биопленок. Окрашивание проводили при 37°С в течение 1 часа. Раствор кристаллического фиолетового удаляли, два раза промывали лунки дистиллированной водой и проводили экстракцию красителя из биопленки в 200 мкл 96% этанола в течение 1 часа при комнатной температуре. В качестве контроля использовали среду для культивирования. Оптическую плотность измеряли на микропланшетном фотометре Multiskan ascent 354 (Thermo Electron Corporation, США) при длине волны 570 нм. Измерения проводили в трех биологических повторах. Считали, что изолят образует биопленку, если оптическая плотность превышала значение 0,24 [17].
Для СЭМ образцы ЦВК извлекали из 10% раствора формалина и высушивали в течение 10 минут при комнатной температуре. Перед анализом на все образцы напыляли золото (толщина слоя – 5 нм) с использованием модуля для напыления SPI-MODULE Sputter Coater (SPI Supplies, США)). Анализировали внутреннюю и наружную поверхности катетеров с помощью двухлучевого ионно-электронного сканирующего микроскопа Quanta 200 3D (FEI Company, США) в условиях высокого вакуума при ускоряющем напряжении 7,5 кВ.
Результаты исследования и обсуждение
В ходе исследования была проанализирована коллекция 150 образцов ЦВК. Бактериологическими методами обнаружена колонизация УПМ 53 катетеров. Из них на 50 образцах была обнаружена бактериальная монокультура. Большинство изолятов были идентифицированы как коагулазо-отрицательные стафилококки (41/50, 82%), а именно S. epidermidis (34/50, 68%), что подтверждает данные эпидемиологических исследований, проводимых в других неонатальных ОРИТ [18]. Кроме коагулазо-отрицательных стафилококков, в коллекции присутствовали по одному изоляту следующих видов: Staphylococcus aureus, Acinetobacter pittii, Aerococcus viridans, Bacillus cereus, Enterobacter cloacae, Enterococcus faecalis, Streptococcus viridans, Pantoea agglomerans, Candida albicans. Помимо этого, выявлено три образца катетеров, для которых в результате анализа высевов были идентифицированы несколько видов микроорганизмов, а именно: катетер № 47 – Staphylococcus haemolyticus и S. epidermidis, № 113 – Staphylococcus haemolyticus и Streptococcus группы viridans, № 202 – S. epidermidis, Enterobacter cloacae и Pantoae agglomerans.

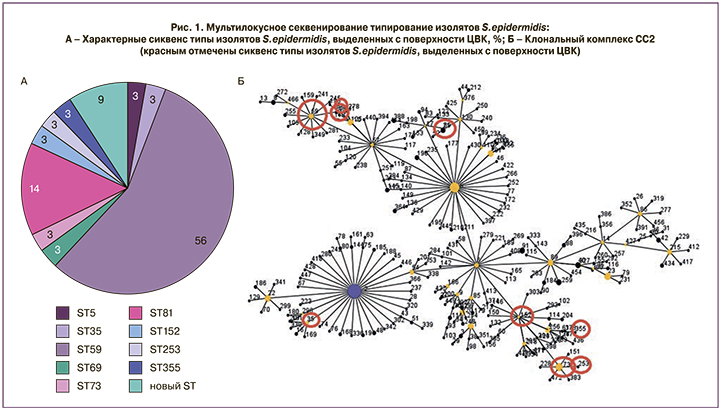
Для оценки разнообразия изолятов S. epidermidis, выделенных с поверхности ЦВК, методом мультилокусного секвенирования типирования были установлены их сиквенс-типы. Изоляты коллекции относились к 12 различным сиквенс-типам, причем преобладающим являлся ST59 (19 изолятов, 56%) (рис. 1А). Надо отметить, что 9 выявленных сиквенс-типов относились к клональному комплексу CC2, характерному для госпитальной популяции S. epidermidis (рис. 1Б) [12], что подтверждает госпитальную природу происхождения большинства собранных изолятов S. epidermidis (31/34, 91%). Кроме того, среди выявленных сиквенс-типов описано три новых со следующими аллельными профилями: 3-41-5-5-38-5-11; 1-1-1-2-2-1-11; 1-6-1-2-2-1-10. Данные сиквенс-типы, характеризующие 3 изолята S. epidermidis, не входят в клональный комплекс СС2.
Одной из наиболее важных особенностей механизмов патогенности коагулазо-отрицательных стафилококков, в том числе и S. epidermidis, является способность образовывать биопленки. Биопленка, сформированная бактериальными клетками, служит для них защитным барьером, предотвращая губительное воздействие антибактериальных препаратов и эффекторов иммунной системы организма-хозяина. Основная часть изолятов (28/50, 54%) обладала повышенной способностью к адгезии на пластике (OD>0.24), при этом не было выявлено корреляции между принадлежностью к определенному сиквенс-типу и выраженностью способности образовывать биопленки. Кроме изолятов S. epidermidis (n=23) повышенной адгезией обладали изоляты Enterococcus faecalis (n=1), Acinetobacter pittii (n=1), S. haemolyticus (n=1), S. warneri (n=1) и Candida albicans (n=1). Нужно отметить, что 2 изолята S. epidermidis, относящиеся к новым сиквенс-типам (1-1-1-2-2-1-11; 1-6-1-2-2-1-10), также обладали повышенной способностью к адгезии на пластике.
Для подтверждения образования биопленок на поверхности ЦВК были получены данные СЭМ образцов ЦВК in vivo. В качестве контрольных образцов использовали интактный катетер (рис. 2А, Б, В, Г) и катетер, стоявший у новорожденного ребенка (длительность катетеризации 6 суток) и не показавший роста микроорганизмов по результатам анализа посевов (рисунок 2Д, Е, Ж, З). Так, по данным СЭМ, наружная и внутренняя поверхность интактного катетера обладали схожей структурой. Непосредственно в материале катетера наблюдали включения округлой формы (100 нм – 5 мкм) (рис. 2А, Б, В, Г). На наружной поверхности катетера, при посевах с которого микроорганизмов выявлено не было, визуализировали выраженное количество вещества средней электронной плотности (рис. 2Д, Ж), а также некоторое количество эритроцитов (рис. 2Ж). В свою очередь, внутренняя поверхность в меньшей степени была покрыта веществом средней электронной плотности, чем наружная (рис. 2Е, З). Исходя из литературных данных, вещество средней электронной плотности представляет собой белки человека – компоненты экстрацеллюлярного матрикса, такие как коллаген, эластин, фибронектин и др. Биопленки, образованной бактериями, на катетере не обнаружено, так же, как и отдельных бактериальных клеток.

Биопленка, сформированная S. epidermidis, представлена на рис. 3. Длительность катетеризации составила 4 суток. На наружной поверхности катетера визуализировали крошковидный материал, бактерии и некоторое количество гомогенного вещества (рис. 3А, В, Д). На внутренней поверхности был обнаружен участок со сгустком, представляющий собой биопленку и состоящий из нитей фибрина, форменных элементов крови и бактерий (рис. 3Б, Г, Е). Надо отметить, что с данного катетера был выделен изолят SE210, характеризующийся ST59 и повышенной адгезией к пластику.
Из многочисленных литературных данных известно, что основным компонентом биопленки, сформированной клетками S. Epidermidis, является полисахарид – полимер β-1,6-N-ацетилглюкозоамина, получивший название полисахаридный межклеточный адгезин (PIA) [8, 9]. Детекцию генов, ответственных за синтез PIA, проводили с помощью реакции амплификации с тремя различными вариантами праймеров [14–16]. Наличие генов icaA, icaB, icaC, icaD подтверждено для 5 изолятов S. epidermidis и 2 изолятов S. aureus. Результаты, полученные при использовании разных систем праймеров, полностью согласуются. Так гены icaABCD оперона были найдены у изолятов S. epidermidis, характеризующихся сиквенс-типами ST73, ST69, ST59, ST35, а также новым сиквенс-типом 1-6-1-2-2-1-10. При этом для изолята SE210, полученного с катетера, для которого визуализирована биопленка с помощью СЭМ, не было выявлено генов icaABCD оперона. Это может быть связано со способностью штаммов S. epidermidis образовывать так называемые ica-независимые биопленки [19]. Кроме полисахаридной составляющей в состав биопленки входят различные белки [8]. В ходе работы у изолятов S. epidermidis, выделенных с поверхности катетеров, определяли наличие генов стафилококкового аутолизина – AtlE, белка, ассоциированного с аккумуляцией (Accumulation-associated protein) – Aap, белка, связывающего внеклеточный матрикс (Extracellular matrix-binding protein) – Ebh, а также белков семейства MSCRAMM – Ebp и SdrH. Гены белков AtlE и Aap были обнаружены у всех изолятов S. epidermidis (34 изолятов, 100%). Ген ebh был детектирован у 21 изолята S. epidermidis (21/34, 62%), из них повышенной адгезией характеризовались 15. Что касается генов белков семейства MSCRAMM, то ген эластин-связывающего белка Ebp обнаружен только у 7 изолятов с повышенной адгезией (7/34, 20%); ген фибриноген-связывающего белка SdrH – у 29 (29/34, 85%), в том числе и у всех изолятов, характеризующихся повышенной адгезией.
Заключение
Таким образом, большинство ЦВК, полученных после катетеризации новорожденных детей, были колонизированы S. epidermidis. Основной пул эпидермальных стафилококков, выделенных с поверхности катетеров, относился к сиквенс-типам, входящим в клональный комплекс СС2, что подтверждает госпитальное происхождение этих изолятов. На основании результатов окраски кристаллическим-фиолетовым бактериальных клеток, прикрепившихся к пластику, была выявлена группа изолятов, обладающих повышенной способностью к адгезии на пластике. Корреляции между повышенной способностью к адгезии бактериальных клеток на пластике и определенным сиквенс-типом выявлено не было. Оценить различия в способности образовывать биопленки изолятов госпитального происхождения, принадлежащих к CC2, и изолятов, относящихся к не госпитальной популяции, не удалось из-за малой выборки. Таким образом, остается невыясненной причина, по которой CC2 получил эволюционное преимущество в госпитальной среде. Способность образовывать биопленки непосредственно на ЦВК была подтверждена in vivo методом СЭМ. У большинства изолятов не были детектированы гены icaABCD оперона, ответственного за синтез полисахарида PIA, при этом для адгезивных изолятов показано наличие генов белков, участвующих в образовании биопленки. Таким образом, данные изоляты образовывали биопленку на поверхности катетеров по ica-независимому механизму, что противоречит теории ведущей роли icaABCD оперона как основного фактора патогенности, связанного с биопленкообразованием. По данным СЭМ на поверхности ЦВК, извлеченных после катетеризации, присутствует значительное количество вещества средней электронной плотности, вероятно, представляющего собой белки клеток человека. Возможно, для образования биопленок на поверхности ЦВК при таком количестве внеклеточного матрикса, представленного белками человека, бактериальным клеткам нет необходимости синтезировать полисахарид PIA, а достаточно собственных белков-адгезинов (белков семейства MSCRAMM) для прикрепления к поверхности катетера и дальнейшего образования биопленки.
Авторы выражают благодарность Н.В. Шевлягиной за проведение сканирующей электронной микроскопии.



