Наружный генитальный эндометриоз (НГЭ) поражает до 30% женщин репродуктивного возраста с бесплодием и характеризуется эстроген-зависимостью, тазовой болью, персистентной активностью и некоторыми идентичными опухолевому процессу фундаментальными проявлениями [1–3]. Среди них — повышенная пролиферативная активность клеток эпителия и цитогенной стромы и так называемое «метастазирование», т.е. распространение пролифератов, или гетеротопий, эндометриоподобной ткани за пределы полости матки, что свидетельствует о нарушениях клеточной адгезии и межклеточных контактов.
Межклеточные и клеточно-матриксные взаимодействия в большинстве тканей обеспечиваются с помощью определенного спектра биологически активных соединений, среди которых видные роли играют крупные белково-углеводные молекулы – протеогликаны [4, 5]. Один из протеогликанов — трансмембранный гепарансульфат синдекан-1 (SDC1, более известный как CD138) локализуется на плазматических клетках, наличие которых в эндометрии в пролиферативную фазу цикла признано самым надежным маркером хронического эндометрита [6].
Биологическая роль SDC1 состоит, прежде всего, в связывании его внеклеточными углеводными цепями некоторых факторов роста, в частности, фактора роста эндотелия сосудов (VEGF) [7]. В различных клетках, экспонирующих SDC1, отщепление его углеводных цепей потенцирует каскад молекулярных сигналов, что приводит к усилению ангиогенеза и изменениям свойств микроокружения, характерных для поддержки активного роста опухолей и метастазирования [8, 9]. Функцию отщепления углеводных цепей от гепарансульфатов выполняет гепараназа (HPSE) — единственная у млекопитающих эндогликозидаза, экспрессия которой значительно повышена в опухолях с агрессивным течением и в тканях с активной пролиферацией [5]. Нами продемонстрирована высокая экспрессия HPSE в очагах аденомиоза у пациенток с множественной миомой тела матки с объемом более 12 недель беременности, сопровождаемая отрицательной зависимостью с экспрессией суммарных гепарансульфатов [10].
Несмотря на исследование эндометриоза при помощи полногеномных методов, надежные биомаркеры для неинвазивной диагностики эндометриоза отсутствуют [11–13]. В последние годы усилия исследователей по всему миру направлены на изучение генной экспрессии в эутопическом эндометрии, и различия могут быть использованы в качестве биомаркеров для малоинвазивной диагностики НГЭ. Опубликован ряд отечественных исследований, посвященных анализу профилей генной экспрессии в эутопическом эндометрии [14, 15]. По-прежнему «золотым стандартом» диагностики являются лапароскопия с биопсией и гистологическое подтверждение патологического процесса [16]. В концепциях патоморфогенеза эндометриоза яичников отмечена роль воспаления [13].
Цель исследования – изучить экспрессию синдекана-1 и гепараназы в выстилке эндометриом яичников у женщин репродуктивного возраста в пролиферативную фазу цикла с оценкой степени выраженности воспалительной инфильтрации и корреляции с болевым синдромом.
Материал и методы исследования
Проведено клинико-морфологическое исследование 20 пациенток в возрасте 27,7±4,3 года с эндометриоидными кистами яичников III-й стадии (по критериям Л.В. Адамян и соавт. [17]), прооперированных в период с 2014 по 2016 г. в гинекологическом отделении ГБУЗ НСО «Государственная Новосибирская Областная Клиническая больница», являющемся клинической базой кафедры акушерства и гинекологии НГМУ. Оперативное лечение проведено в объеме вылущивания эндометриом – у 19 пациенток и резекции яичников в 1 случае; всем женщинам выполнены иссечение очагов эндометриоза в малом тазу и разъединение спаек.
Критерии включения в исследование: плановое оперативное лечение в пролиферативную фазу менструального цикла, репродуктивный возраст до 35 лет, уровень фолликулостимулирующего гормона (ФСГ) менее 15 мМЕ/мл, уровень антимюллерова гормона (АМГ) не менее 2 нг/мл, гистологически верифицированный эндометриоз яичников и информированное согласие пациентки. Критерии исключения: беременность, прием гормональных препаратов минимум за 3 месяца до операции, онкологические заболевания, иммунодефицитные состояния, декомпенсированная экстрагенитальная патология.

Образцы резецированных эндометриом фиксировали в забуференном формалине и заливали в гистомикс; парафиновые срезы окрашивали гематоксилином и эозином. Экспрессию SDC1 и HPSE исследовали с помощью двухшагового иммуногистохимического (ИГХ) метода, в качестве первичных антител использовали моноклональные антитела к SDC1 («Dako», готовые к использованию) и к HPSE («Abnova») в разведении 1:200; продукты реакции визуализировали диаминобензидином (DAB), ядра клеток докрашивали гематоксилином Майера. Для негативного контроля вместо первичных антител использовали 5% бычью сыворотку. Площадь интра — и экстрацеллюлярных продуктов ИГХ реакции оценивали полуколичественно (1–3 баллов) с помощью микроскопа Axio Scope.A1 с фотокамерой AxioCam MRc5 (С.Zeiss), для каждого параметра оценивали по 20–25 изображений с увеличением 63х12.
Статистическую обработку результатов осуществляли с помощью пакета прикладных программ STATISTICA v.6.0. Коэффициент корреляции Спирмена использовали для оценки зависимости экспрессии SDC1 и HPSE по DAB-позитивным продуктам ИГХ реакции и выраженности боли по визуальной аналоговой шкале (ВАШ). В зависимости от наличия или отсутствия субэпителиальной воспалительной инфильтрации 18 пациенток из включенных в исследование были разделены на две равные подгруппы для изучения различий в экспрессии SDC1 и HPSE. Далее 18 пациенток из включенных в исследование были разделены на две подгруппы в зависимости от наличия или отсутствия фиброза цитогенной стромы (по 9 в каждой подгруппе) для изучения различий в экспрессии HPSE и SDC1. При сравнении пар подгрупп, выделенных по наличию субэпителиальной воспалительной инфильтрации или по фиброзу цитогенной стромы, применяли критерий Манна-Уитни. Различия считали статистически значимыми при уровне р<0,05.
Результаты и их обсуждение
В структуре жалоб всех 20 пациенток преобладали болевой синдром (3–5 баллов по ВАШ – у 13 (65%) и бесплодие – у 13 (65%) женщин. При этом у 5 пациенток течение заболевания было почти бессимптомным (с оценкой боли в 1–2 балла по ВАШ), несмотря на верифицированную III стадию эндометриоидных кист яичников [17]. Не реализовали свою репродуктивную функцию 15 пациенток (75%), из них у 2-х в анамнезе были ранние репродуктивные потери, остальные беременностей не имели.
Из сопутствующих гинекологических заболеваний преобладали: патология шейки матки (12 случаев, 60%), миома тела матки (7 женщин, 35%) и воспалительные заболевания органов малого таза (6 наблюдений, 30%) с непроходимостью маточных труб, установленной с помощью хромосальпингоскопии. Диагностическая гистероскопия до операции выполнена в 4-х случаях, из них у 2-х пациенток выявлен полип эндометрия и еще у 2-х — аденомиоз. Хронический эндометрит по данным гистологического изучения пайпель-биоптатов эуэндометрия верифицирован перед операцией лишь в 1-м клиническом наблюдении.
Содержание маркера СА125 в образцах крови колебалось от 23 до 69 Ед/мл и в среднем немного превышало нормативные значения, составив 40,33±16,9 Ед/мл. Основные показатели овариального резерва — ФСГ и АМГ — находились в пределах референсных значений — 7,33±1,2 мМЕ/мл и 3,79±1,61 нг/мл, соответственно.
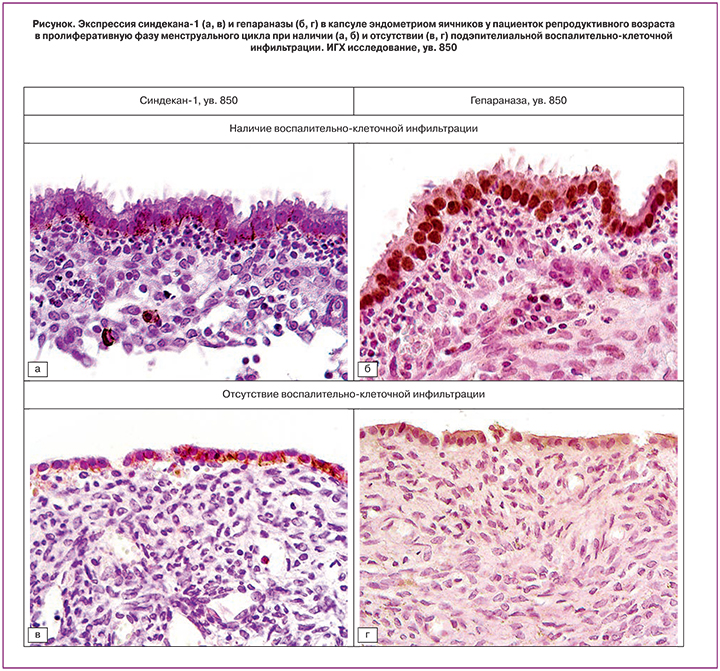
По данным ИГХ исследования выстилки эндометриом яичников, SDC1 локализовался преимущественно на базальных и, в меньшей степени, на базолатеральных плазмолеммах эпителиоцитов и слабо экспрессировался в ядрах эпителиальных клеток (рисунок, А). Однако повышение СА125 коррелировало даже с минимальной экспрессией SDC1 в эпителии (r=0,646; p=0,0037). В цитогенной строме экспрессия SDC1 приурочена к межклеточному матриксу, обратно коррелируя с экспрессией в цитоплазме эпителиоцитов (r=-0,671; p=0,0023), а также выявлена в цитолемме одиночных плазматических клеток.
Экспрессия HPSE в тех же образцах отличалась от экспрессии SDC1. Во всех случаях большинство или все ядра эпителиоцитов были высоко или умеренно DAB-позитивны (рисунок, Б), однако реакция цитоплазмы клеток характеризовалась значительными колебаниями – от отсутствия реакции до весьма выраженной. Интенсивность экспрессии SDC1 в ядре и цитоплазме эпителиальных клеток эндометриом в целом слабая, но с более высоким коэффициентом корреляции (r=0,707; p=0,001), по сравнению с экспрессией HPSE, выраженность которой в ядрах и в цитоплазме клеток эпителия характеризовалась умеренной положительной зависимостью (r=0,527; р=0,0246). По сравнению с наблюдениями с выраженной субэпителиальной клеточной инфильтрацией, при слабо выраженной инфильтрации и отсутствии нейтрофилов, экспрессия SDC1 в эпителии эндометриом была аналогичной (рисунок, В), однако экспрессия HPSE была явно снижена (рисунок, Г).
Высокая экспрессия HPSE в ядрах клеток эпителия эндометриом прямо коррелировала с наличием субэпителиальной воспалительной инфильтрации (r=0,949; р<0,0001) и с более интенсивной болью по ВАШ (r=0,902; р<0,0001), однако отрицательно коррелировала с экспрессией HPSE в цитогенной строме (r = -0,949; р<0,0001) и с ее фиброзом (r=-1,0; р<0,0001). Наличие субэпителиальной воспалительной инфильтрации положительно коррелировало с болевым синдромом в 3–5 баллов по ВАШ (r = 0,887; р<0,0001) и отрицательно коррелировало с фиброзом (r = -0,949; р<0,0001), а также с экспрессией HPSE в цитогенной строме (r = -1,0; р<0,0001).
В целом, тазовая боль в 3–5 баллов по ВАШ при эндометриомах яичников III-й стадии статистически значимо (р<0,0001) положительно коррелировала с экспрессией HPSE в ядрах эпителия (r=0,902) и воспалительной инфильтрацией (r=0,887) и отрицательно коррелировала с проявлениями фиброза цитогенной стромы (r=-0,902).
Далее с помощью теста Манна-Уитни сравнили показатели экспрессии гепарансульфата SDC1 и фермента его биодеградации HPSE в образцах эндометриом в зависимости от наличия/отсутствия субэпителиальной воспалительной инфильтрации (по 9 клинических наблюдений). Для SDC1 достоверные различия между группами не выявлены (Таблица 1). При этом выявлены достоверные различия между группами, связанные с экспрессией HPSE в ядрах (р=0,0001) и цитоплазме (р=0,0354) эпителия и цитогенной строме (р=0,0002) эндометриом яичников, а также с болевым синдромом интенсивностью 3 – 5 баллов по ВАШ (р=0,0003) и отсутствием фиброза цитогенной стромы (p=0,0001).
Также проанализированы различия при сравнении подгрупп, выделенных по наличию/отсутствию фиброза цитогенной стромы (см. табл. 2). Выявлены достоверные различия по наличию воспалительной инфильтрации (р=0,0002), болевому синдрому (р=0,0003) и более высокой экспрессии HPSE в ядрах (р=0,0001) и цитоплазме (р=0,0354) эпителия эндометриом. При этом наличие фиброза сопровождалось более высокой экспрессией HPSE стромальными подэпителиальными клетками кист (р=0,0002), что свидетельствует о высокой вероятности нарушения межклеточных контактов, высвобождения факторов роста и активации миграции клеток соединительной ткани, т.е. о сохранении потенциала роста.
Как правило, в опухолях содержание гепарансульфат протеогликана SDC1 и фермента его метаболизма HPSE обратно пропорционально, однако существует синхронная функциональная активность двух молекул в клетках – т.н. ось «синдекан-гепараназа» [9]. HPSE является драйвером опухолевой прогрессии, обеспечивая повышение экспрессии и биоактивности нескольких ключевых факторов роста, в т.ч. фактора роста эндотелия сосудов (VEGF), которыми изобилует опухолевое микроокружение [18]. При этом активируется сигнальный путь ERK (Extracellular signal-Regulated Kinase), способствующий выживанию, пролиферации и увеличению подвижности клеток, а также повышению экспрессии в клетках факторов роста и матриксной металлопротеиназы-9 (MMP-9) [19].
Кроме того, благодаря активности HPSE на клеточной поверхности от SDC1 отщепляются углеводные цепи, что способствует усилению ферментной деградации core-белка молекулы гепарансульфата с участием MMP-9. Отщепленный SDC1 присоединяется к секретируемым опухолью VEGF и другим факторам роста, концентрируя их в опухолевом микроокружении и потенцируя их сигнальные свойства. В целом, синхронная активность HPSE и SDC1, а также воспаление, представляют собой мощный механизм прогрессирования роста опухоли, ангиогенеза, инвазии и метастазирования [9, 20].
Таким образом, важно отметить, что отсутствие достоверной отрицательной корреляции между экспрессией SDC1 и HPSE в эпителии эндометриом яичников III-й стадии может являться дополнительным свидетельством в пользу принципиального отличия эндометриоидных гетеротопий от опухолевых пролифератов.
Заключение
По данным ИГХ исследования выстилки овариальных эндометриом у пациенток раннего репродуктивного возраста с эндометриоидными кистами III-й стадии, выраженная экспрессия HPSE в эпителии ассоциирована с субэпителиальной воспалительно-клеточной инфильтрацией и наличием болевого синдрома в 3–5 баллов по ВАШ. Экспрессия гепарансульфат протеогликана SDC1 в эпителии эндометриом снижена и не имеет корреляции с высокой экспрессией HPSE.



