По данным статистических исследований, приблизительно 15% супружеских пар страдают бесплодием. Бесплодие обычно определяется как отсутствие зачатия после одного года регулярной половой жизни. На долю женского бесплодия приходится 20–35%. Одной из самых распространенных причин женского бесплодия является нарушение овуляции [1–3].
Одним из методов лечения бесплодных пар является экстракорпоральное оплодотворение (ЭКО) [1–3]. ЭКО предполагает использование гормонов для стимуляции функции яичников с целью увеличения роста фолликулов и, таким образом, развития более одного ооцита. Однако в клинической практике часто регистрируют отсутствие результата при проведении ЭКО у больных с бедным ответом яичников. Основная часть больных, демонстрирующих бедный ответ на овариальную стимуляцию в циклах ЭКО, – это женщины со сниженным овариальным резервом. В литературных источниках имеются данные о том, что при бедном ответе яичников на овариальную стимуляцию использование гормона роста (соматотропного гормона (СТГ), соматотропина) способно увеличить успех программы ЭКО [4].
Согласно литературным данным, применение СТГ улучшает качество ооцитов и, следовательно, эмбрионов [5]. Также было показано, что введение гормона роста стимулирует рост и развитие фолликулов [6–9], а также повышает ответ яичников на овариальную стимуляцию гонадотропинами [8, 9]. Таким образом, использование соматотропина может значительно улучшить результаты ЭКО, особенно у женщин со слабым ответом на общепринятую гормональную терапию.
Немаловажную роль в процессе фолликулогенеза играет простагландин Е2 (PGE2). PGE2 является одним из медиаторов, способствующих росту и созреванию фолликулярного эпителия, питающего ооцит. Согласно литературным данным, ингибирование продукции PGE2 в фолликулах или генетический нокаут продукции PGE2 и его рецепторов может препятствовать овуляции. Было показано, что увеличение уровня лютеинизирующего гормона увеличивает уровень PGE2 в доминантном фолликуле, что приводит к росту клеток фолликулярного эпителия и экспрессии протеаз, связанных с разрывом фолликула. В эксперименте на мышах с дефицитом рецептора PGE2 наблюдались аномальное деление клеток фолликулярного эпителия и отсутствие овуляции, что приводило к бесплодию [10].
Механизмом действия нового разрабатываемого лекарственного средства являются индукция синтеза специфических аутоантител к соматостатину (анти-СОМ-IgG), снижение его концентрации и, как следствие, увеличение содержания в организме эндогенного соматотропина [11].
Целью данной работы являлась оценка фармакологической активности препарата на основе соматостатинсодержащего белка на модели циклофосфамид-индуцированной недостаточности яичников у самок мышей.
Материалы и методы
Тестируемый объект – новое лекарственное средство на основе соматостатинсодержащего белка (ООО «Юрсфарм», Россия). Действующим веществом является рекомбинантный белок, содержащий соматостатин (СОМ), состоящий из белка-носителя – глюкансвязывающего домена (ГСД), спейсерной последовательности (-) и двух копий антигенной детерминанты соматостатина (ГСД-СОМ-СОМ) с молекулярной массой 39 кДа [11].
В эксперименте использовали аутбредных самок мышей ICR (CD-1) в возрасте 8–10 недель, массой 17–24 г, полученных из питомника АО «НПО «ДОМ ФАРМАЦИИ» (Ленинградская обл., Россия). Животных содержали в стандартных условиях в соответствии с Директивой 2010/63/EU от 22 сентября 2010 г. по охране животных, используемых в научных целях. В качестве корма использовали «Корм для содержания лабораторных животных» ПК-120-1, приготовленный по ГОСТ 34566-2019. Исследование было одобрено на заседании биоэтической комиссии АО «НПО «ДОМ ФАРМАЦИИ» (№БЭК 2.29/19 от 15 мая 2019 г.). Исследование соответствовало принципам «трех R» (Reduction, Refinement, Replacement) [12].
В качестве индуктора патологии использовали препарат «Эндоксан» (МНН: циклофосфамид, производство «Бакстер Онкология ГмбХ», Германия, серия 8l264D) однократно внутрибрюшинно в дозе 70 мг/кг [13]. По литературным данным, на этой модельной патологии наблюдают снижение массы яичников, значительное снижение количества нормальных фолликулов и увеличение количества атретических фолликулов, снижение уровня PGE2, увеличение уровня фолликулостимулирующего гормона (ФСГ) [13].
Для проведения исследования были сформированы 6 групп: 1-я – интактная (n=15); 2-я – негативный контроль (патология + раствор натрия хлорида 0,9% (производство ООО «Гротэкс», Россия, серия 320319), n=10); 3-я – позитивный контроль (патология + рекомбинантный мышиный соматотропный гормон (rmGH) в дозе 800 мкг/кг, n=10); 4-я – патология + тестируемый объект в дозе 10 мкг/кг (n=15); 5-я – патология + тестируемый объект в дозе 50 мкг/кг (n=15), 6-я – патология + тестируемый объект в дозе 250 мкг/кг (n=15). Тестируемый объект и физиологический раствор вводили животным подкожно двукратно с интервалом 14 дней (в 1-й и 14-й дни эксперимента). Вещество позитивного контроля вводили однократно внутрибрюшинно на 28-й день эксперимента. Индуктор патологии вводили однократно на 21-й день эксперимента. Общая продолжительность эксперимента составила 43 дня (рис. 1). Эвтаназию проводили с помощью диоксида углерода (CO2) с последующим обескровливанием из полостей сердца.
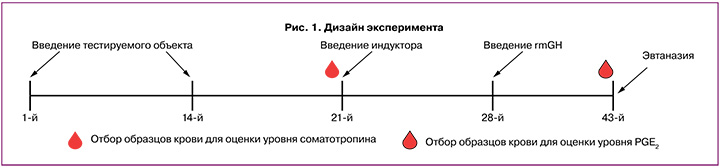
Наблюдение за животными проводили ежедневно. Массу тела животных измеряли до введения исследуемых объектов и далее еженедельно. Для определения уровня соматотропина у 5 животных интактной группы и 5 животных из групп, получавших тестируемый объект в исследуемых дозах, на 21-й день эксперимента во время проведения плановой эвтаназии отбирали образцы крови из полостей сердца. Для определения уровня PGE2 образцы крови отбирали у оставшихся животных всех экспериментальных групп на 43-й день эксперимента по аналогичной схеме. Кровь отбирали в пробирки с гепарином натрия. На 43-й день эксперимента во время плановой эвтаназии у 10 животных из каждой группы проводили измерение массы яичников, а также отбор эндометрия и яичников для дальнейшего гистологического анализа. Дизайн эксперимента представлен на рисунке 1.
Для определения концентрации соматотропина и PGE2 использовали коммерчески доступные наборы: Elisa kit for Growth Hormone (GH), № SEA044Mu, lot L190619110, (Cloud-Clone Corp., США) и Elisa kit for Prostaglandin (PGE2), № CEA538Ge, lot L190619122, (Cloud-Clone Corp., США). Измерения выполняли на многофункциональном микропланшетном анализаторе CLARIOstar (BMG Labtech, Германия) при двух длинах волн – 450 нм и 650 нм в соответствии с инструкцией производителя.
В процессе эвтаназии у животных извлекали матку с яичниками. Яичники, извлеченные при некропсии, были взвешены парно с предварительной фиксацией в 10% растворе нейтрального формалина для дальнейшего расчета массовых коэффициентов. Матку и яичники для дальнейшего гистологического анализа фиксировали в 10% растворе нейтрального формалина в течение 24 ч, после чего заливали в парафин [14]. Затем изготавливали срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином. Анализ гистологических объектов проводили при помощи светооптического микроскопа Accu-Scope 3000 SERIES (Accu Scope Inc., США) при увеличении 40, 100 и 400. Для оценки функции яичников производили подсчет первичных, вторичных, ранних антральных, антральных фолликулов, желтых тел, а также патологических фолликулов в стадии атрезии в одном яичнике. Далее от общей суммы подсчитанных фолликулов вычисляли долю (%) содержания определенного типа фолликулов в яичнике.
Статистический анализ
Анализ данных и построение графиков выполняли с помощью программного обеспечения Statistica 10.0 (StatSoft, США) и Prism 9.0 (GraphPad Software, США). Данные были проверены на соответствие закону нормального распределения с помощью критерия Шапиро–Уилка и представлены в виде среднего значения (M) и стандартного отклонения (SD) (критерий Шапира–Уилка, р>0,05). Различия были определены при 0,05 уровне значимости.
Для несвязанных данных был использован однофакторный дисперсионный анализ (ANOVA). Последующее межгрупповое сравнение (post hoc) проводили с помощью теста Тьюки (post hoc Tukey's).
Результаты и обсуждение
На протяжении всего эксперимента животные были в удовлетворительном состоянии, наблюдался равномерный прирост массы тела экспериментальных животных во всех группах.
Уровень PGE2 на 43-й день эксперимента у животных интактной группы составлял 2,33 (1,81) пг/мл. В группе негативного контроля у животных с циклофосфамид-индуцированной патологией яичников уровень PGE2 был существенно ниже и составлял 1,21 (0,87) пг/мл, что в среднем было ниже на 48% в сравнении с показателями интактной группы.
В группе животных, получивших после моделирования патологии лечение rmGH, уровень PGE2 составил 2,56 (2,57) пг/мл. В среднем уровень PGE2 в данной группе был выше на 112% в сравнении с уровнем PGE2 в контрольной группе животных, не получавших терапии. У самки №3.8 уровень PGE2 составил 8,30 пг/мл, что значительно превышало среднее содержание PGE2 по группе.
У животных, получавших изучаемый препарат в дозах 10–250 мкг/кг, отмечали дозозависимое повышение уровней PGE2. В среднем уровень PGE2 был выше на 55% (10 мкг/кг), 124% (50 мкг/кг) и 181% (250 мкг/кг) в сравнении с аналогичными показателями в группе негативного контроля (рис. 2).
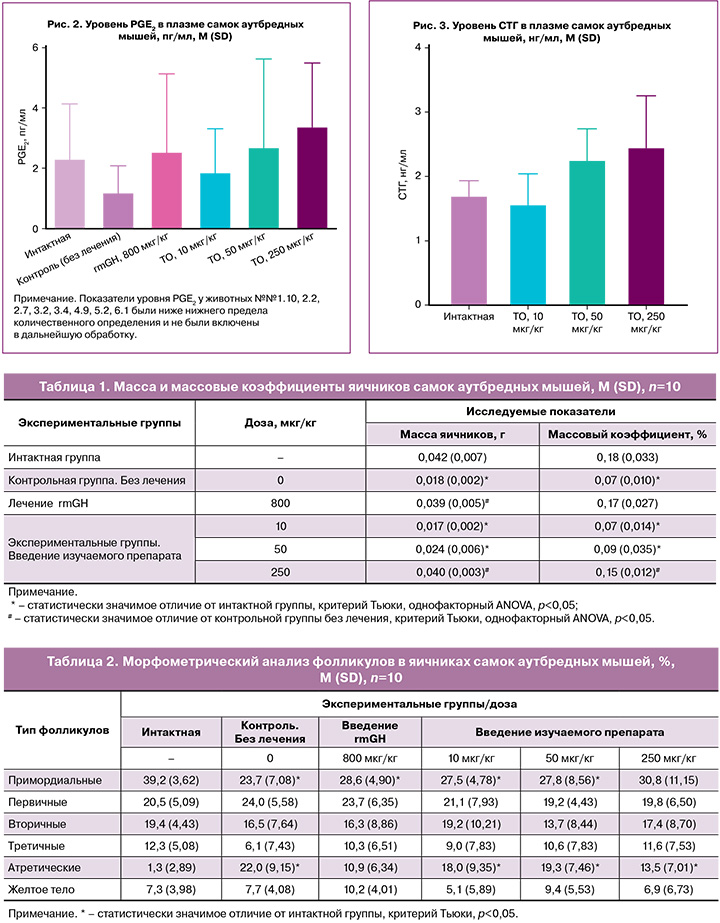
Диапазон уровней соматотропина в плазме крови животных интактной группы на 21-й день эксперимента составлял 1,72 (0,22) нг/мл. Статистически значимого влияния изучаемого препарата в исследуемых дозах на уровень соматотропина не установлено. Уровень СТГ у животных, получивших изучаемый препарат в дозе 10 мкг/кг, находился в пределах значений СТГ у животных интактной группы и составлял 1,58 (0,46) нг/мл (рис. 3). При этом наблюдали увеличение уровня СТГ в группах, получавших изучаемый препарат в дозах 50 мкг/кг (2,27 (0,47) нг/мл) и 250 мкг/кг (2,47 (0,79) нг/мл) (рис. 3). В среднем значения СТГ у животных данных групп превышали уровень СТГ у животных интактной группы на 32 и 44% соответственно. Несмотря на отсутствие статистической значимости, полученные данные позволяют говорить о наличии фармакологической активности препарата в дозах 50 и 250 мкг/кг, проявляющейся в увеличении уровня СТГ.
Однократное введение циклофосфамида оказало выраженное влияние на органы репродуктивной системы мышей. У животных группы негативного контроля наблюдали значимое уменьшение массы (в 2,3 раза) и массовых коэффициентов яичников в сравнении с аналогичными показателями у животных интактной группы (p<0,05, табл. 1). У животных группы позитивного контроля наблюдали статистически значимое увеличение массы яичников в сравнении с аналогичными показателями у животных группы без лечения. Статистически значимое увеличение массы яичников, в сравнении с группой негативного контроля без лечения, наблюдали только в группе животных, получавших изучаемый препарат в дозе 250 мкг/кг. При этом масса яичников у животных, получавших изучаемый препарат в дозе 250 мкг/кг и rmGH в дозе 800 мкг/кг, была сходна со значениями массы яичников у животных интактной группы.
У животных всех экспериментальных групп патологических изменений тканей матки и яичников не наблюдали. В таблице 2 представлены данные морфометрического анализа фолликулов в яичниках самок мышей. У животных интактной группы наблюдали многочисленные фолликулы на разной стадии зрелости, а также отдельные желтые тела, что соответствует физиологической норме. Основную долю от общего числа подсчитанных фолликулов в яичнике составляли примордиальные фолликулы (39,2%). Первичные фолликулы составляли 20,5%, третичные – 12,3%, атретические – 1,3%. В контрольной группе у животных с модельной патологией присутствовали фолликулы с признаками атрофии и апоптоза клеток. На фоне патологии наблюдали снижение доли примордиальных (23,7%) и третичных (6,1%) фолликулов и увеличение доли первичных (24%) и атретических (22%) фолликулов. В группе животных, получавших rmGH в дозе 800 мкг/кг, отмечали значимое увеличение доли примордиальных и третичных фолликулов, а также снижение доли атретических фолликулов в сравнении с контрольной группой. У животных, получавших изучаемый препарат в дозах 10–250 мкг/кг, наблюдали дозозависимую тенденцию к увеличению доли примордиальных и третичных фолликулов с параллельным снижением доли атретических фолликулов, что согласуется с литературными данными [15].
Заключение
У животных была успешно сформирована патология, вызванная введением циклофосфамида. Патологическая картина выражалась в увеличении количества фолликулов с признаками атрофии и апоптоза клеток. Наблюдалось увеличение количества атретических фолликулов наряду со снижением количества примордиальных фолликулов. Более чем в 2 раза снижались масса и массовый коэффициент яичников в сравнении с аналогичными показателями у животных интактной группы. Отмечено значимое снижение концентрации PGE2 в сравнении со значениями PGE2 у животных интактной группы, что соответствует литературным данным.
На фоне введения изучаемого препарата наблюдали дозозависимое увеличение массы и массовых коэффициентов яичников. При введении животным препарата в дозе 250 мкг/кг масса яичников не отличалась от соответствующих значений у интактной группы животных. Выявлена дозозависимая тенденция к увеличению доли примордиальных и третичных фолликулов наряду со снижением доли атретических фолликулов, что соотносилось с данными по уровню PGE2 и может свидетельствовать о нормализации процесса фолликулогенеза на фоне индуцированной введением циклофосфамида патологии. Полученные результаты экспериментальных исследований согласуются с данными ранее проведенных работ, в которых было показано, что введение животным экзогенного СТГ приводит к увеличению размеров и количества фолликулов.
По нашему мнению, необходимы клинические исследования возможности применения препарата на основе соматостатинсодержащего белка для лечения женского бесплодия, связанного с нарушениями процесса фолликулогенеза.



