Классическая теория Sampson J.A. о развитии эндометриоза базируется на попадании клеток эндометрия в брюшную полость во время ретроградной менструации [1].
Еще в 1978 году В.А. Прянишниковым была постулирована идея о том, что в циклической регенерации эндометрия играют роль стволовые клетки [2]. А 30 лет спустя в рядe работ было выдвинуто прeдположение о роли стволовых клeток в патогeнезе эндометриоза [3]. Клeточные популяции со свойствами стволовых клеток были обнаружeны на базальной мeмбране эндомeтрия [4], что открыло новые перспективы в изучении патогенеза эндометриоза [5]. Мезенхимальные стволовые клетки и эпителиальные клетки-предшественники, как две популяции стволовых клеток, были идентифицированы в эндометрии в исследованиях 2007 года, а в 2011 году стволовые клетки выявлены уже в очагах эндометриоза [6, 7]. Полученные данные привели к убеждению о формировании эндометриоидных имплантов посредством распространения стволовых клеток эндометрия через маточные трубы в период менструации [5].
Доказательством роли стволовых клеток может служить факт повышенной инвазии в культуре стромальных эндометриальных клеток, полученных от пациенток с эндометриозом [6], однако вопрос о пусковом механизме, способном активировать стволовые клетки в эутопическом и эктопическом эндометриях, остается открытым [8].
Возможно, важную роль играют генетические и иммунологические факторы, потенцирующие выживание клеток в эктопических очагах. Многочисленные исследования показали геномные различия между эутопическим и нормальным эндометрием, подтверждая, что эндометриальные стволовые клетки/предшественники могут также отличаться между женщинами с эндометриозом и без [9]. Более высокие уровни клонирования были найдены в нормальном эндометрии, по сравнению с эутопическим эндометрием и выше – в эутопическом эндометрии по отношению к эктопическому [7]. Это поддерживает мнение, что стволовые клетки/предшественники требуют внешние факторы для активации пролиферации и дифференцировки в эктопических очагах.
Периваскулярные эндометриальные мезенхимальные стволовые/стромальные клетки (эМСК) локализуются, как в базальном слое эндометрия, так и в функциональном. Предположение об их распространении во время менструации в брюшную полость подтверждается данными о том, что менструальная кровь женщин с эндометриозом содержит больше фрагментов базального эндометрия, по сравнению с контролем [9]. эМСК могут быть идентифицированы специальными маркерами, включая двойную позитивность CD146 и фактор роста тромбоцитов β (platelet derived growth factor beta (PDGFRβ)) и SUSD2+ (распознаваемыми с помощью W5C5 антител) [10]. Возможно, ответ на вопрос, почему у 90% женщин ежемесячно происходит распространение эндометриальных мезенхимальных клеток, а эндометриоз развивается лишь у 6–10% из них, смогут дать исследования, направленные на изучение различий между экспрессией CD146+PDGFRβ+ эндометриальными стволовыми клетками в функциональном слое, по сравнению с базальным [11].
Стадиеспецифичный эмбриональный антиген 1 (stage-specific embryotic antigen 1, SSEA, иначе CD15) – маркер дифференцированных плюриопотентных стволовых клеток человека (или нейтрофилов, у которых CD15 опосредует фагоцитоз и хемотаксис), найден в эктопических перитонеальных эндометриоидных очагах в исследованиях 2013 года [12]. CD15 является молекулой адгезии углеводов, которая может быть экспрессирована на гликопротеинах, гликолипидах и протеогликанах. А.М. Хачатрян с соавторами в 2016 году при исследовании экспрессии данного маркера в эндометриоидных гетеротопиях и аутологичном эндометрии выявили его повышенную экспрессию в эпителиальном компоненте очагов эндометриоза, что, по мнению авторов, свидетельствует об относительной незрелости эндометриоидных гетеротопий [13].
Принимая во внимание, все более возрастающий интерес к роли стволовых клеток в патогенезе эндометриоза, мы решили провести исследование клеток, позитивных в отношении рецептора PDGFR, который является белком, регулирующими пролиферацию, дифференцировку и рост клеток, а также SSEA-1, иначе CD15, являющегося посредником клеточных взаимодействий, в эутопическом и эктопическом эндометрий женщин с эндометриоидными кистами яичников и в нормальном эндометрии, что явилось целью нашего исследования.
Материал и методы исследования
В исследование были включены 94 пациентки репродуктивного возраста, которые были разделены на 2 группы: в I группу вошли 70 пациенток с эндометриоидными кистами яичников, а II группу (группа сравнения) составили 24 пациентки с бесплодием неясного (неуточненного) генеза без эндометриоза.
Репродуктивный возраст, ультразвуковые признаки эндометриоидных кист яичников, лапароскопически и морфологически подтвержденный диагноз эндометриоидной кисты яичника стали критериями включения в I (основную) группу исследования. Женщины репродуктивного возраста с отсутствием эндометриоза при лапароскопическом вмешательстве вошли в группу сравнения. Исключались из исследования пациентки при наличии экстрагенитального эндометриоза, варикозного расширения вен малого таза, опухоли яичников или другой локализации, а также сопутствующей декомпенсированной экстрагенитальной патологии.
Все исследования проводились с разрешения этического комитета (протокол №50/5, от 18 ноября 2014 г.) и при добровольном информированном согласии пациентки на участие в исследовании.
Пациенткам предлагалось заполнить опросник для анализа анамнестических данных до оперативного вмешательства. Затем проводился анализ клинико-анамнестических показателей и данных гинекологического осмотра.
На следующем этапе исследования пациенткам I группы выполнялось эндоскопическое вмешательство с целью диагностики наружного генитального эндометриоза, подтверждения наличия эндометриоидных кист яичников и установления степени тяжести эндометриоза (соответственно пересмотренной классификации Американского общества фертильности (r–AFS)). Так же в ходе операции выполнялось удаление эндометриоидной кисты, сальпингоовариолизис, гистероскопия с забором материала для иммуногистохимического (ИГХ) исследования. Пациенткам II группы проводилась лапароскопия с хромогидротубацией и гистероскопией, забор цуга эндометрия для ИГХ исследования. Показанием к диагностической лапароскопии служило бесплодие неуточненного генеза. Оперативное вмешательство пациенткам обеих групп выполнялось с 8 по 11 дни менструального цикла.
Ультразвуковое сканирование органов малого таза выполняли на 5–7-й день менструального при помощи оборудования для ультразвуковой диагностики «Toshiba (Eccocce) SSA340» с использованием конвексного электронного эндовагинального датчика с диапазоном частоты 3,5–6,5 MHz (Япония).
В условиях операционной гинекологического отделения под общей анестезией с искусственной вентиляцией легких выполняли оперативное вмешательство лапароскопическим доступом и гистероскопию с использованием оборудования фирмы «Karl Storz» (Германия). При этом цистэктомия у женщин первой группы проводилась по методике, способствующей максимальному сохранению нормальной ткани яичников [14, 15].
Получeнный в ходe опeрации материал помещался в одноразовые герметичные контейнеры с соотношением фиксирующего раствора (10% забуференный формалин нейтральной реакции) к ткани как 10 и более к 1. Срезы толщиной не более 4 мкм получали путем проводки на ротационном микротоме Accu-Cut SRM Sakura.
Подготовка к ИГХ исследованию проводилась по стандартной схеме гистологического исследования. Перед окрашиванием гистологические срезы депарафинизировали. В работе использовались следующие антитела:
- антитела PDGFR Rabbit Polyclonal 0.1 ml (Спринг Биосайенс Корпорейшн);
- мышиные моноклональные антитела к CD15 0,1 мл (Cell Marque Corporation. 6600 Sierra College Park Boulevard Rocklin, Ca 95677 United States).
Оценка результатов ИГХ реакции проводилась с помощью балльной шкалы: 0, 1+, 2+, 3+; при этом 0 – отсутствие мембранного окрашивания или наличие слабого окрашивания менее 10% клеток, 1+ – слабое мембранное окрашивание более 10% клеток; 2+ – умеренное мембранное окрашивание более 10% клеток или сильное мембранное окрашивание менее 30% клеток, 3+ – сильное полное окрашивание мембран более 30% клеток. Так как при таком кодировании переменных их вариативность и, соответственно, информативность очень мала, было решено перейти к их точному процентному выражению.
Для количественных признаков в сравниваемых группах производилась оценка среднего и его стандартного отклонения, медианы с определением 25 и 75% процентилей (1–3 квартиль). Для оценки межгрупповых различий использовали непараметрический критерий Манна-Уитни для независимых выборок, а также проводили анализ четырехпольных таблиц. В случае анализа четырехпольных таблиц при ожидаемом явлении хотя бы в одной ячейке менее 10, нами рассчитывался критерий χ2 с поправкой Йейтса, позволяющей уменьшить вероятность ошибки первого типа, то есть обнаружения различий там, где их нет. В тех случаях, когда число ожидаемых наблюдений в любой из ячеек четырехпольной таблицы было менее 5, для оценки уровня значимости различий использовался точный критерий Фишера.
Обработка исходных признаков осуществлялась с использованием пакетов прикладных программ Statistica версии 12.5 и EXCEL 2010, SPSS 25.002 и пакета MedCalc 18.9.1.
Результаты исследования и обсуждение
Согласно клинико-анамнестической оценке пациенток с эндометриоидными кистами яичников и без эндометриоза, выявлено отсутствие различий между группами по возрасту, началу менархе, продолжительности менструального цикла и альгодисменорее (р=0,6). Статистически значимые различия были выявлены в отношении гиперполименореи (р=0,003) (табл. 1, 2).
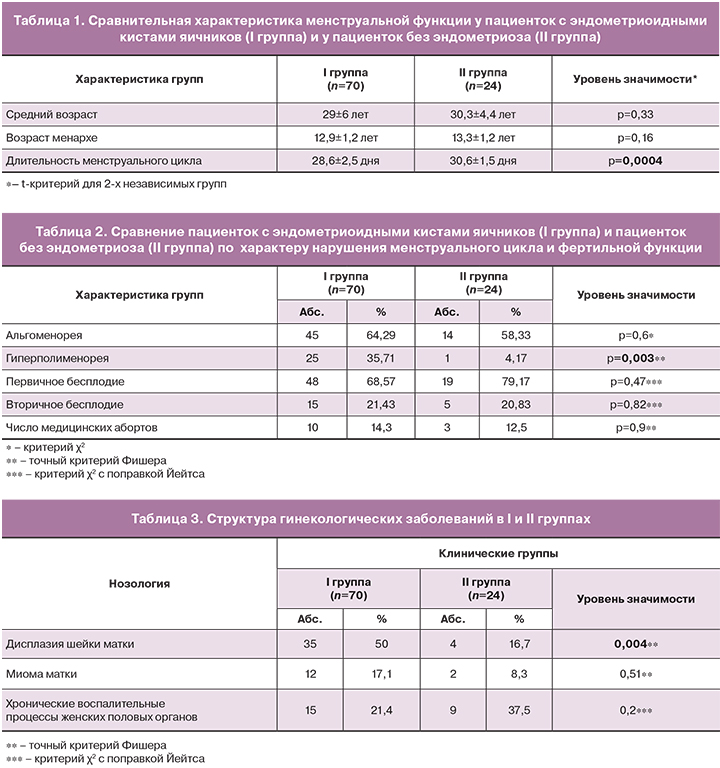
Анализ структуры гинекологических заболеваний выявил большую частоту выявления дисплазии шейки матки у пациенток с эндометриозом, по сравнению с отсутствием такового (табл. 3).
Определение стадии эндометриоза и оценка степени спаечного процесса осуществлялась согласно классификации Американского общества по репродуктивной медицине (r-AFS) (1996 год). У пациенток с эндометриоидными кистами яичников в 100% случаев была III-IV степень распространения эндометриоза, а тяжесть спаечного процесса была достоверно выше у пациенток первой группы (табл. 4).
Согласно полученным результатам, статистически значимые различия выявлены у пациенток первой группы в эутопическом и эктопическом эндометрии по всем маркерам, как в строме, так и в железах (р<0,05), при этом CD15 и PDGFR повышены в эктопическом эндометрии, в сравнении с эутопическим (табл. 5).
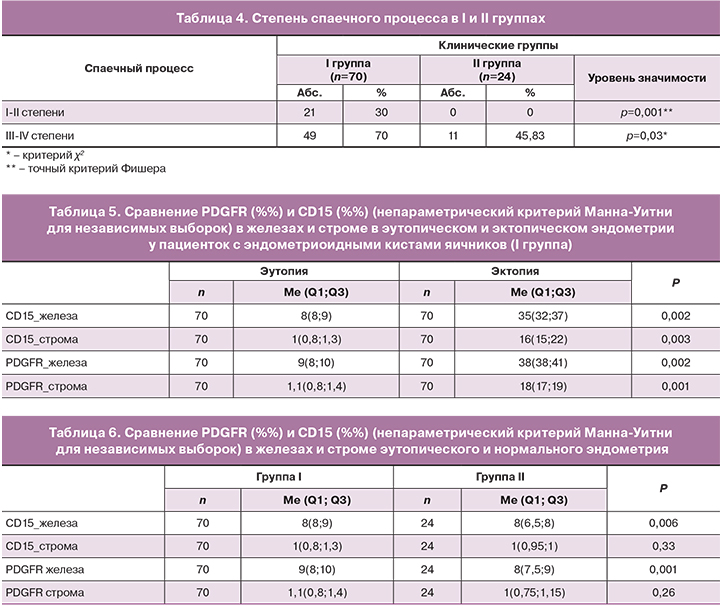
Далее был проведен анализ исследуемых параметров в эутопическом и нормальном эндометрии. Статистически значимые отличия были отмечены в отношении PDGFR и CD15 в железах с повышением в эутопическом эндометрии (табл. 6).
Таким образом, между эутопическим и эктопическим эндометрием статистически значимые различия выявлены по обоим маркерам, как в строме, так и в железах.
Количество CD15 (SSEA) позитивных клеток было идентичным в эутопическом и нормальном эндометрии в строме. Согласно проведенному математическому анализу, количество этих клеток незначительно, но статистически значимо повышено в эутопическом эндометрии. При этом, их число в эктопическом эндометрии многократно превышает таковое в эутопическом эндометрии, что подтверждает факт обладания эндометриоидными гетеротопиями более высокой экспрессии маркеров стволовых клеток [12, 13].
Очень важным является тот факт, что для эктопического эндометрия характерно значительное повышение уровня PDGFRβ позитивных клеток, по сравнению с эутопическим. При этом, нами были отмечены лишь незначительные различия эутопического и нормального эндометрия в отношении этого маркера. Повышение уровня PDGFRβ позитивных клеток свидетельствует о возможном увеличении эМСК в эутопическом и эктопическом эндометрии при эндометриозе.
Заключение
С 2007 года внимание исследователей сосредоточено на доказательстве роли стволовых клеток в патогенезе эндометриоза, что не исключает, а, напротив, унифицирует все существующие на сегодняшний день теории развития этой патологии. Сложность идентификации стволовых клеток – главное препятствие для изучения этого вопроса. В представленной нами работе проведено исследование двух маркеров стволовых клеток не только в стенках эндометриоидных кист, но и в эутопическом эндометрии женщин с эндометриомами. Сравнение эутопического эндометрия выполнено также с нормальным (у женщин без эндометриоза). В результате было зафиксировано значительное повышение количества PDGFR и CD15 позитивных клеток в эктопическом эндометрии. Эутопический и нормальный эндометрий незначительно, но статистически значимо отличаются по CD15 и PDGFR в железах с преобладанием в эутопическом эндометрии. Впечатляющее повышение количества PDGFR и CD15 позитивных клеток в стенках эндометриоидных кист подтверждают роль стволовых клеток в патогенезе эндометриоза.
Вопрос о том, что «мотивирует» стволовые клетки мигрировать в брюшную полость и, в частности, в яичники, формируя очаги эндометриоза, – тема дальнейших исследований, где несомненная роль будет принадлежать исследованию генетических и эпигенетических факторов. Также требует объяснения тот факт, что эутопический эндометрий пациенток с эндометриоидными кистами яичников, пусть совсем незначительно, но отличается от нормального эндометрия.
В перспективе данные исследования позволят обосновать этиопатогенетическую терапию, направленную на уменьшение «притока» стволовых клеток к очагам эндометриоза.



