Преждевременный разрыв плодных оболочек (ПРПО) – спонтанный разрыв амниотической мембраны перед началом схваток до 37 недель беременности [1–3]. Время от нарушения целостности плодных оболочек до начала родовой деятельности называется латентным периодом, длительность которого обратно пропорциональна гестационному сроку [4]. Распространенность ПРПО варьирует от 2 до 15% всех беременностей [5–8], является ведущей причиной преждевременных родов [9]. ПРПО, сопровождаемый преждевременными родами, является основной причиной заболеваемости и смертности в неонатальном периоде [10].
По сравнению с другими причинами преждевременных родов, ПРПО связан с высоким риском неонатальной заболеваемости и смертности только в случаях внутриутробной инфекции, что сопряжено с более высокими показателями внутриутробной смерти плода, ранней неонатальной инфекцией и некротическим энтероколитом [11].
Ежегодно во всем мире происходит 4 млн случаев смерти новорожденных, и примерно треть из них вызвана инфекциями. Сепсис и бактериальный менингит продолжают оставаться одной из основных причин неонатальной смертности, особенно среди новорожденных с очень низкой массой тела при рождении от матерей, беременность которых осложнилась ПРПО. Сепсис признан одной из наиболее тяжелых патологий у новорожденных.
Ранняя диагностика и лечение новорожденного с подозрением на сепсис необходимы для предотвращения тяжелых и опасных для жизни осложнений. По сравнению с понятными и ценными терапевтическими схемами, заподозрить диагноз сепсис у новорожденных сложно. Как правило, используются: общий анализ крови, прокальцитониновый тест, определение С-реактивного белка, бактериологическое исследование и верификация очага инфекции.
Средний объем тромбоцитов – mean platelet volume (MPV) – мера объема тромбоцитов в образце крови и обычно измеряется автоматическими гематологическими анализаторами с использованием электрического импеданса или метода оптической флуоресценции. Увеличение объема и размера тромбоцитов отражает наличие тромботической и воспалительной среды, на основании чего, MPV предлагается в качестве возможного маркера функции и активации тромбоцитов. Исследователи показывают, что MPV отражает воспаление, активность заболевания и эффективность противовоспалительного лечения при некоторых хронических воспалительных заболеваниях. Хотя основной патогенетический механизм изменения объема тромбоцитов еще не полностью понят, сложное взаимодействие тромбоцитов с патогенами и эндотелиальными клетками может завершиться сепсисом, тяжелым патофизиологическим каскадом, характеризующимся значительным снижением количества тромбоцитов и их дисфункцией [12, 13].
В настоящее время в перинатальной клинической практике на показатель MPV не обращают должного внимания при установлении диагнозов, выработке тактики, прогнозе состояния матери и плода.
Довольно широкие диапазоны нормальных значений MPV, делают невозможным учитывать данный параметр при принятии клинических решений [14].
Цель исследования: определить роль MPV крови у беременных с ПРПО при прогнозировании внутриутробного сепсиса.
Материалы и методы
Данное исследование является ретроспективным. Проведен анализ 84 историй родов пациенток с одноплодной беременностью, поступивших в ГБУ РО «Перинатальный центр» с 2017 по 2018 гг. по поводу ПРПО, произошедшего в сроках гестации 22,0–28,0 недель. Во всех случаях произошли преждевременные роды в сроках до 31,0 недели гестации. Критериями диагностики ПРПО явились: подтекание околоплодных вод при осмотре в стерильных зеркалах, положительный нитрозиновый тест, определение индекса амниотической жидкости путем ультразвукового исследования. Не включались в анализ случаи с сомнительным диагнозом, а также многоплодные беременности. Всем пациенткам, включенным в исследование, выполнены лечебные и диагностические мероприятия в объеме, предусмотренном приказом Министерства здравоохранения РФ от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)”», и письма Минздрава России от 17 декабря 2013 г. №15-4/10/2-9480 «Преждевременные роды». Дополнительно был проанализирован показатель MPV – средний объем тромбоцита в общем анализе крови у беременных. Измерения выполнялись на автоматическом гематологическом анализаторе MindrayBC-5300.
Из клинических данных анализировали: срок на момент родоразрешения, длительность безводного промежутка, индекс амниотической жидкости перед родоразрешением, признаки хориоамнионита, способ родоразрешения. Лабораторные данные: уровень лейкоцитов и MPV материнской крови, уровень С-реактивного белка матери, антибактериальная терапия до родоразрешения. Другие показатели тромбоцитов в данной статье не рассматривались; данный вопрос будет рассмотрен в последующих статьях; на данный момент проводится анализ изменений других характеристик тромбоцитов у данной группы беременных и анализ неонатальных исходов.
После рождения оценивали: пол и массу тела новорожденного; состояние ребенка по шкале Апгар на 1, 5 и 10-й минуте, шкале Даунс; время нахождения в отделении реанимации и интенсивной терапии недоношенных новорожденных (ОРИТН), наличие внутриутробного инфицирования.
Статистический анализ
Для анализа полученных данных были использованы параметрические и непараметрические методы статистики, в частности U-критерий Манна–Уитни (для сравнения выборок, распределение которых не подчиняется закону нормального распределения, рассматривались Ме (Q1;Q3)), t-критерий Стьюдента (для выборок, подчиняющихся нормальному распределению, рассматривались М±м). Метод корреляционного анализа (нахождение коэффициента корреляции, его значимости, коэффициента детерминации).
Обработка собранной информации осуществлялась с помощью программного обеспечения Statistica 12, в которой был сформирован массив данных и произведены основные расчеты.
Результаты
Характеристика выборки: в исследование включены 84 пациентки, которые были родоразрешены в сроке 22,0–31,0 недели, с диагнозом ПРПО и их 84 новорожденных ребенка. Разделены на две группы. В I группу (n=39) вошли пациентки, дети которых родились с внутриутробным сепсисом. II группа (n=45) – пациентки, дети которых родились без внутриутробного сепсиса. Диагноз внутриутробного сепсиса был выставлен после рождения на основании: повышения С-реактивного белка выше 5 мг/л, прокальцитонина >2 нг/мл, лейкоцитоза выше 15×109 л, нейтрофильного индекса >0,2 и выявленного очага инфекции.
Срок беременности на момент родоразрешения составил: I группа – 27,6±0,28 недели, II группа – 28,8±0,24 недели; длительность безводного промежутка: I группа – 102,4±21,9 ч, II группа – 106,7±15,5 ч.
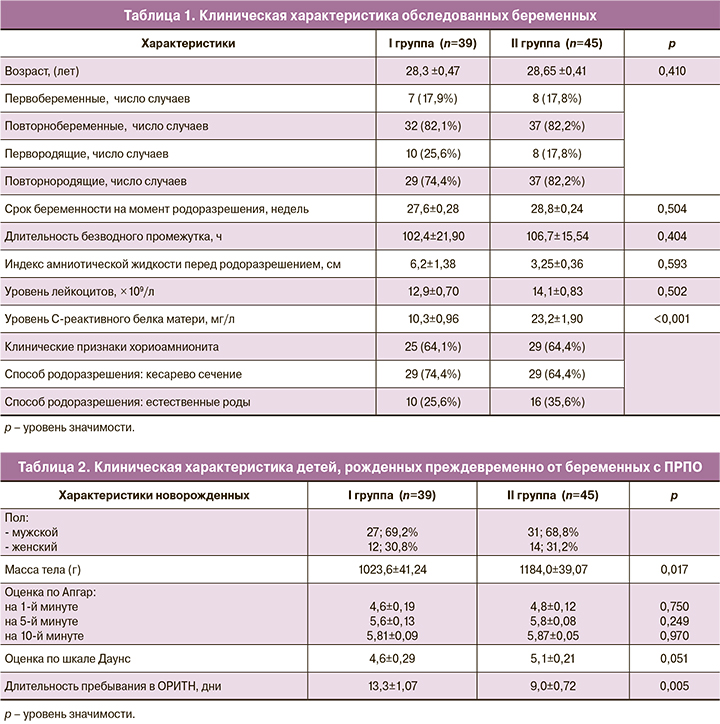
Возраст, паритет, характеристика клинического статуса беременных перед родоразрешением, лабораторные данные, наличие/отсутствие антибактериальной терапии представлены в таблице 1.
Новорожденные обеих групп не отличались по демографическим показателям и состоянию при рождении, оцененного с помощью шкалы Апгар, Даунс (табл. 2). Тем не менее, длительность послеродовой госпитализации была больше в I группе (с внутриутробным сепсисом), чем во II группе (без внутриутробного сепсиса). Среднее время пребывания детей в ОРИТН для I группы составило 13,3±1,07 дня, для II группы – 9,0±0,72 дня.
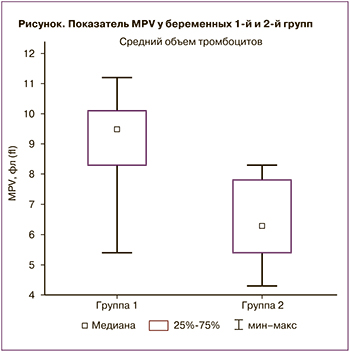 Перед родоразрешением у беременных, включенных в исследование, определяли MPV в общем анализе крови на анализаторе Mindray BC-5300 (рисунок).
Перед родоразрешением у беременных, включенных в исследование, определяли MPV в общем анализе крови на анализаторе Mindray BC-5300 (рисунок).
Для сравнения беременных по показателю MPV, был определен тип распределения данных (отличается от нормального), следовательно, был выбран U-критерий Манна–Уитни.
Сравнение медианных показателей MPV с использованием U-критерия Манна–Уитни показало статистически значимые различия между беременными в группе I (Me=9,5; Q1=8,3; Q3=10,1) и в группе II (Me=6,3; Q1=5,4; Q3=7,8) (p<0,001). У беременных, дети которых родились с внутриутробным сепсисом, показатель MPV общего анализа крови был значимо выше, чем в группе беременных, дети которых родились без внутриутробного сепсиса.
Обсуждение
Сепсис становится проблемой в отделениях интенсивной терапии новорожденных в связи с формированием устойчивых к антибактериальным препаратам штаммов микроорганизмов. Еще одна проблема – ранняя диагностика неонатального сепсиса. Заподозрить данный диагноз у новорожденных сложно, еще сложнее диагностировать это осложнение у недоношенных детей. Трудности возникают из-за неспецифической клинической картины и отсутствия надежных диагностических тестов. В связи с этим теряется время, и лечение начинается с опозданием.
Хотя большое количество исследований было сосредоточено на взаимосвязи между неонатальным сепсисом и тромбоцитопенией [15], работ, посвященных изучению зависимости между септическими осложнениями и свойствами тромбоцитов очень мало. В исследовании Guida J.D. et al. (2003) было показано, что значения MPV увеличиваются в результате повышенной выработки тромбоцитов и/или повышения скорости разрушения тромбоцитов при сепсисе [16]. В исследовании Abdelfadil A.M., Abdel Naem E.A. (2018) было выявлено, что MPV в крови детей с клиническим неонатальным сепсисом (11,7±1,3) и неонатальным сепсисом, подтвержденным бактериологической культурой (12,2±2,5), было выше, по сравнению с группой контроля (здоровые новорожденные) (8,5±2,5) [17]. Еще в одной работе у новорожденных с сепсисом были выявлены статистически более высокие значения MPV (10,2 мкл), по сравнению с новорожденными без неонатального сепсиса [12].
Если вопросу роли тромбоцитов в крови новорожденных и их морфологической характеристике посвящены единичные работы, то опубликованных работ, посвященных свойствам тромбоцитов (в частности MPV) в крови беременных женщин на фоне ПРПО в современных источниках научной литературы найдено не было.
Проведенное нами исследование показало, что у беременных с ПРПО, родивших недоношенных детей с внутриутробным сепсисом, перед родоразрешением был повышен MPV. Показатель MPV в общем анализе крови был значимо выше (Me=9,5; Q1=8,3; Q3=10,1), чем в группе беременных, дети которых родились без внутриутробного сепсиса (Ме=6,3; Q1=5,4; Q3=7,8). Можно предположить, что повышение MPV в крови матери перед родоразрешением отражает воспалительный статус матери, что не может рассматриваться отдельно от маточно-плацентарного комплекса и плода, и возможно, косвенно свидетельствует о воспалительном статусе у плода. Патогенез повышения MPV у женщин с ПРПО до конца не ясен. Однако, причина повышения MPV при сепсисе заключаются в разрушении тромбоцитов при их взаимодействии с микроорганизмами.
Таким образом, полученные нами данные – повышение MPV у беременных с ПРПО, родивших новорожденных с внутриутробным сепсисом, – позволяют считать данный показатель на фоне ПРПО предиктором рождения недоношенного ребенка с внутриутробным сепсисом.
Преждевременные роды и недоношенность – одни из основных причин неонатальной заболеваемости и смертности. Особенно это важно в отношении беременностей с ПРПО, поскольку, кроме недоношенности, у новорожденных имеются факторы внутриутробного инфицирования.
Заключение
Беременные с ПРПО в сроке гестации 22,0–28,0 недель должны быть отнесены к высокой группе риска по развитию внутриутробного сепсиса. Маркером развития внутриутробного сепсиса является повышение MPV в общем анализе крови накануне родоразрешения.
Дополнительные маркеры (простые и не требующие дополнительных затрат), позволяющие оценить возможность безопасного пролонгирования беременности (либо необходимость срочного родоразрешения), могут иметь огромное значение для практического здравоохранения.



