Репродуктивная функция находится под контролем синхронизированного взаимодействия нервной и эндокринной систем. Функциональная гипоталамическая аменорея (ФГА) – патологическое обратимое состояние, возникающее на фоне психологических стрессов или хронического энергетического дефицита, приводящее к нарушению нейромедиаторных сигнальных путей и дизрегуляции гипоталамо-гипофизарно-яичниковой (ГГЯ) системы [1]. ФГА характеризуется снижением частоты выбросов гонадотропин-рилизинг гормона, уменьшением частоты и амплитуды ЛГ и ФСГ, гипоэстрогенией и аменореей.
Традиционным подходом к ведению пациенток с ФГА является назначение менопаузальной гормонотерапии (МГТ). Рекомендации по ее применению основаны на ассоциации ФГА с низкими уровнями половых стероидных гормонов. Однако патофизиологические механизмы развития ФГА достаточно сложны и МГТ не оказывает существенного влияния на этиологические факторы и основные звенья патогенеза. Можно считать, что МГТ носит преимущественно симптоматический характер в виде индукции закономерной менструальноподобной реакций (ЗМПР), тем самым маскируя проблему и задерживая ее адекватное решение [2]. В связи с этим в настоящее время большое внимание уделяется разработке терапевтических подходов, направленных на модификацию факторов риска, коррекцию патогенетических механизмов формирования ФГА и восстановление самостоятельных менструаций.
С 1980-х годов проводятся попытки лечения ФГА путем применения непрямого индуктора овуляции – кломифена цитрата (КЦ). Основной механизм действия КЦ заключается в блокаде эстрогеновых рецепторов на уровне гипоталамуса. Далее по механизму отрицательной обратной связи увеличивается секреция ФСГ и ЛГ и инициируется рост фолликулов и синтез эстрогенов [3]. Такой механизм действия дал основание для использования КЦ при ФГА, хотя данные о его эффективности достаточно противоречивые. Так, есть сведения об отсутствии эффекта КЦ (100 мг в сутки по стандартной 5-дневной схеме) у пациенток со стресс-индуцированной ФГА, хотя отмечалось двукратное повышение уровня ЛГ и почти 20-кратное повышение уровня эстрадиола без изменения концентраций ФСГ на 5-й день стимуляции [4].
По данным других исследований, применение КЦ по стандартной схеме (50–100 мг в сутки), проводимой в течение 1–3-х месяцев, способствует индукции овуляции у 43,8–50% больных [5, 6]. Следует отметить, что во всех этих публикациях отсутствует информация о восстановлении собственного менструального цикла у больных с ФГА. Djurovic M. и соавт. использовали 10-тидневный курс КЦ в дозе 50 мг в сутки для лечения ФГА на фоне нервной анорексии (НА) в анамнезе [7]. Индукция менструации без последующего восстановления ритма менструаций наблюдалась у 53% больных. В исследовании Borges L.E. оценивалась эффективность 3-х 5–10 дневных циклов стимуляции КЦ в дозе 50–100 мг у 8 больных с ФГА, возникшей на фоне интенсивных физических нагрузок и соблюдения диеты [8]. Возобновление самостоятельных менструаций было отмечено у всех больных.
Таким образом, данные об эффективности применения КЦ при ФГА малочисленны и достаточно противоречивы, исследования выполнены на малых выборках больных и при разных протоколах назначения препарата, а также отсутствует информация о возможных предикторах восстановления менструального цикла. Это в сочетании с необходимостью совершенствования методов лечения ФГА послужило поводом для выполнения данного исследования
Цель исследования: оценить эффективность терапии КЦ в режиме «down-step» при ФГА и определить возможные клинико-лабораторные предикторы ответа на терапию.
Материал и методы
В исследование были включены 84 больные с ФГА (средний возраст 25,6±5,1 лет, средний индекс массы тела (ИМТ) – 19,8±2,2 кг/м2). Средний возраст менархе составил – 13,1±1,2 лет. До развития заболевания 68 пациенток (80,7%) отмечали регулярный менструальный цикл, соответственно 16 (19,3%) – задержки менструаций с менархе от 1 до 6 месяцев. Средний возраст возникновения ФГА составил 20,9±7,2 лет, длительность аменореи – 3,5±4,2 года. В качестве возможных причин ФГА 15 пациенток (17,9%) выделяли приверженность диете, 11 (13,1%) – стресс, 7 (8,3%) – чрезмерные физические нагрузки, 1 (1,2%) – не связывала ФГА ни с одним из этих факторов, 50 (59,5%) – отмечали разные комбинации этих факторов.
Критериями включения в исследование явились следующие данные: наличие ФГА, возраст от 18 до 35 лет, отмена гормональной терапии за 3 и более месяцев до вступления в исследование. К критериям исключения были отнесены: типичная форма НА, профессиональная спортивная активность, наличие признаков клинической и/или биохимической гиперандрогении, гиперпролактинемия, нарушения функции щитовидной железы, гипергонадотропная аменорея, органическая патология ГГЯ оси, тяжелая соматическая и психическая патология.
Протокол исследования включал оценку массо-ростовых показателей с расчетом ИМТ (масса тела в кг/рост в м²), гормональное обследование и ультразвуковое исследование (УЗИ) органов малого таза. Определение эстрадиола (Е2), лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ) в сыворотке крови выполняли на автоматическом иммунохимическом анализаторе «Cobas е411» (Roche Diagnostics GmbH, Германия).
УЗИ органов малого таза проводилось на аппарате 2000 Toshiba SSA-240 (Япония) трансвагинальным конвексным датчиком частотой 7,5 Мгц, с определением толщины эндометрия, объема матки и яичников.
Для оценки функционального резерва ГГЯ системы и возможности восстановления ритма менструаций использовали 3-х месячный курс терапии КЦ в режиме «down-step». После индукции ЗМПР прогестагенами или в любой день при ее отсутствии, в течение 10 дней назначали КЦ в дозе 50 мг в сутки с 3 по 7 день цикла, в дозе 100 мг в сутки – с 8 по 12 день цикла. На 12–14 день цикла определяли уровни ЛГ, ФСГ, Е2, на 20–22 день цикла выполняли УЗИ органов малого таза для оценки признаков произошедшей овуляции и состояния эндометрия. При появлении менструации в ответ на 10-дневный курс терапии КЦ, в течение 2 последующих циклов КЦ назначали в курсовой дозе 500 мг с 3 по 7 день цикла с последующим УЗИ мониторингом состояния яичников и эндометрия. При отсутствии менструации на 35 день цикла – проводили индукцию ЗМПР путем 10-дневного назначения прогестагенов. Ответ на терапию расценивали, как полный, в случае появления менструаций на фоне 3-х циклов КЦ и их сохранения после его отмены. Ответ расценивали, как частичный, при появлении менструаций на фоне КЦ и их отсутствии после завершения терапии. При отсутствии менструаций на фоне 2-х последовательных циклов приема КЦ ответ расценивали, как отрицательный.
Для статистического анализа материала использовали программу SPSS (IBM Statistical Package for the Social Science, 21 версия). Все данные представлены как средние ± стандартное отклонение. Сравнение проводили с помощью U-теста Манна-Уитни, для выявления корреляций был использован метод Спирмена. Статистическими значимыми считали результаты при достижении уровня ошибки р˂0,05.
Для построения многофакторной прогностической модели использовали метод логистической регрессии с включением всех независимых факторов. Статистика согласия модели оценивалась с использованием универсальных критериев для коэффициентов модели (шаг-блок-модель) на каждом шаге. В качестве зависимой переменной использовали принадлежность субъекта к группе с восстановлением ритма менструаций и без восстановления ритма менструаций. В качестве независимых переменных использовали количественные и категориальные переменные, удовлетворяющие вышеописанным условиям отбора. Регрессионное уравнение имеет вид:
y=exp(b0+b1*x1+...+bn*xn)/[1+exp(b0+b1*x1+...+bn*xn)],
где xi – независимые переменные,
у – зависимая бинарная переменная,
bi – регрессионные коэффициенты.
Для определения диагностической значимости модели была построена ROC-кривая.
Результаты исследования
По результатам гормонального обследования нормогонадотропная аменорея была диагностирована у 22,6% (19/84) больных, гипогонадотропная, характеризующаяся низкими показателями ЛГ (≤3 МЕ/л) или ФСГ (≤3 МЕ/л) – у 77,4% (65/84). Средние уровни ЛГ, ФСГ и Е2 у женщин с ФГА составили 2,37±2,1 МЕ/л, 5,04±2,26 МЕ/л, и 77,5±87,1 нмоль/л, соответственно.
Перед назначением КЦ всем пациенткам проводили пробу с прогестагенами для оценки эстрогенной насыщенности и индукции ЗМПР. Положительный ответ был отмечен у 59,5% (50/84) больных. Алгоритм ведения пациенток с ФГА в зависимости от реакции на терапию КЦ схематично представлен на рисунке 1.
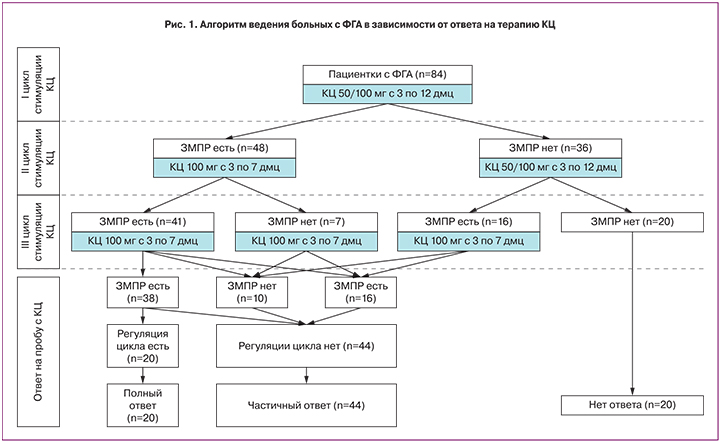
В зависимости от характера ответа на КЦ все пациентки были разделены на 3 группы:
- 1-я – С отсутствием ответа (n=20, 23,8%);
- 2-я – С частичным ответом на КЦ (n=44, 52,4%);
- 3-я – С полным ответом на КЦ (n=20, 23,8%).
Результаты клинико-лабораторного обследования пациенток на фоне 3-х циклов терапии представлены в таблице 1. Отсутствие менструаций после 1 цикла КЦ отмечено у 36 (43%) больных, для них были характерны более низкие уровни ЛГ без различий в уровнях ФСГ. В группах с частичным и полным ответом на КЦ отмечено 4-хкратное увеличение уровня эстрадиола на 12–14 день цикла в сравнении с группой не ответивших на терапию (р<0,05). В группе с полным ответом частота овуляции составила 50%(10/20), в группе с частичным ответом – 31,8%(14/44). Среднее значение М-Эхо на 20–22 день цикла было достоверно больше в группе с частичным и полным ответом на терапию. На фоне 1 цикла стимуляции фолликулярные кисты (диаметр от 30 до 50 мм) были выявлены у 20% (4/20) пациенток с отсутствием ответа, у 29,5% (13/44) – с частичным ответом и у 25% (5/20) – с полным ответом на терапию. Второй цикл стимуляции КЦ начинали после самостоятельного регресса фолликулярных кист яичников.
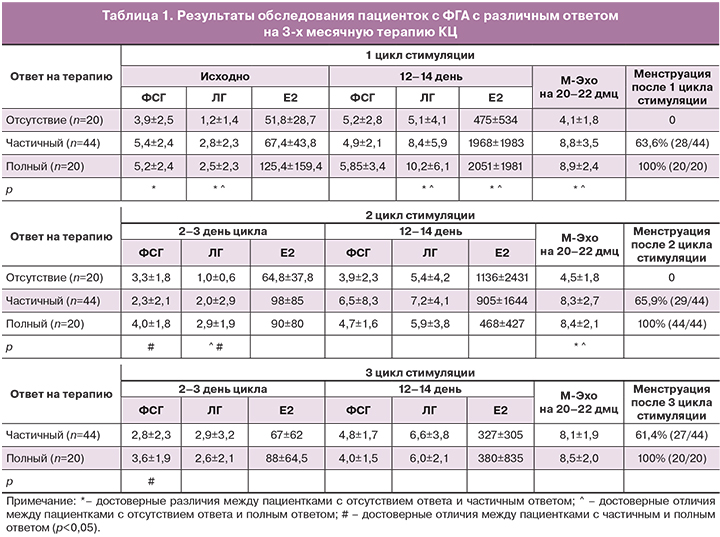
Как видно из данных таблицы 1, перед назначением 2-го курса КЦ более высокие уровни ЛГ и ФСГ на 2–3 день цикла были отмечены у пациенток с полным ответом. Хотя средние уровни этих гормонов перед 1-м и 2-м курсами КЦ, а также на 12–14 день в двух циклах КЦ существенно не различались. При этом, в группе с полным ответом частота овуляции на 2-м цикле КЦ была выше, чем с частичным (35 и 25%). Частота функциональных кист яичников у пациенток с отсутствием ответа составила 20% (4/20), с частичным ответом – 13,6% (6/44), с полным ответом – 5% (1/20). Значения М-Эхо были аналогичными значениям, полученным на фоне 1-го цикла стимуляции (р>0,05).
Поскольку отрицательный ответ на пробу с КЦ расценивался, как отсутствие менструаций на фоне 2-х последовательных циклов терапии, сравнение клинико-лабораторных параметров на фоне 3-го цикла проводилось между пациентками с частичным и полным ответом на терапию.
Исходные уровни ЛГ, ФСГ, Е2 перед 3-м циклом терапии не отличались от таковых перед предыдущими циклами. Не было выявлено также достоверных различий в уровнях гонадотропинов и Е2 между группами на 12–14 день цикла (р>0,05). Тем не менее, частота овуляции при полном ответе была в 2 раза выше, чем при частичном ответе (40 и 27,3% соответственно, p<0,05). Частота функциональных кист в яичниках не различалась (р>0,05) и составила 11,3% в группе с частичным ответом и 10% – с полным.
С целью выявления факторов, играющих роль в ответе на терапию КЦ, был проведен сравнительный анализ клинико-лабораторных показателей по группам. Установлено, что при положительной пробе с прогестагенами (n=50) полный ответ на пробу с КЦ отмечен у 28% (14/50) больных, частичный – у 68% (34/50), отсутствие ответа – лишь у 4% (2/50). При отрицательном ответе на пробу с прогестагенами отсутствие ответа на КЦ наблюдалось в 32,4% (11/34) случаев, частичный ответ – в 50% (17/34), полный – лишь в 17,6% (6/34).
Пациентки с отсутствием ответа на КЦ характеризовались более низкими исходными значениями гонадотропинов и Е2. Доля пациенток с гипогонадотропной формой ФГА при отсутствии ответа на КЦ составила 95%, в то время, при частичном ответе – 77%, при полном – 60%. Гипоэстрогения (Е2 менее 100 нмоль/л) была характерна для 95% больных с отсутствием ответа на пробу с КЦ, для 79,5% – с частичным ответом и для 65% – с полным, хотя статистических различий между группами по средним значениям Е2 не выявлено (p>0,05). Частота гипогонадотропного состояния и гипоэстрогении перед проведением каждого цикла стимуляции представлены в таблице 2.
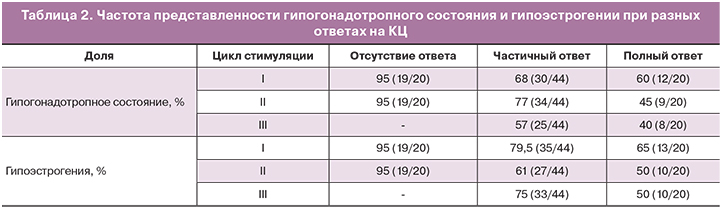
Полный ответ на КЦ встречался в 2 раза чаще при нормогонадотропной ФГА (36,8%), чем при гипогонадотропной (20%). Вместе с тем, не удалось выявить зависимости между характером ответа на КЦ и клинико-анамнестическими данными (возраст менархе, длительность аменореи, провоцирующий фактор) (р>0,05).
Использование метода множественной логистической регрессии с пошаговым исключением переменных по алгоритму Вальда позволило разработать прогностическую модель по оценке предикции восстановления ритма менструаций у пациенток с ФГА на терапию КЦ.
Формула прогностической модели:
Y= 2,96 + 0,38[ИМТ] – 0,337[ЛГ/ФСГ] + 0,194[ЛГ] + 0,04[Е2]
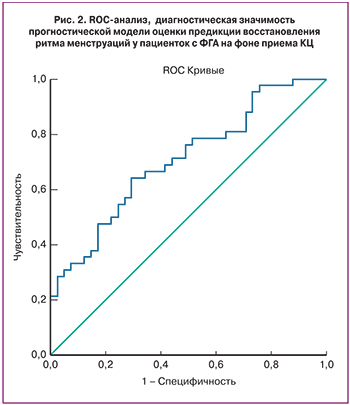 Согласно проведенному ROC-анализу, площадь под кривой, составила AUC=0,708, что указывает на «хорошее» качество модели. Пороговая точка отсечки (cutoff) составила 0,52 при уровне чувствительности 64% и специфичности 71% (рис. 2). К наиболее значимым предикторам полного ответа на терапию КЦ относились уровни ЛГ>2,71 МЕ/л, Е2 >106,5 нмоль/л, ЛГ/ФСГ>0,88, ИМТ>20,6 кг/м2.
Согласно проведенному ROC-анализу, площадь под кривой, составила AUC=0,708, что указывает на «хорошее» качество модели. Пороговая точка отсечки (cutoff) составила 0,52 при уровне чувствительности 64% и специфичности 71% (рис. 2). К наиболее значимым предикторам полного ответа на терапию КЦ относились уровни ЛГ>2,71 МЕ/л, Е2 >106,5 нмоль/л, ЛГ/ФСГ>0,88, ИМТ>20,6 кг/м2.
Обсуждение
Многообразие этиологических факторов и патофизиологических механизмов развития ФГА обуславливают сложности в ведении данной категории пациенток. МГТ, традиционно используемая, как метод лечения ФГА, носит преимущественно симптоматический характер. Это определяет актуальность поиска альтернативных подходов к ведению пациенток с ФГА с целью восстановления функционального состояния ГГЯ оси и ритма менструаций. В данном исследовании проводилась оценка ответа на терапию КЦ при ФГА, доля пациенток с нормогонадотропной аменореей составила 22,6%, гипогонадотропной – 77,4%. Кумулятивный ответ на КЦ в виде появления менструации был отмечен у 76,2% больных: после 1 цикла – у 57,1%, после 2 цикла – у 67,9%, после 3 цикла – у 84,4%. Сохранение самостоятельных менструаций после завершения 3-х месяцев лечения было отмечено у 31,25% больных. Частота восстановления ритма менструаций после проведения 3-х курсов терапии КЦ отличалась в сравнении с результатами предыдущих исследований. Так, по данным L.E. Borges и др. возобновление собственных менструаций после первого цикла приема КЦ по использованной нами схеме отмечалось у 6 из 8 пациенток с ФГА [8]. Вместе с тем, в исследовании Djurovic и соавт. отмечено, что после 10-дневного курса КЦ в дозе 50 мг значительно повысились уровни ЛГ и Е2, менструация была отмечена у 52,9% больных, однако сохранение самостоятельного ритма менструаций не наблюдалось ни в одном случае [7].
С практической точки зрения, на этапе обследования важно выделить группы пациенток с ФГА с потенциальным положительным ответом на терапию. Проведенный анализ показал, что полный ответ на КЦ встречался почти в 2 раза чаще у пациенток с нормогонадотропной формой ФГА (36,8%), в сравнении с гипогонадотропной (20%). Пациентки с отсутствием ответа на КЦ отличались более низкими значениями ФСГ, ЛГ и Е2, в сравнении с женщинами с частичным и полным ответом. К числу предикторов восстановления ритма менструаций у пациенток с ФГА можно отнести уровни ЛГ>2,71 МЕ/л, Е2>106,5нмоль/л и ЛГ/ФСГ>0,88, ИМТ>20,6 кг/м2.
Согласно имеющимся в литературе данным, частота овуляции при ФГА на фоне стандартной схемы приема КЦ составляет 29,2–37,5% [5, 6, 9, 10]. В проведенном исследовании частота овуляции на фоне 1, 2 и 3 цикла стимуляции КЦ составила 31,8, 25 и 27,3% в группе с частичным ответом и 50, 35, 40% – в группе с полным ответом. Разница, по всей видимости, обусловлена более выраженным подавлением гипоталамо-гипофизарной системы у больным с частичным ответом на терапию.
Известно, что КЦ хорошо переносится пациентками и серьезные осложнения на фоне его приема достаточно редки. В некоторых случаях прием КЦ может стать причиной синдрома гиперстимуляции яичников и формирования кист яичников. По данным литературы, у пациенток с СПКЯ на фоне приема КЦ в дозе 50–100 мг в сутки в течение 5 дней частота развития кист яичников варьирует от 5,7 до 12% [11]. Однако в доступной литературе не удалось найти данных о частоте формирования кист яичников на фоне приема КЦ при ФГА. По результатам проведенного исследования, частота функциональных кист варьировала от 5 до 29,5%, наиболее часто – на фоне 1-го цикла терапии. Вероятнее всего, это можно объяснить более высокой дозой (750 мг на цикл) и длительностью приема КЦ. Все кисты спонтанно регрессировали в течение месяца и не требовали назначения дополнительной медикаментозной терапии.
Заключение
Полученные результаты позволяют сделать заключение, что используемый протокол КЦ можно рассматривать как альтернативный подход к лечению ФГА. За счет сенсибилизации ГГЯ оси КЦ способствует возобновлению ритма менструаций у 76% больных, с последующим их сохранением у каждой третьей больной после завершения терапии.



