Исследования последних лет показали, что причиной около 60,0% спорадических и 12,5% случаев привычных выкидышей являются анеуплоидии. Оценка состояния эмбриона/плода, в том числе диагностика хромосомных анеуплоидий (ХА), при угрожающем и привычном выкидыше является чрезвычайно актуальной. В современных социальных условиях планирование и наступление беременности часто происходит у женщин старшего репродуктивного возраста, что повышает риск ХА плода. Беременности плодом с хромосомной патологией часто сопровождаются угрожающим выкидышем, неоднократными кровотечениями, нередко заканчиваются преждевременными родами [1]. Именно правильная постановка диагноза при анеуплоидии плода приводит к выбору рациональной тактики ведения осложненной беременности. Вместе с тем при угрожающем и привычном выкидыше проведение инвазивных методов пренатальной диагностики затруднено и без веских оснований противопоказано. Инвазивные процедуры, являясь диагностическим стандартом, тем не менее могут привести к осложнениям беременности вплоть до ее самопроизвольного прерывания в 1,0–2,0% случаев. Поэтому инвазивная диагностика должна проводиться после тщательного обоснования с детальным учетом результатов скрининга.
Одними из самых частых анеуплоидий, приводящих к рождению ребенка с пороками и задержкой развития, являются трисомии по 21, 18 и 13-й хромосомам. Они встречаются в одном случае на 650–1000, 6000–8000 и 10000–16000 новорожденных соответственно [2–4]. Риск данных хромосомных нарушений у плода существенно возрастает с возрастом матери. Причиной синдромов Дауна, Эдвардса или Патау у детей также могут являться частичные анеуплоидии, при наличии у клинически здоровых родителей сбалансированных перестроек (транслокаций), в которые вовлечены хромосомы 21, 18 и 13.
В последние несколько лет в России внедрен новый порядок пренатального обследования, впервые регламентированный Постановлением Правительства Российской Федерации №572 от 12.11.2012г. Он базируется на результатах ультразвукового исследования (УЗИ) и биохимических показателях в I триместре и на данных УЗИ для исключения поздно манифестирующих пороков развития во II триместре. Скрининг основан на косвенных маркерах и имеет ограничение по чувствительности и специфичности, колебания биохимических показателей зависят как от хромосомного статуса плода, так и от гормонального статуса беременной женщины. В результате комбинированный скрининг I триместра (сочетание биохимических маркеров с данными УЗИ) даже при четком соблюдении сроков обследования позволяет отнести в группу риска для последующего проведения инвазивной диагностики лишь около 80% беременностей плодами с трисомией по 21-й хромосоме [5, 6].
Таким образом, имеется необходимость в разработке и внедрении в практическое здравоохранение более современных неинвазивных скрининговых методов, позволяющих выделять группу риска с более высокой точностью.
Наиболее перспективным в данном направлении является неинвазивный пренатальный ДНК-скрининг анеуплоидий (НИПС), основанный на анализе внеклеточной ДНК плода в крови матери (далее «ДНК-скрининг») [7, 8]. Источником внеклеточной ДНК плода в кровотоке матери являются апоптотические клетки плодового происхождения [9]. В большинстве случаев ДНК плода циркулирует в крови матери в количестве, достаточном для надежного анализа существующими в настоящее время методами, начиная с 10–11 недель беременности, и не детектируется уже через сутки после родов. Это позволяет осуществлять ДНК-скрининг по крови матери, в том числе у повторнобеременных женщин [10–14].
ДНК-скрининг по крови матери может проводиться с использованием методов высокопроизводительного секвенирования [15, 16]. В настоящее время этот метод начинает широко применяться в мировой и российской лабораторной практике для решения клинических задач. Высокопроизводительное секвенирование суммарной внеклеточной ДНК матери и плода с последующим статистическим биоинформационным анализом позволяет оценить количество фрагментов, приходящееся на каждую из хромосом, что дает возможность определить наличие или отсутствие анеуплоидий плода. Этот принципиально новый подход в пренатальном скрининге является прямым методом исследования и может служить эффективным инструментом выявления ХА плода у беременных женщин. По данным многочисленных исследований [13, 17–21] метод обладает высокими диагностическими характеристиками, которые, однако, могут различаться в зависимости от исследуемых хромосом. Здесь и далее диагностические характеристики приводятся с 95% доверительным интервалом в соответствии с «Правилами оценки клинической информативности лабораторных тестов. ГОСТ Р 53022.3-2008».
Учитывая высокую точность метода НИПС актуальной является оценка его клинической значимости у женщин с привычным выкидышем.
Цель настоящего исследования: оценка эффективности НИПС методом высокопроизводительного секвенирования для выявления трисомий 21, 18, 13 и половых хромосом плода в образцах крови женщин с привычным выкидышем и осложненным течением данной беременности.
Материал и методы исследования
Всего были обследованы 600 женщин в сроках беременности от 11 до 16 недель и 6 дней. Группа с привычным выкидышем включала 270 женщин, группа без привычного выкидыша – 330 женщин. Проводился сбор анамнестических данных, клиническое обследование, скрининг I триместра беременности – эхография, определение содержания сывороточных маркеров, компьютерный анализ. При отборе пациенток учитывались ограничения метода: онкологические заболевания у беременной женщины; многоплодная беременность, включая случаи спонтанной редукции одного из плодов; индекс массы тела пациентки более 30 кг/м2.
Исследование проведено в отделнии клинической и молекулярной генетики ФГБУ НМИЦ АГП им. В.И. Кулакова. Анализировали образцы материнской венозной крови (10 мл ЭДТА) 600 беременных женщин с одноплодной беременностью. Была предоставлена информация по каждому образцу крови, код пациентки выставляли автоматически, учитывали возраст женщины, гестационный срок, дату забора крови. У всех женщин было получено добровольное согласие на исследование и забор периферической крови из вены.
Полученный материал анализировали с помощью полупроводникового высокопроизводительного секвенирования. В периферической крови женщины определяли наличие или отсутствие у плода анеуплоидий, а также его пол следующим образом. На первом этапе из крови матери отделяли плазму. На втором этапе выделяли внеклеточную ДНК, содержащую материнскую и фетальную фракции. В последующем последовательно осуществляли приготовление библиотек ДНК для высокопроизводительного секвенирования, эмульсионную полимеразную цепную реакцию (ПЦР) и секвенирование на приборе Ion Proton (Life Technologies, США). Результаты оценивали с помощью биоинформатической обработки данных секвенирования ДНК. Для сравнения покрытия внутри образца применяли T-test.
Результаты исследования
У всех исследуемых женщин беременность завершена, нами проанализированы течение и исходы беременности.
Проанализированы клинические и анамнестические данные беременных, включенных в исследование на основании вышеизложенных критериев. Проведен тщательный сбор анамнеза пациенток исследуемых групп – данные о возрасте, социально-экономическом положении, профессиональных вредностях, наследственности; проанализированы экстрагенитальная и гинекологическая заболеваемость, характер менструальной функции, репродуктивный анамнез.
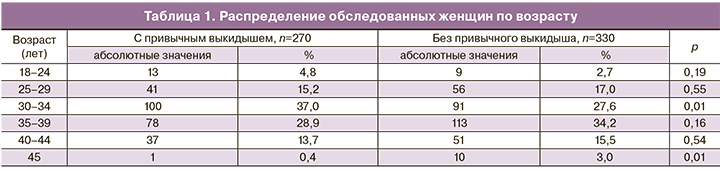
Средний возраст женщин в исследуемых группах 34,9±5,5 года, в группе без привычного выкидыша средний возраст составил 33,9±5,5 года, в группе с привычным выкидышем 35,1±5,5 года. Распределение женщин по возрасту представлено в табл. 1.
В группе с привычным выкидышем было больше женщин возрастной категории 30–34 года, в группе без привычного выкидыша – женщин в возрасте 45 лет.
Все женщины проживали в одинаковых климатогеографических условиях – преимущественно в Москве и Московской области, имели среднее и высшее образование. Профессиональных вредностей при сборе анамнеза не выявлено.
Результаты анализа свободной эмбриональной ДНК (сэ-ДНК) в крови матери были получены для 600 женщин. В 12 наблюдениях (2%) результат не был получен с первого раза, поскольку в образце было недостаточное количество сэ-ДНК (менее 4%). Проводили повторный забор венозной крови у 10 беременных, фракция сэ-ДНК возросла, в связи с чем удалось получить результаты исследования. В 2 наблюдениях (0,3%) результат так и не был получен, в данных случаях была проведена инвазивная процедура (амниоцентез), установлен нормальный кариотип плода. Средний уровень сэ-ДНК у вышеуказанных 12 женщин составил 2,3%, в отличии от пациентов с полученным результатом исследования – 11,1 %.
При высоком риске ХА плода по данным комбинированного скрининга всем женщинам настоятельно рекомендована инвазивная процедура с последующим кариотипированием, от которой беременные отказались с оформлением письменного отказа в амбулаторной карте.
В исследовательских целях с учетом всех необходимых условий для проведения теста беременным было предложено проведение НИПС с обязательным разъяснением возможностей и ограничений метода. После подписания формы информированного согласия проводился НИПС, интерпретация результатов проводилась врачом-генетиком. Во всех случаях, когда требовалось изменение тактики ведения беременности, пациентки были направлены на инвазивную процедуру (амниоцентез) с последующим кариотипированием.
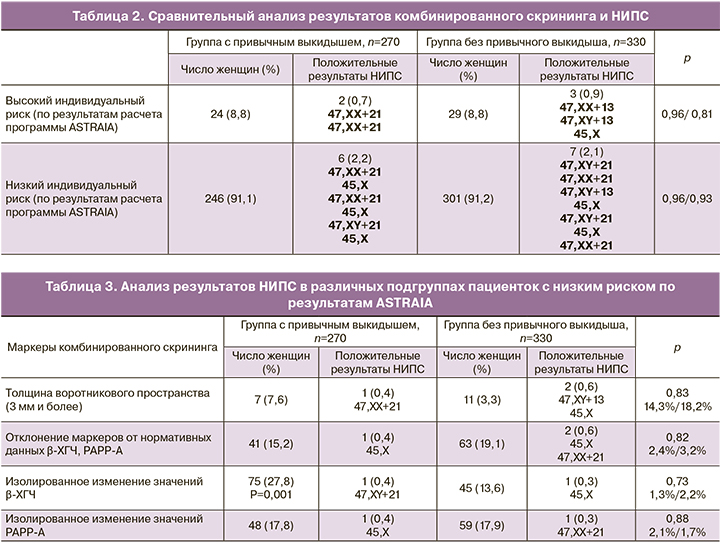
В 18 наблюдениях (3%) по результатм НИПС получен высокий риск ХА, беременным рекомендовано проведение инвазивной пренатальной диагностики (табл. 2).
По результатам комбинированного скрининга лишь у 5 из 53 женщин, то есть в 9,4% случаев пациенток был установлен высокий риск по НИПС, во всех случаях ХА подтверждены кариотипированием. В то время как среди 547 женщин низкого риска по данным комбинированного скрининга лишь у 13 пациенток методом НИПС выявлен высокий риск анеуплоидий. Во всех случаях трисомии по 21-й и 13-й хромосомам были подтверждены кариотипированием. В случаях моносомии Х были расхождения данных, обусловленные мозаицизмом.
При сравнительном анализе результов комбинированного скрининга и НИПС в различных подгруппах пациентов установлено, что при комбинированном скрининге в группе с привычным выкидышем лишь у 2 из 24 женщин высокий риск был установлен по результатам НИПС. В группе без привычного выкидыша у 3 из 29 женщин были положительные результаты НИПС. В группе низкого индивидуального риска по результатам комбинированного скрининга в группе привычного выкидыша методом НИПС выявлено 6 женщин с высоким риском анеуплоидии (табл. 3). Из 301 женщины без привычного выкидыша с низким риском по данным комбинированного скрининга в 7 наблюдениях установлен высокий риск по данным НИПС.

При анализе результатов в различных подгруппах пациентов с низким риском по результатам программы ASTRАIA отмечено, что у женщин с привычным выкидышем достоверно чаще уровень β-ХГЧ отличается от нормативных значений, что, вероятно, связано с особенностями плацентации у беременных с неоднократными потерями беременности.
Таким образом, с высоким риском ХА по данным НИПС было 18 пациенток, из них по трисомии 21 – 9 случаев, по трисомии 13 – 3, в 6 случаях – по половым хромосомам.
Проанализированы течение и исходы беременностей у женщин исследуемых групп. Установлено, что беременные с привычным выкидышем отличаются большей частотой гестационных осложнений: достоверно чаще по сравнению с группой с неотягощенным анамнезом отмечены угрожающий выкидыш (31,9% по сравнению с 13,6%, p≤0,0001), угроза ранних преждевременных родов (31,9 и 13,6% соответственно, p≤0,0001), образование ретроплацентарных и заоболочечных гематом, кровотечения во втором триместре беременности (22,2 и 7,6%, p≤0,0001), истмико-цервикальная недостаточность (42,6 и 17,9%, p≤0,0001), преждевременные роды (8,1 и 2,4%, p=0,0023). В этой связи проведение инвазивных методов диагностики у беременных с привычным выкидышем должно быть ограничено четкими показаниями.
У 15 женщин были проведены инвазивные диагностические процедуры, анеуплоидии были подтверждены у 12 пациенток, из них 10 прервали беременность по медицинским показаниям, в 2 случаях пациентки отказались от предложенного им прерывания беременности, и родились живые дети с синдромом Дауна и синдромом Шерешевского–Тернера (моносомия по Х хромосоме).
В 3 случаях пациентки отказались от проведения инвазивных процедур; все эти случаи были связаны с моносомией Х, было продолжено наблюдение и проанализированы исходы беременностей. В 2 случаях кариотип подтвердился и в 2 случаях зарегистрирован ложно-положительный результат моносомии Х хромосомы, что было обусловлено плацентарным мозаицизмом [12, 13, 15–25]. Достоверно установлены трисомии по 13-й хромосоме, однако единичные наблюдения относительно данных хромосом не позволяют сделать однозначный вывод о чувствительности и специфичности метода в описанном случае. Показанием для прерывания беременностей по медицинским показаниям послужили анеуплоидии, пороки развития плода, состояние матери. Все случаи множественных пороков развития плода отмечены в группе без привычного выкидыша.
Установлено, что частота анеуплоидий после 12 недель беременности достоверно не отличалась в обеих группах и составила 3,0% в группе привычного выкидыша и 3,0% в группе без отягощенного акушерского анамнеза (табл. 4).
Один мозаичный ложноотрицательный результат НИПС по трисомии 21 был обусловлен мозаицизмом плода. Анализ клеток периферической крови новорожденного с помощью FISH позволил обнаружить 3 разных клона клеток. Помимо нормальных и трисомных клеток отмечено небольшое количество моносомных клеток (рисунок). Повторное исследование в возрасте 2 месяцев жизни ребенка показало, что доля трисомных клеток возросла, а доля моносомных и нормальных клеток стала меньше (табл. 5).
 После рождения все новорожденные оценивались фенотипически, у 547 (91,2%) установлен нормальный фенотип.
После рождения все новорожденные оценивались фенотипически, у 547 (91,2%) установлен нормальный фенотип.
На основании проведенного исследования определены чувствительность, специфичность, положительное и отрицательное прогностические значения метода НИПС для различных ХА. Результаты представлены в табл. 6.
Полученные результаты позволяют рекомендовать НИПС для клинического применения у женщин с привычным выкидышем с учетом существующих ограничений.
Обсуждение
В настоящее время общепринятый комбинированный скрининг беременных на ХА плода позволяет оценить только косвенные маркеры, в связи с чем он имеет недостаточно высокую чувствительность и специфичность [5–7]. Однозначный результат может быть получен только после проведения инвазивной диагностики. Однако после ее проведения возможны осложнения, основным из которых является прерывание беременности с частотой от 0,5 до 2% в общей популяции женщин, при привычном выкидыше частота осложнений выше [9, 26]. У женщин с привычным выкидышем, чья беременность протекает с кровотечениями и признаками угрозы прерывания, решение о проведении инвазивной процедуры должно быть строго аргументированным.
В нашем исследовании проанализированы результаты НИПС в сопоставлении с комбинированным скринингом в группах женщин с привычным выкидышем и без него. Выбор группы с привычным выкидышем обусловлен, с одной стороны, большей частотой акушерских осложнений у данных пациенток, с другой стороны – предположением о распространенности у них ХА. Оказалось, что частота ХА достоверно не отличалась в обеих группах после 12 недель беременности и составила 3,0% в группе с привычным выкидышем и 3,0% в группе без отягощенного акушерского анамнеза. В этой связи становится ясно, что женщины с привычным выкидышем после 12 недель беременности по частоте ХА абсолютно сопоставимы с женщинами без отягощенного анамнеза, и высокая частота гестационных осложнений у них обусловлена плацента-ассоциированными проблемами. Полученные данные диктуют необходимость тщательного обоснования показаний для проведения инвазиной диагностической процедуры у женщин с привычным выкидышем.
Проанализирована частота ложнопозитивных результатов комбинированного скрининга I триместра. Оказалось, что из 53 пациенток с высоким риском ХА по данным программы ASTRAIA лишь у 5 выявлена ХА, следовательно, 48 женщин были бы подвергнуты инвазивной диагностической процедуре при нормальном кариотипе плода. Нами не получено данных о большей частоте ложноположительных результатов комбинированного скрининга у женщин с привычным выкидышем, частота установления высокого индивидуального риска ХА была одинаковой в обеих группах (8,8 и 8,8%).
Интерес представляет анализ случаев низкого риска по результатам комбинированного скрининга I триместра. Среди 547 женщин с установленным низким индивидуальным риском в 13 наблюдениях отмечен высокий риск по НИПС. При общепринятой системе наблюдения вышеуказанные беременные не были бы направлены на инвазивную процедуру, что не дало бы возможности установить правильный диагноз.
Среди женщин низкого риска обращали на себя внимание достоверно более высокие значения β-ХГЧ (P=0,001) у беременных с привычным выкидышем, что свидетельствует не о ХА плода, а о нарушениях процессов плацентации.
Метод НИПС, обладая высокой специфичностью, в то же время имеет определенные ограничения. Так, наличие плацентарного, материнского или плодового мозаицизма искажает результаты высокопроизводительного секвенирования и по объективным причинам возможен неправильный результат скрининга. Ложноотрицательный результат НИПС в проведенном нами исследовании был обусловлен наличием 3 пулов клеток у плода – трисомных, дисомных и моносомных, что в совокупности дало результат, указывающий на низкий риск ХА. Подобные ограничения необходимо учитывать и информировать пациентов при проведении генетического консультирования. В то же время лидеры международных исследовательских коллективов едины во мнении, что возможности, ограничения и преимущества НИПС должны быть разъяснены всем беременным женщинам при консультировании генетиком для предоставления беременной возможности выбора скрининговой программы.
С учетом результатов настоящего исследования можно рекомендовать использование высокопроизводительного секвенирования для неинвазивного скрининга на анеуплоидии 21, 18, 13 и половых хромосом с последующим инвазивным обследованием при выявлении высокого риска.
Метод может быть использован для скрининга и определения риска у всех беременных до постановки окончательного диагноза, как самостоятельный метод, так и в дополнение к существующим методам.
Исследователи полагают, что НИПС со временем может заменить или усовершенствовать существующие скрининговые тесты [12, 19, 27–30]. Подобные выводы были сделаны, основываясь на результатах нескольких проспективных исследований, во всех случаях, подтвержденных классическим кариотипированием [27, 28]. По результатам проведенного нами исследования становится ясным, что у женщин с привычным выкидышем проведение НИПС позволяет снизить уровень тревоги родителей, усовершенствовать тактику ведения осложненной беременности с отказом от ее пролонгирования при выявлении ХА, а главное, избежать необоснованных инвазивных диагностических процедур у женщин с привычным выкидышем, угрожаемых по развитию ятрогенных осложнений при инвазивных вмешательствах.
Заключение
Данное исследование показало, что НИПС является перспективным методом для скрининга ХА плода у женщин с привычным выкидышем, который может быть рекомендован в качестве высокоэффективного пренатального теста.



