В последние годы отмечается рост заболеваемости хроническим эндометритом (ХЭ), частота которого в популяции составляет от 2,6 до 51% [1, 2]. Среди женщин с самопроизвольными выкидышами доля ХЭ составляет 90%, неразвивающейся беременностью – 91,7%, неудачными попытками экстракорпорального оплодотворения (ЭКО) – 83,3% [3], маточной формой бесплодия – 72,5% [4]. Кроме того, ХЭ является одной из основных причин нарушения менструальной функции, гиперпластических процессов эндометрия и сексуальной дисфункции [5, 6]. Все это определяет не только медицинскую, но и социальную значимость заболевания.
В настоящее время в структуре воспалительных заболеваний доля вирусных инфекций составляет 40–60% [4, 7], приводящих к нарушениям противоинфекционной резистентности слизистой оболочки матки и значительному нарушению микробиоценоза с преобладанием условно-патогенной микрофлоры, которая со временем становится ведущей в патогенезе ХЭ [4, 7]. При этом воспаление нередко развивается только локально, вызывая нарушение функции органа, и всегда сопровождается изменениями параметров системного и локального иммунитета [7].
Цель – определить современные особенности этиологии ХЭ и обосновать необходимость комплексного лечения, включающего локальную цитокинотерапию.
Материалы и методы
Обследовано 128 пациенток с ХЭ, подтвержденным морфологически. Критерии включения: возраст 25–35 лет; маточная форма бесплодия или неразвивающаяся беременность, обусловленные ХЭ; овуляторный менструальный цикл; показатели гемостазиограммы в пределах референсных значений. Критерии исключения: другие причины бесплодия (трубно-перитонеальное, эндокринное и т.д.); миома матки, эндометриоз, пороки развития; тяжелые соматические заболевания; резус-отрицательная кровь.
Для верификации диагноза и отбора пациенток в группу исследования использовали клинические, функциональные и лабораторные методы исследования, применяемые в гинекологии по стандартным методикам.
Оценку клинической картины заболевания проводили на основании жалоб и объективного осмотра. Для диагностики ХЭ использовали морфологические критерии – интенсивность воспалительных элементов, наличие плазматических клеток в инфильтрате, фибропластические изменения в строме и склероз стенок спиральных артерий.
Изучалась вирусно-бактериальная обсемененность полости матки в аспиратах эндометрия методом полимеразной цепной реакции (ПЦР) в режиме реального времени и бактериологическим методом.
Уровни субпопуляций лимфоцитов CD16, CD56 (маркеры NK – натуральных киллеров) и HLA-DRII (маркер иммунной стимуляции антигенпрезентирующих клеток) определяли в аспиратах эндометрия иммуногистоцитохимическим методом с применением антигенспецифических моноклональных антител фирмы Novocastra, провоспалительные цитокины фактор некроза опухоли альфа (ФНО-a), интерлейкины 6 и 8 (ИЛ-6, ИЛ-8) и интерферон гамма (ИФН-γ) – методом ELISA. Взятие образцов эндометрия проводили путем аспирационной биопсии с помощью Pipelle de Cornier (Laboratoire C.C.D., Франция) на 22−24-й день цикла по стандартной методике.
Из когорты обследованных пациенток с ХЭ случайным образом было выделено 30 пациенток, среди которых проведено изучение клинического действия локальной цитокинотерапии препаратом Суперлимф. Основанием для выбора препарата явились сведения, полученные из литературных источников, свидетельствующие о его нормализующем действии на уровень цитокинов [8]. Препарат содержит экзогенные цитокины природного происхождения, которые действуют локально в очаге воспаления [8]. При этом происходит изменение собственного цитокинового фона тканей и кислородного метаболизма фагоцитарных клеток. Экспериментальными исследованиями установлено, что локальное использование комплекса цитокинов обеспечивает запуск каскадной активации клеток-эффекторов в патологическом очаге и регуляцию процессов воспаления и регенерации [9]. Также препарат оказывает противовирусное (в отношении вирусов простого герпеса, ВПГ) и антимикробное действие (хламидийные и микоплазменные инфекции) [10, 11]. Препарат Суперлимф использовали в соответствии с действующей инструкцией по применению по 25 ЕД вагинально 1 раз в день, на курс – 10 суппозиториев. В комплексе по показаниям применяли антибактериальную терапию (выбор препарата осуществлялся в зависимости от выявленных возбудителей). После лечения проводили повторное исследование иммунного статуса по тем же показателям (забор материала проводили в цикле, следующем после окончания лечения).
Контроль лабораторных показателей выполнялся в группе, состоящей из 25 человек без ХЭ.
Исследование проводилось на основании добровольного информированного согласия и в соответствии с положениями 18-й Всемирной медицинской ассамблеи (Хельсинки, 1964) и рекомендациями ICH. Протокол исследования одобрен этическим комитетом.
Статистическая обработка результатов проведена при помощи пакета прикладных программ Statistiсa. При анализе количественных признаков проводилась проверка на нормальность распределения. Количественные показатели представлены в виде М(SD), где М – среднее значение, SD – стандартное отклонение. При оценке качественных показателей вычислялись фактические частоты наблюдений и их доли (n, %). Статистическая разница между двумя средними количественными показателями оценивалась по критерию Манна–Уитни, качественных – по критерию χ2 Фишера. За статистически значимые принимались различия при величине p≤0,05.
Результаты
Средний возраст обследованных пациенток составил 31,9 (5,0) лет; в контроле – 30,1 (4,8), р=0,199. Общая клиническая характеристика обследованных пациенток представлена в табл. 1.
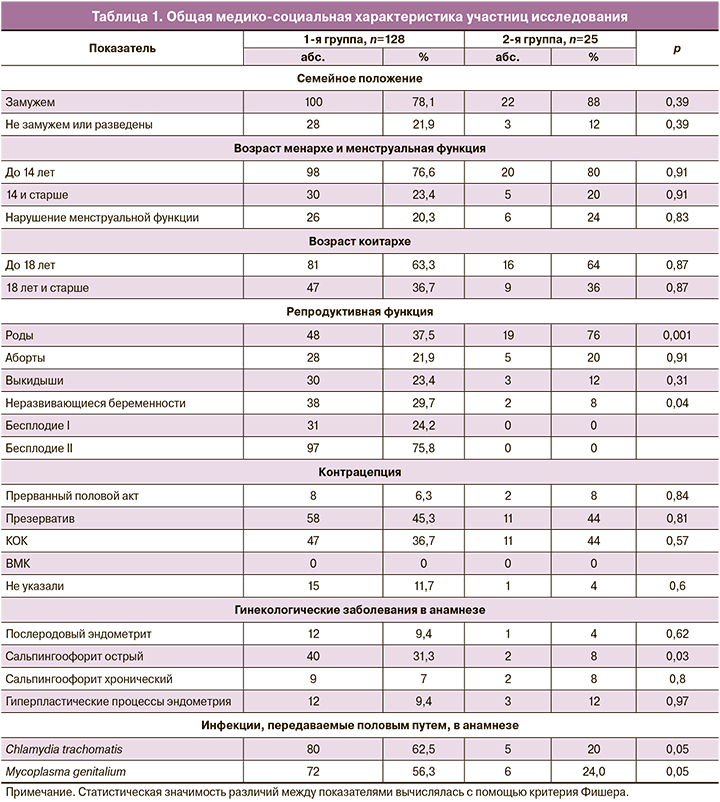
Статистически значимой разницы между группами по социальным характеристикам не выявлено. Средняя продолжительность ХЭ с момента установления диагноза составила 3,6 (0,07) лет, более 5 лет – у 76,6% (98/128) пациенток. Бесплодие более 3 лет наблюдалось у всех пациенток.
При анализе табл. 1 обращает на себя внимание высокая частота инфекций, передаваемых половым путем (ИППП), и острых воспалительных заболеваний органов малого таза в анамнезе, меньшая частота беременностей, реализованных родами, и, наоборот, большее количество эпизодов невынашивания беременностей по сравнению с группой контроля.
Результаты исследования методом ПЦР представлены в табл. 2.
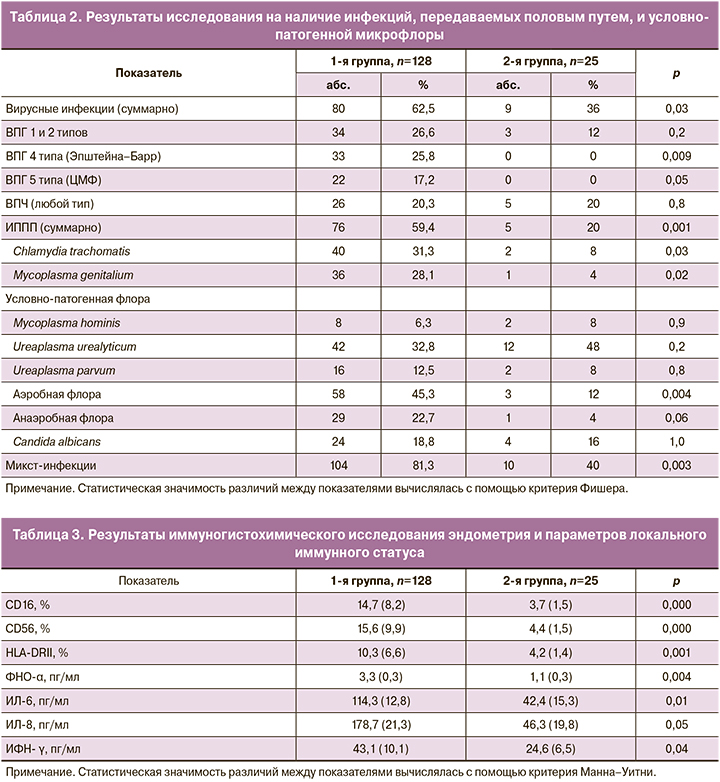
Обращает на себя внимание, что у 62,5% (80/128) женщин с ХЭ выявлены вирусы, что было в 2 раза выше по сравнению с пациентками контрольной группы, при этом сочетание нескольких видов вирусов наблюдалось у каждой второй (56,3%, 45/80) пациентки. Сочетание вирусов, ИППП и/или условно-патогенной микрофлоры (микст-инфекции) наблюдалось у 81,3 против 40% пациенток соответственно.
Бактериологическое исследование аспиратов из полости матки свидетельствовало о наличии стерильных посевов у 60,9 (78/128) и 96% (24/25) пациенток в 1-й и 2-й группах соответственно. Наличие условно-патогенной микрофлоры менее 104 выявлено у 9,4 (12/128) и 4% (1/25) соответственно и более 104 – у 29,7% (38/128) только в 1-й группе.
Результаты иммуногистохимического исследования эндометрия и параметров локального иммунного статуса представлены в табл. 3.
Иммуногистохимические признаки ХЭ с аутоиммунным компонентом в стадии обострения имели место в 96 случаях (75%). У остальных пациенток была зарегистрирована высокая экспрессия в эндометрии CD16 на фоне малого количества CD56 и HLA-DRII-позитивных клеток, что свидетельствовало о ремиссии ХЭ без аутоиммунного компонента (р<0,001).
При этом выявлено повышение уровней провоспалительных факторов ФНО-α в 3 раза, ИЛ-6 – в 2,7, ИЛ-8 – в 1,2, ИФН- γ – в 1,4 раза по сравнению с группой контроля. Низкая экспрессия маркеров воспаления в контрольных образцах эндометрия подтверждала отсутствие ХЭ.
Таким образом, выявленная нами особенность этиологии ХЭ, а именно – высокая обсемененность вирусами и бактериями, свидетельствует о смешанном генезе инфекционного поражения ткани эндометрия. При этом в развитии ХЭ существенную роль играют нарушения местной иммунной защиты и активация иммунопатологических процессов, обусловленных повышенным синтезом провоспалительных цитокинов. Дисбаланс факторов местного иммунитета может лежать в основе низкой эффективности традиционных методов терапии ХЭ, что обусловливает актуальность поиска новых средств и методов для коррекции цитокинового статуса.
 Результаты лечения 30 пациенток препаратом Суперлимф продемонстрировали статистически значимое снижение уровней провоспалительных цитокинов (рисунок). Содержание ФНО-α также уменьшилось – с 3,6 (0,2) до 1,9 (0,3) пг/мл, р=0,005.
Результаты лечения 30 пациенток препаратом Суперлимф продемонстрировали статистически значимое снижение уровней провоспалительных цитокинов (рисунок). Содержание ФНО-α также уменьшилось – с 3,6 (0,2) до 1,9 (0,3) пг/мл, р=0,005.
После проведения комплексной терапии с использованием антибактериальных средств и препарата Суперлимф на данный момент беременность закончилась срочными родами у 6 пациенток, разные сроки прогрессирующей беременности имеют 9 женщин, остальные – находятся в процессе катамнестического наблюдения.
Обсуждение
Результаты, полученные в настоящем исследовании, показали высокую обсемененность эндометрия вирусами герпеса и ВПЧ различных типов (суммарно – у 62,5% пациенток) в сочетании с разнообразной микробной флорой, включая ИППП, при этом общая доля микст-инфекций составила 81,3%, что было в 2 раза выше, чем среди пациенток контрольной группы. На эту особенность указывают и другие авторы в последние годы [8, 12, 13], что, по-видимому, является современной особенностью этиологии этого заболевания. Кроме того, обращает на себя внимание повышение роли вирусов Эпштейна–Барр – в настоящем исследовании его доля составила 25,8%, а в исследовании Ю.Э. Доброхотовой и соавт. – 55,8% [8].
Известно, что инфекты выступают источником постоянного антигенного раздражения, пусковым и поддерживающим воспалительную реакцию механизмом на фоне недостаточности факторов местной противоинфекционной защиты. Общность антигенов персистирующих микроорганизмов и тканевых антигенов организма хозяина является основой феномена аутоиммунных реакций и вторичного иммунодефицита. Особую роль в поддержании иммунодефицитного состояния отводят хронической вирусной инфекции генитального тракта [14], что совпадает с результатами нашего исследования. Так, за аутоиммунный процесс при ХЭ в настоящем исследовании свидетельствовало выявление у большинства пациенток на фоне ХЭ иммуногистохимических маркеров воспаления CD16, CD56 и HLA-DRII, уровень которых превышал верхнее пороговое значение в 75% наблюдений. Схожие данные по фенотипическому составу лимфоцитов в эндометрии у пациенток с ХЭ представлены в работе Е.А. Михниной [15].
Активация иммунопатологических процессов, в свою очередь, приводит к повышенному синтезу провоспалительных цитокинов [16], что также совпадает с результатами в исследуемой нами когорте пациенток – выявлено повышение уровней провоспалительных факторов ФНО-α в 3 раза, ИЛ-6 – в 2,7, ИЛ-8 – в 1,2, ИФН- γ – в 1,4 раза по сравнению с группой контроля. И.А. Новикова и соавт. определили, что у пациенток с герпетической инфекцией в период ремиссии наблюдается диспропорция в цитокиновом спектре с преобладанием синтеза ИФН-γ и IL-8 над производством ИЛ-10, а ИЛ-4 и ИЛ-13 – над продукцией ИЛ-1β [16]. Анализ профиля экспрессии генов ростовых факторов и цитокинов в эндометрии в период «имплантационного окна» при ХЭ у пациенток с бесплодием показал их значимое снижение [17].
Эти нарушения служат препятствием для создания в предимплантационный период локальной иммуносупрессии, которая необходима для формирования защитного барьера, что является условием успешной имплантации и предотвращения выкидыша [12, 18]. Избыточное количество провоспалительных цитокинов ведет к активации протромбиназы, обусловливая тромбозы, инфаркты трофобласта и его отслойку и, в конечном итоге, – прерывание беременности в I триместре. При сохранении беременности в дальнейшем формируется первичная плацентарная недостаточность [19].
Длительность течения ХЭ является основным фактором, определяющим глубину и распространенность повреждения структур эндометрия. А.И. Ищенко и соавт. установлена прямая умеренная корреляционная зависимость между длительностью течения ХЭ и частотой развития бесплодия на его фоне (r=0,53, р<0,001) в когорте пациенток, у которых продолжительность бесплодия в среднем составляла более 5 лет, у 82,8% из числа обследованных при продолжительности ХЭ 5,5±0,06 года [20]. Эти результаты схожи с полученными нами сведениями из анамнеза обследованных пациенток – 76,6% из них страдали ХЭ более 5 лет.
Сохранение имплантационной способности эндометрия на начальных этапах течения ХЭ обусловлено функционированием компенсаторного механизма, определяемого соотношением патогенных свойств персистирующего в полости матки инфекционного агента и состоянием иммунной системы женщины. При наличии инфекционных агентов в полости матки при ХЭ, по мнению многих исследователей, целесообразно назначение антибактериальных препаратов с учетом выявленного возбудителя в комплексе с нестероидными противовоспалительными препаратами, при этом морфологическая эффективность, по данным Н.А. Гомболевской и соавт., составляет 68,4%, однако репродуктивная функция реализуется лишь в 42,1% [21]. Постепенное истощение описанного выше компенсаторного механизма и присоединение аутоиммунного процесса приводит к критичному нарушению рецептивности эндометрия с последующим бесплодием [20]. В связи с этим положительные результаты лечения пациенток с ХЭ могут быть связаны не только с элиминацией возбудителя (что не всегда дает ожидаемый эффект), но и с восстановлением иммунной реактивности, в частности, с содержанием и функциями цитокинов [4, 5, 8, 9, 12].
Обсуждая механизмы влияния дисбаланса цитокинов на течение ХЭ и реализацию репродуктивной функции, отметим, что цитокины – пептидные информационные молекулы, с помощью которых от клетки к клетке передается сигнал, запускающий определенные реакции. Их основными продуцентами являются лимфоциты (Т и В), а также макрофаги, гранулоциты, ретикулярные фибробласты, дендритные, эндотелиальные и эпителиальные клетки. Все цитокины, а их в настоящее время известно более 30, по структурным особенностям и биологическому действию делятся на несколько самостоятельных групп. К ним относятся провоспалительные цитокины, обеспечивающие мобилизацию воспалительного ответа (ИЛ-1, -2, -6, 8, ФНО-α, ИФН-γ); противовоспалительные, ограничивающие развитие воспаления (ИЛ-4, -10, трансформирующий ростовой фактор бета – TGF-β) и регуляторы клеточного и гуморального иммунитета (врожденного или специфического), обладающие собственными эффекторными функциями (противовирусными, антибактериальными, цитотоксическими) [22].
В настоящее время большинство препаратов, применяемых с иммуномодулирующей целью, содержат интерфероны (в основном ИФН-ɑ), которые индуцируют либо активируют определенные клеточные белки, блокирующие репликацию вируса и оказывают опосредованное действие, вызывая синтез эндогенных цитокинов Т-хелперами. В отличие от этой группы иммуномодуляторов, в состав препарата Суперлимф входят природные цитокины, что является его преимуществом. Он содержит в необходимой концентрации ИЛ-1 и фактор торможения миграции макрофагов МИФ, ИЛ-6 и ФНО-α, TGF-β и ряд минорных примесей цитокинов, хемокинов и антимикробных пептидов.
Препарат обладает широким спектром активности по отношению к клеткам, участвующим в реакциях врожденного иммунитета, — макрофагам, нейтрофилам, естественным клеткам-киллерам. Он активирует фагоцитоз, выработку ряда цитокинов моноцитами, вызывает гибель внутриклеточных вирусов и бактерий, регулирует процесс миграции лейкоцитов [10].
Нами, а также некоторыми другими авторами показано, что при ХЭ происходит нарушение баланса между про- и противовоспалительными цитокинами с преобладанием последних. Дополнительное назначение препарата, модулирующего активность цитокинов, повышает собственную резистентность организма и позволяет улучшить результаты лечения при хроническом воспалении [23–25].
Некоторыми авторами было показано, что на фоне локальной цитокинотерапии происходит снижение вирусной нагрузки в 1,2 и 1,8 раза для ВПЧ различных групп и 2-кратное увеличение экспрессии ФНО-a. Изменение вирусной нагрузки на фоне лечения препаратом Суперлимф коррелировало с активацией показателей врожденного иммунитета как в слизистой цервикального канала, так и во влагалище за счет экспрессии генов толл-подобных рецепторов TLR2, TLR9 и эффекторных молекул бета дефенсина HBD-1 [26]. Отсутствие выделения ВПГ и ВПЧ через 2 месяца проведенной терапии препаратом Суперлимф у пациентов с инфекциями нижних отделов половых путей отмечено в 93,4 и 100% наблюдений соответственно, что объясняется не только опосредованным через активацию цитотоксических клеток-эффекторов (макрофаги, естественные киллеры и т.д.), но и прямым ингибирующим действием препарата на репликацию вирусов [10, 26].
Ю.Э. Доброхотовой и соавт. [23] было показано, что после курса лечения данным препаратом произошла нормализация уровней провоспалительных цитокинов у пациенток с неразвивающейся беременностью в анамнезе, и авторы пришли к выводу о целесообразности его применения у пациенток с ХЭ, что совпадает с результатами нашего исследования. Теми же авторами показано двукратное уменьшение частоты верификации ХЭ, по данным иммуногистохимического исследования, и наступление беременностей в течение первого месяца после лечения у 11,6% пациенток со средней длительностью бесплодия 5,7 года [8].
Заключение
Данные, полученные в настоящем исследовании, свидетельствуют о высокой частоте вирусных и бактериальных инфекций у женщин с ХЭ и изменении состояния местного иммунитета со сдвигом в сторону преобладания провоспалительных цитокинов. Дополнительное назначение препарата, модулирующего активность цитокинов на локальном уровне (Суперлимф), позволяет снизить проявления местного воспалительного процесса в эндометрии и его аутоиммунного компонента.



