В последнее время все больший научный интерес представляет изучение генетических механизмов развития различных заболеваний. Предполагается, что исследования в данной сфере помогут разработать и внедрить в область практического здравоохранения либо современные лекарственные препараты, либо инновационные диагностические подходы, способные ускорить диагностический поиск и максимально быстро начать проведение таргетной терапии.
К числу тяжелых заболеваний периода новорожденности, чреватых развитием серьезных осложнений, относится некротизирующий энтероколит (НЭК), который представляет собой воспаление кишечной стенки с последующим ее некрозом [1]. Наиболее часто заболевание встречается у новорожденных, находящихся в критическом состоянии, и/или у недоношенных детей. НЭК характеризуется чрезмерным воспалением кишечника, вызывающим повреждение слизистой оболочки различной степени тяжести и распространения. К основным состояниям, способствующим развитию НЭК у новорожденных, относятся: недоношенность, искусственное вскармливание, асфиксия при рождении, операция заменного переливания крови.
Хотя факторы риска развития НЭК у новорожденных на сегодняшний день хорошо известны, точная причина заболевания все еще недостаточно ясна. Ранее было показано, что в развитии НЭК играет роль именно совокупность различных патологических механизмов. Рассматривается сложное взаимодействие иммунной системы, кишечного эпителия, бактерий-комменсалов и сигнальных молекул.
Несмотря на значительные достижения в области неонатальной интенсивной терапии и хирургии, смертность новорожденных с НЭК существенно не изменилась за последние десятилетия и составляет от 20 до 30% [2]. Также НЭК остается одной из основных причин инвалидизации недоношенных детей. К сожалению, хирургическое лечение не во всех случаях улучшает прогноз заболевания, поскольку воспаление в кишечнике, как в органе с большой площадью поверхности, обширной васкуляризацией и высокой степенью концентрации иммунных клеток, может способствовать не только перфорации кишечной стенки, но и развитию системных эффектов заболевания, оказывающих влияние на другие ткани и органы [3]. Согласно недавним исследованиям, более 50% недоношенных детей с НЭК имеют задержку развития нервной системы [3].
В экспериментальных моделях НЭК ассоциируется с серьезными морфологическими изменениями мозга: провоспалительные реакции в головном мозге изменяют гомеостаз и плотность популяций клеток мозга. G. Biouss et al. показали, что выраженность воспалительных реакций в головном мозге коррелирует с тяжестью НЭК [4].
Начальные клинические проявления НЭК неспецифичны, в особенности у младенцев с очень и экстремально низкой массой тела при рождении, что затрудняет диагностику и своевременное начало лечения.
В настоящее время основной задачей неонатологов является разработка диагностического комплекса, позволяющего прогнозировать НЭК, выявлять его ранние стадии, проводить дифференциальную диагностику с другими заболеваниями периода новорожденности и, соответственно, максимально быстро начинать этиопатогенетическую терапию. Подобный подход должен дать возможность снизить частоту и в ряде случаев избежать развития инвалидизирующих осложнений у новорожденных, в том числе у недоношенных детей.
Анализ экспрессии генов, участвующих в иммунном ответе, в настоящее время считается одним из многообещающих инструментов для идентификации биомаркеров НЭК. В ходе проведенного многоцентрового исследования Tremblay et al. обнаружили, что в развитии НЭК участвует значительное количество дифференциально экспрессируемых генов [5]. Экспериментальное исследование Yin et al. обнаружило, что экспрессия мРНК TLR4 и NF-κB в образцах кишечника мышей с НЭК была значительно выше, чем у контрольной группы без признаков заболевания [6].
В настоящее время также существуют данные, свидетельствующие о том, что измерение экспрессии активированных TLR4 также репрезентативно в образцах крови, взятых у новорожденных с ранним началом сепсиса [7]. Учитывая тот факт, что измененный иммунный ответ новорожденных является одним из основных патогенетических путей развития НЭК и имеет системные эффекты, мы предположили, что определение мРНК можно проводить в образцах крови и буккальных соскобах (БС). Получение образцов биоматериала из этих локусов во время первого обследования новорожденных после рождения можно рассматривать как наименее инвазивный метод определения биомаркеров НЭК.
В ходе данного исследования нами была оценена взаимосвязь между уровнем экспрессии в клетках буккального эпителия и в крови генов, участвующих в иммунном ответе, и развитием НЭК у новорожденных, находящихся в критическом состоянии, с целью выявления молекулярно-генетических предикторов НЭК у недоношенных детей различного гестационного возраста.
Материалы и методы
В исследование были включены 590 новорожденных детей различного гестационного возраста (ГВ) (24–41 неделя), родившихся в «НМИЦ АГП им. В.И. Кулакова» Минздрава России в период с января 2015 по декабрь 2017 г. 130 новорожденных родились глубоконедоношенными на сроках 24–32 недели гестации. После первичной стабилизации состояния в родильном зале все дети были госпитализированы для обследования и лечения в отделение реанимации и интенсивной терапии (ОРИТН).
Критериями исключения из исследования стало наличие множественных врожденных пороков, несовместимых с жизнью или требующих экстренной хирургической коррекции, и хромосомных аномалий у детей.
Родителями новорожденных было подписано добровольное информированное согласие на участие детей в исследовании. Данное исследование было одобрено этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Антропометрические данные недоношенных новорожденных оценивались с помощью центильных таблиц Т. Фэнтон [8]. Оценка массы тела при рождении менее 10-го перцентиля свидетельствовала о задержке внутриутробного развития.
При постановке диагноза НЭК использовалась классификация по стадиям течения, предложенная Bell et al. (1978) в модификации Walsh and Kliegman (1987) [1].
 Дизайн исследования приведен на рисунке 1.
Дизайн исследования приведен на рисунке 1.
Всем новорожденным с целью выявления/исключения реализации врожденной инфекции проводилось стандартное клинико-лабораторное обследование, включавшее в себя рентгенографию органов грудной полости, анализ гемокультуры, клинический анализ крови с подсчетом абсолютного числа лейкоцитов, тромбоцитов, нейтрофилов и вычисление нейтрофильного индекса, контроль уровня белков острой фазы воспаления (С-реактивный белок). По результатам проведенного клинико-лабораторного и инструментального обследования в возрасте 72 ч жизни ребенка делалось заключение о наличии или отсутствии врожденной инфекции.
Диагноз «ранний неонатальный сепсис» устанавливался на основании выявления у ребенка очага инфекции либо положительной гемокультуры, наличия признаков синдрома системного воспалительного ответа, как минимум один из которых являлся гематологическим, а также симптомов полиорганной недостаточности [9, 10]. Дифференциальный диагноз между врожденной пневмонией, ранним неонатальным сепсисом, респираторным дистресс-синдромом и транзиторным тахипноэ новорожденных проводился в соответствии с клиническими рекомендациями [11, 12].
Всем новорожденным детям, вошедшим в данную работу, для исследования использовали венозную кровь (ВК) и БС, полученные в течение первых суток после рождения.
Сбор биологического материала осуществлялся у новорожденных в первые часы жизни, сразу после поступления в ОРИТН, одновременно с проведением обязательного клинико-лабораторного обследования, до начала медикаментозной терапии и энтерального кормления. Клетки БС получали путем взятия соскоба из защечной области в пробирки с раствором для стабилизации мРНК (лизирующий раствор набора «Проба НК» («ДНК-Технология», Россия)). Кровь для исследования забиралась в пробирку с антикоагулянтом (ЭДТА). Во избежание деградации мРНК пробирки с кровью немедленно транспортировали в отделение биобанка, где производилось ее аликвотирование (по 100 мкл) в лизирующий раствор набора «Проба НК» («ДНК-Технология», Россия) для стабилизации мРНК. До момента исследования все образцы хранились при -80°С. После завершения курса лечения всех детей, включенных в исследование, биоматериал поступал в работу. Выделение РНК проводили с помощью набора «Проба НК» («ДНК-Технология», Россия) с фенольной депротеинизацией. Объем образцов после выделения составил 50 мкл. Реакцию обратной транскрипции ставили в объеме 40 мкл (в реакцию брали 33 мкл раствора выделенной РНК). В качестве праймеров для обратной транскрипции использовали специфические олигонуклеотиды. Реакцию проводили при температуре 40°С в течение 30 минут, с последующей инактивацией обратной транскриптазы при 95°С в течение 5 минут.
Проводили измерение уровней экспрессии следующих генов, ответственных за продукцию: цитокинов (IL1b, IL6, IL8, IL10, IL12а, IL15, IL18, TNFa, TGFb1), транскрипционных факторов (TBX21, GATA3, RORC2), поверхностных клеточных структур (CD45, CD68, CD69), TLR2, TLR4, TLR9, матриксной металлопротеиназы (MMP8). В работе использовались коммерческие реактивы («ДНК-Технология», Россия). Производитель гарантировал отсутствие амплификации на матрице геномной ДНК исследуемых и референсных генов. Это позволило не использовать дополнительный этап обработки нуклеиновых кислот ДНК-азой. Амплификацию осуществляли в режиме реального времени на приборе «ДТ-384» в объеме 12,5 мкл по следующей программе: 1 цикл – 80°С 30 с, 94°С 1 мин 30 с; 50 циклов – 94°С 20 с, 62°С 20 с; 10°С – хранение 94°С. Измерение уровня флуоресценции проводили на каждом цикле при температуре 62°С по каналу FAM. Реакцию ставили в двух повторах для каждой точки. Нормировка проводилась по четырем референсным генам HPRT1, TBP, B2M, GUSB. Использован метод сравнения индикаторных циклов (метод Δ∆Cр). Уровень экспрессии выражали в относительных единицах как отношение количества мРНК анализируемого гена к среднему геометрическому количества мРНК референсных генов.
Статистический анализ
Статистическую обработку выполняли с использованием пакета компьютерных программ IBM SPSS Statistics version 23 (США). Проверку нормальности распределения оценивали с помощью критерия Колмогорова–Смирнова с поправкой Лиллиефорса, Шапиро–Уилка, а также показателей эксцесса и асимметрии.
Во всех подгруппах отмечалось распределение, отличное от нормального, для выявления статистической значимости различий использовали непараметрический U-критерий Манна–Уитни. Результаты представлены как медиана (Ме) и интерквартильный размах, 25–75-й процентили (Q1–Q3). Принимая во внимание специфику групп пациентов (новорожденные дети в ОРИТН), в частности, значительные отличия массо-ростовых показателей, а также практическую направленность исследования, с целью более детальной клинической характеристики групп мы приводим минимальное (min) и максимальное (max) значения для каждого признака [min–max]. Различия считали статистически значимыми при уровне значимости p<0,05. Для оценки корреляционных взаимосвязей использовали коэффициент корреляции Спирмена. При анализе номинальных переменных (частоты) применялись критерий χ2 Пирсона с поправкой Йетса и точный критерий Фишера при малом количестве наблюдений. Оценка качества диагностической модели проводилась с помощью ROC-анализа (Receiver Operating Characteristic) по площади под характеристической кривой в координатах Se и 1–Sp. Значение площади приведено с 95% доверительным интервалом (ДИ). При расчете операционных характеристик пороговый уровень выбирали исходя из требования максимальной суммарной чувствительности и специфичности. 95% ДИ для операционных характеристик рассчитывали на основании распределения χ2.
Результаты
За период исследования развитие НЭК различной степени тяжести было зарегистрировано у 25 из 590 новорожденных различного ГВ (4,2%). После завершения клинической части исследования и технической оценки биоматериала из исследования были исключены образцы 172 детей, в том числе 7 детей, течение неонатального периода которых было осложнено развитием НЭК. Из 418 новорожденных НЭК был диагностирован у 18 детей, 16 из которых родились ранее 33 недели беременности. В связи с этим с целью исключения «загрязняющих» статистических факторов (конфаундеров) сравнительному анализу подверглись биологические образцы только 130 недоношенных детей, родившихся на 24–32-й неделях беременности.
ГВ новорожденных с НЭК составлял от 26 до 31 недель (Ме=29 недель, Q1–Q3: 26,5–30), а масса тела – от 485 г до 1230 г (Me=900 г, Q1–Q3: 760–987).
Проведено сравнение уровня экспрессии генов иммунного ответа в клетках биологических образцов 16 глубоконедоношенных детей, течение неонатального периода которых было осложнено развитием НЭК (основная группа), с аналогичными показателями 114 глубоконедоношенных детей, у которых в течение неонатального периода не было выявлено развития НЭК (контрольная группа). Дети основной и контрольной групп были сопоставимы по ГВ, оценке по шкале Апгар на 1-й минуте, частоте проведения антенатальной стероидной профилактики и рождения путем операции кесарева сечения.
Среди пациентов с НЭК отмечалась более высокая частота синдрома задержки внутриутробного развития (9/16, 56%), чем в контрольной группе (34/114, 29%), также отмечалась более низкая оценка по шкале Апгар на 5-й минуте жизни [4–8] баллов (Me=7; Q1–Q3: 5,5–7) по сравнению с [4–9] баллами (Me=7; Q1–Q3: 7–7) в контрольной группе (р=0,02).
Течение НЭК I стадии отмечено у 1 пациента из 16 (6,3%), IIa – у 11 (69%), IIб – у 3 (18,8%) новорожденных. НЭК III развился у 1 ребенка, которому было проведено хирургическое вмешательство (6,3%).
Все новорожденные основной группы (16/16), развившие НЭК, наблюдались с основным диагнозом инфекционного генеза (ранний неонатальный сепсис (n=5), врожденная пневмония (n=11)), что отличалось от доли врожденной инфекции в контрольной группе – 102/114 (ранний неонатальный сепсис (n=14), врожденная пневмония (n=88)), однако разница не достигла статистической значимости (р=0,37).
Летальный исход наступил у 2 новорожденных основной группы с развившимся НЭК (первый случай – вследствие полиорганной недостаточности и ДВС-синдрома у новорожденного ГВ 26 недель с течением раннего неонатального сепсиса, второй случай – в результате полиорганной недостаточности и ДВС-синдрома у ребенка с задержкой внутриутробного развития ГВ 26 недель с течением врожденной пневмонии). Клиническая характеристика пациентов приведена в таблице.
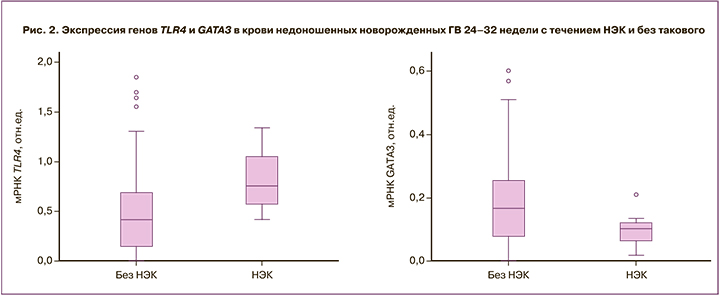
При сравнении профиля экспрессии исследованных генов в клетках крови у недоношенных новорожденных, родившихся на 24–32-й неделях гестации, выявлено статистически значимое повышение экспрессии TLR4 у новорожденных из группы НЭК: 0,8 (Q1–Q3: 0,6–1,0) против 0,4 (Q1–Q3: 0,1–0,7), р=0,012 и тенденция к снижению GATA3: 0,10 (Q1–Q3: 0,70–0,12) против 0,17 (Q1–Q3: 0,08–0,26), р=0,08 по сравнению с группой детей аналогичного ГВ без признаков НЭК (рис. 2). Уровни экспрессии других генов статистически значимо не различались между группами. При исследовании экспрессии соответствующих генов, участвующих в иммунном ответе, в буккальном эпителии недоношенных новорожденных статистически значимых различий между группами получено не было.
Учитывая разнонаправленность изменений экспрессии TLR4 и GATA3 в клетках крови в качестве диагностического критерия был проанализирован десятичный логарифм соотношения уровней экспрессии указанных генов. На практике использование соотношения уровней экспрессии ключевых генов позволяет отказаться от использования референсных генов. Проведенный ROC-анализ показал, что логарифм (TLR4/GATA3) обладает хорошей диагностической ценностью: площадь под ROC-кривой составила 0,78; (95% ДИ 0,64–0,91; р=0,011). При пороговом значении 0,74 чувствительность модели составила 88% (47–100), а специфичность – 77% (63–88); прогностическая ценность положительного результата – 39% (95% ДИ 17–64), прогностическая ценность отрицательного результата – 97% (95% ДИ 86–100).
Обсуждение
Толл-подобные рецепторы (toll-like-receptors, TLR) играют первостепенную роль в иммунной защите организма. TLR участвуют в индукции и модуляции реакций врожденного и адаптивного иммунитета, выступая в роли их интеграторов [13]. Данные белки присутствуют на поверхности различных клеток и способны распознавать стандартные молекулярные структуры (паттерны), специфичные для различных групп патогенов. По сравнению с системой адаптивного (приобретенного) иммунитета такие рецепторы и связанные с ними механизмы иммунной защиты являются эволюционно более древними.
В неактивном состоянии TLR находятся в мембране в мономерном состоянии. Активация TLR происходит при связывании лигандов, которыми для них являются определенные структуры бактерий, вирусов и грибов [14]. У человека первым был открыт TLR4, всего на сегодня описано 13 TLR, каждый из которых связывается со своим молекулярным паттерном. TLR4 избирательно реагирует на липополисахариды (LPS), которые являются частью клеточной стенки грамотрицательных бактерий, липоолигосахариды, а также бактериальный эндотоксин [15]. Кроме того, TLR4 распознает широкий спектр белков вирусов, грибов и микоплазм. TLR4 может активироваться и эндогенными факторами, называемыми DAMP (danger associated molecular patterns – молекулярные структуры, связанные с повреждением). Типичными DAMP, действующими в качестве агонистов TLR4, являются такие компоненты внеклеточного матрикса, как фибронектин (точнее, его внеклеточный домен), гиалуроновая кислота или гепарансульфат, олигосахариды гиалуроновой кислоты и β-дефензин, белок 1-q группы высокой подвижности (HMGB1), белки теплового шока (Hsp), сульфат гепарина, вещество P, высвобождающиеся при повреждении клетки и воспалении также активируют TLR4 и TLR2. Однако эти эндогенные лиганды TLR4 активируют иммунные клетки только в высоких концентрациях, в отличие от LPS, которые запускают иммунные реакции даже в низких концентрациях [14].
Активация TLR приводит к запуску внутриклеточного сигнального пути NF-κB (нуклеарный фактор каппа B) – белкового комплекса, а NF-κB, в свою очередь, играет ключевую роль в развитии иммунного ответа на инфекцию, регулируя транскрипцию ДНК, продукцию провоспалительных цитокинов и выживаемость клеток [16, 17].
TLR4, как и TLR2, играет активную роль в инициировании воспалительного ответа, а также апоптоза клеток [18]. Более того, TLR4 единственный из экспрессируемых на клеточной поверхности членов семейства TLR способен индуцировать продукцию IFNα.
В настоящее время установлена роль TLR в развитии акушерской патологии. Клинические исследования, проведенные у беременных и рожениц, подтверждают ключевую роль TLR в развитии преждевременных родов инфекционного генеза. Было показано, что экспрессия TLR2 и TLR4 в децидуальной оболочке и плаценте увеличивается при преждевременных родах, ассоциированных с развитием хориоамнионита. Было предложено использовать определение экспрессии TLR2 в качестве маркера преждевременных родов у пациенток с внутриутробной инфекцией и у беременных с высоким риском реализации внутриутробной инфекции [19]. Кроме того, было показано, что к прерыванию беременности в I триместре может привести апоптоз клеток трофобласта, вызванный активацией TLR4 при связывании его с белком теплового шока хламидий Hsp [20, 21].
Была изучена также роль TLR в патогенезе патологии новорожденных. В экспериментах на мышах было показано, что повреждения белого вещества головного мозга недоношенных мышат могут быть связаны с активацией TLR4 у плода. Было выявлено, что низкие дозы LPS, не вызывающие тяжелых осложнений беременности, тем не менее, способны значительно усиливать повреждения головного мозга плода гипоксического генеза на модели новорожденных мышей [22].
Вместе с тем результаты исследований, посвященных экспрессии TLR у новорожденных с течением септического процесса, достаточно противоречивы. В исследовании Redondo было показано, что экспрессия TLR4 на моноцитах периферической крови повышается у новорожденных с реализацией позднего неонатального сепсиса [23], однако у данного исследования есть ограничения – в него были включены только доношенные дети (n=27), общий объем выборки сравнительно небольшой, а группа сравнения была представлена здоровыми взрослыми. В работе Silveira-Lessa исследовалась экспрессия TLR и цитокинов у 44 новорожденных разного ГВ как с ранним, так и с поздним неонатальным сепсисом. Исследование производилось в образцах пуповинной крови – у пациентов с ранним неонатальным сепсисом и в периферической – у новорожденных с поздним неонатальным сепсисом. Сравнение показателей проводилось с таковыми у взрослых и между группами новорожденных. Различий экспрессии TLR4 на моноцитах у пациентов исследуемых групп выявлено не было [7]. Очевидно, что малочисленность и разнородность групп не позволяют с уверенностью экстраполировать полученные данные на всю популяцию.
Исследован механизм участия TLR4 в развитии НЭК у новорожденных [24]. Активация TLR4 приводит к повреждению слизистой оболочки и уменьшению темпов и способности к восстановлению эпителия стенки кишки. Интересным является тот факт, что уровень и функция TLR4 в слизистой оболочке кишечника повышены у недоношенных по сравнению с доношенными детьми [25]. TLR4 играет важную роль в регуляции нормального развития кишечника в утробе матери. Вследствие колонизации многочисленными грамотрицательными бактериями у недоношенных возникает чрезмерная стимуляция передачи сигналов от TLR4, что вызывает высвобождение провоспалительных цитокинов, повышенный апоптоз энтероцитов и нарушение заживления слизистой оболочки. Кроме того, бактериальная транслокация через слизистую оболочку кишечника активирует TLR4 на эндотелии кишечной сосудистой стенки, что приводит к снижению кровотока и развитию кишечной ишемии и некроза [26]. Исследование Hui et al. продемонстрировало увеличение уровней провоспалительных цитокинов и усиление экспрессии TLR4 в резецированных образцах кишечника у недоношенных детей, родившихся на 28–29 неделях гестации, с НЭК [27].
В настоящее время в неонатологии все более и более возрастает интерес к неинвазивным методам диагностики инфекционно-воспалительных заболеваний (в слюне или клетках буккального эпителия), позволяющим избежать стресса, боли и анемизации пациентов, вызванной флеботомическими потерями. Недавние исследования показали, что слюна может служить не менее информативным субстратом для обнаружения цитокинов, чем кровь [28, 29]. Опубликованные данные об исследовании экспрессии TLR в слюне у новорожденных первых суток жизни отсутствуют.
В результате данного исследования было установлено, что определение экспрессии гена TLR4 в БС недоношенных новорожденных с течением НЭК менее информативно, чем в крови, однако наблюдается сходная тенденция к его увеличению, что подтверждает полученные нами данные. По-видимому, это может быть связано как с особенностями основной локализации рецепторов к TLR4, которые расположены на мембране моноцитов и макрофагов, в клетках печени, миелоидных, дендритных клетках и в клетках эпителия кишечника, так и с развитием системного воспалительного ответа именно при транслокации возбудителя со слизистых оболочек в кровь.
Транскрипционный фактор GATA3 относится к семейству, включающему в себя 6 транскрипционных факторов, содержащих общий ДНК фрагмент (A/G) GATA(A/G) и концевой цинксодержащий домен [30]. Выключение гена GATA3 у мышей влечет за собой гибель эмбриона в результате дефектов гемопоэза и центральной нервной системы. Транскрипционный фактор GATA3 регулирует пролиферацию и дифференцировку многих типов клеток и тканей, играет важнейшую роль в развитии заболеваний, участвуя в поляризации иммунного ответа по Th2-пути. Кроме того, под действием GATA3 происходит изменение гистонов (Н3К4, Н3К14), расположенных в локусах генов, кодирующих продукцию IL-5 (эозинофильный колониестимулирующий фактор), IL-4 и IL-13, структурно родственных друг другу и осуществляющих мощную иммуносупрессивную и противовоспалительную активность [31].
Установленное в ходе настоящего исследования снижение экспрессии транскрипционного фактора GATA3, ответственного за дифференцировку наивных Th-лимфоцитов в сторону Th2-клеток в ВК глубоконедоношенных новорожденных ГВ 24–32 недели с течением НЭК может свидетельствовать о выраженной провоспалительной направленности иммунного ответа и недостаточной активности противовоспалительного звена у данной категории пациентов. Высокая частота инфекционной патологии у новорожденных с НЭК связана со сходными изменениями экспрессионного профиля, что, по-видимому, объясняет низкую диагностическую ценность повышения соотношения TLR4/GATA3 и высокую ценность снижения этого соотношения.
В настоящее время хорошо известно о нарушении кровотока в бассейне чревного ствола у новорожденных с тяжелой задержкой внутриутробного развития, вызывающем ишемию кишечной стенки, что в совокупности с колонизацией кишечника условно-патогенной микрофлорой, в особенности грамотрицательной, приводит к повышению экспрессии TLR4 и запуску каскада патологических реакций, который играет ключевую роль в генезе НЭК у глубоконедоношенных детей. Наличие задержки внутриутробного развития является дополнительным фактором риска и предрасполагает к развитию НЭК.
Заключение
Проведенное нами исследование продемонстрировало статистически значимое повышение уровня экспрессии TLR4 и тенденцию к снижению экспрессии GATA3 в ВК недоношенных новорожденных ГВ 24–32-й недели с НЭК. Целесообразно дальнейшее продолжение исследований экспрессии ключевых генов иммунного ответа в ВК недоношенных новорожденных с развитием НЭК, так как в случае расширения выборки пациентов выявленная нами тенденция к снижению уровня экспрессии транскрипционного фактора GATA3 может приобрести статистическую значимость.
На сегодняшний день становится очевидным, что системный воспалительный ответ организма новорожденного зависит не только от возбудителя, а представляет собой своеобразную норму реакции организма пациента на инфекцию. В связи с этим повышение уровня экспрессии TLR4 в ВК глубоконедоношенных детей характеризует их системный воспалительный ответ, который реализуется через локальное воспаление в стенке кишечника у младенцев с НЭК.
Следовательно, определение экспрессии TLR4 в ВК недоношенных новорожденных, родившихся на 32-й неделе гестации и ранее, может быть полезным маркером в плане прогнозирования дальнейшего развития и ранней диагностики НЭК на этапе его субклинической стадии, что позволяет своевременно принять комплекс предупредительных мер и минимизировать возможные осложнения.



