Большинство рожениц оценивают боль в родах как самую сильную боль за всю жизнь [1]. Интенсивная и длительная боль в родах может быть сопряжена с негативными последствиями для матери и плода [2]. В Российской Федерации показаниями к обезболиванию в родах являются непереносимые болезненные ощущения роженицы во время схваток, а также клинические ситуации, при которых отсутствие обезболивания может ухудшить результат родоразрешения [3]. Среди способов обезболивания наибольшее признание в области акушерской анестезиологии получили нейроаксиальные методы: эпидуральная аналгезия (ЭА), спинальная аналгезия (СА), комбинированная спинально-эпидуральная аналгезия (КСЭА) и их модификации [4]. Однако каждый из методов сопряжен с наличием побочных эффектов, поэтому в современных исследованиях не прекращается поиск оптимального метода обезболивания родов.
Современные нейроаксиальные методы обезболивания родов
Наиболее распространенный метод обезболивания родов — ЭА. Например, в США частота его применения для обезболивания родов через естественные родовые пути достигает 77% [5]. Во многом это обусловлено безопасностью ЭА. Хотя этот метод ассоциирован с увеличением длительности второго периода, он не оказывает влияния на длительность первого периода родов, частоту кесарева сечения (КС) и перинатальные исходы [6]. ЭА не связана с клинически значимыми нарушениями кислотно-основного состояния крови, однако ассоциирована с увеличением дефицита оснований и снижением pH пуповинной крови [7]. Увеличение рисков при ЭА для матери и плода может быть связано, например, с исходными нарушениями, такими, как фетоплацентарная недостаточность и внутриутробная гипоксия плода или с использованием высококонцентрированных растворов местных анестетиков [8].
Метод КСЭА является промежуточным между ЭА и СА и предполагает введение анестетика как эпидурально, так и интратекально. Таким образом, метод имеет преимущество перед ЭА в виде более быстрого наступления аналгезии и возможности ее пролонгирования [4]. Но вместе с тем, за счет интратекального введения препарата, он становится потенциально менее безопасным, в сравнении с ЭА, и может привести к нарушениям ритма плода вследствие увеличения силы сокращений матки. Кроме того, в случае использования опиоидов для интратекального введения чаще возникают зуд и гипотензия матери [9]. В качестве метода, который одновременно может и проявить преимущества КСЭА, и сократить частоту неблагоприятных явлений, связанных с интратекальным введением анестетиков, предложена эпидуральная аналгезия с проколом твердой мозговой оболочки (ТМО) (dural puncture epidural, DPE) [10, 11].
При DPE выполняют прокол ТМО спинальной иглой через иглу Туохи, однако интратекальное введение препарата не производят [12]. Впервые метод DPE был описан Suzuki и соавт. в 1996 г. для операций на нижнем этаже брюшной полости [13]. Известность в акушерской анестезиологии метод получил в 2017 г. после публикации работы Chau A. и соавт., в которой было показано, что, по сравнению с ЭА, при DPE более надежно определялось размещение катетера в эпидуральном пространстве, аналгезия наступала быстрее и захватывала сакральные сегменты, снижался риск одностороннего блока [11]. Таким образом, метод DPE по сложности выполнения сопоставим с КСЭА, но в перспективе может позволить устранить его недостатки при сохранении преимуществ. С целью рассмотрения возможностей применения DPE на практике был проведен обзор источников литературы, посвященных методу DPE.
Сравнение методик DPE
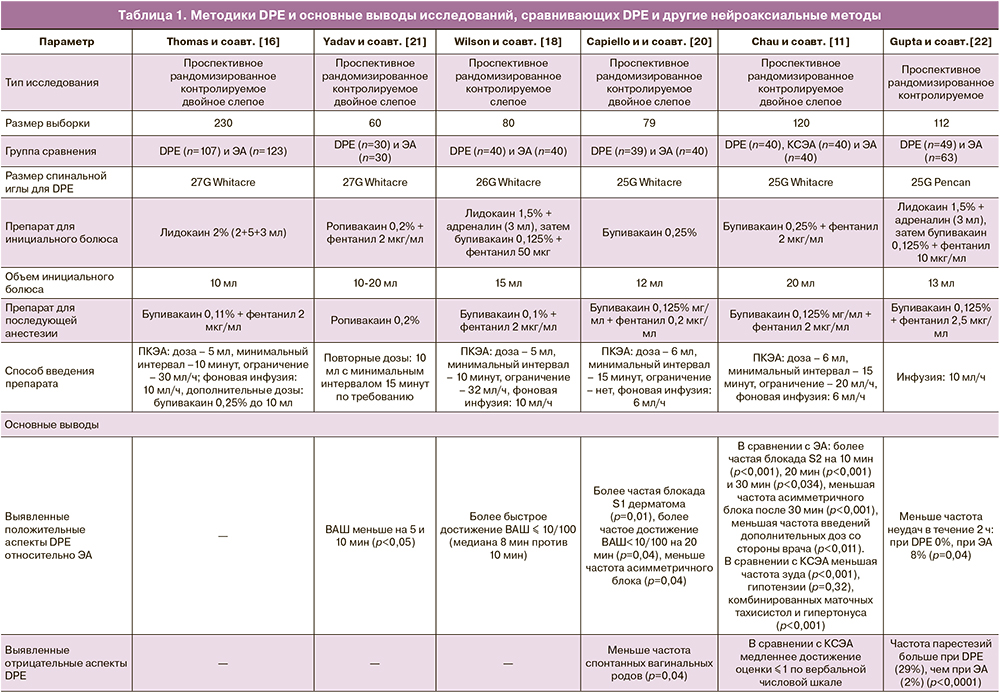
Heesen M. [14] в обзоре отмечает, что изначально планировал выпустить мета-анализ, но был вынужден отказаться от этой идеи по ряду причин, таких, как высокие и вариабельные проценты неудач при пунктировании ТМО, а также отличия протоколов DPE во включенных в анализ рандомизированных клинических испытаниях (РКИ). Так, в проведенных РКИ отличаются комбинации вводимых препаратов, их концентрации, инициальные болюсные дозы, способы введения (продолжительная инфузия, периодические повторные введения, пациент-контролируемая ЭА). Широко обсуждаемым в обзорах DPE отличием в РКИ является также размер спинномозговой иглы [12, 14].
В исследованиях DPE выполнялась с использованием спинальных игл нескольких размеров: 25G, 26G, 27G [12].
Исследование in vitro показало значимость размера спинальных игл для переноса различных препаратов через трупную ТМО обезьян при ее проколе [15]. Было выявлено, что ток морфина и лидокаина через ТМО увеличивался с увеличением размера иглы: 27G Витакре, 24G Спротта, 18G Туохи. Однако, ток лидокаина при проколе иглой 27G Витакре не отличался от тока через интактную ТМО, в отличие от морфина. Как было отмечено в обзоре Layera и соавт. [12], это сочетается с результатом, полученным в исследовании Thomas и соавт. [16], в котором DPE с проколом ТМО иглой 27G не имел преимуществ перед ЭА в скорости наступления аналгезии при введении инициального болюса в объеме 10 мл 2% раствора лидокаина.
Напротив, бупивакаин обладает более медленным током через интактную ТМО в сравнении с лидокаином, что было установлено на кроличьих моделях [17]. Предположительно, для бупивакаина наличие отверстия в ТМО в большей степени может оказать влияние на скорость наступления аналгезии [12]. Это могло бы объяснить более быстрое наступление эффекта при DPE в сравнении с ЭА в исследовании, в котором прокол ТМО также проводился иглой 27G, но для инициального болюса использовалась уже комбинация лидокаина (3 мл) и бупивакаина (12 мл) [18]. Таким образом, прокол ТМО иглой одного и того же размера может увеличивать перенос одних препаратов, но не изменять его у других. Причина этому — их более быстрый перенос через интактную ТМО, на который физическое отверстие влияет незначительно. Поэтому при выборе размера иглы в процедуре DPE в первую очередь следует учитывать вводимый препарат.
Отдельное сравнение эффекта спинальных игл 25G и 27G при обезболивании родов методом DPE было проведено в РКИ Contreras и соавт. [19]. Процедура DPE проводилась с инъекцией 20 мл бупивакаина 0,125% и фентанила 2 мкг/мл с последующим введением по необходимости 12 мл бупивакаина 0,125% каждые два часа. В ходе исследования не было выявлено межгрупповых различий в S2 блоке, высоте сенсорного блока, моторном блоке, количестве дополнительных доз и частоте постпункционной головной боли. Однако, DPE с использованием игл 25G обеспечило статистически значимое уменьшение времени наступления аналгезии на 1,6 мин, в сравнении с использованием игл 27G, что, как отмечают авторы, не имеет клинической значимости [19]. Таким образом, для DPE аналгезии в родах с описанными концентрациями и объемами препаратов бупивакаина и фентанила размер спинальной иглы 25G или 27G не имеет клинического значения.
Другой неразрешенный вопрос — подбор вида, концентрации и объема анестетика для введения в эпидуральное пространство при DPE. В обзоре Layera S. и соавт. [12] отмечено, что на результаты исследований могло повлиять количество вещества в растворе. Так, с увеличением количества молекул вещества увеличивается его ток через интактную ТМО. Этим может объясняться, почему в исследованиях, где использовались относительно большие дозы бупивакаина (12–20 мл 0,25% раствора), не было выявлено разницы во времени наступления пикового сенсорного блока у групп DPE и ЭА [11, 20]. Таким образом, при достаточном количестве анестетика наличие физического отверстия может не играть значимой роли.
В обзоре Heesen M. и соавт. [9, 14] также было предположено, что повышение скорости переноса анестетика через отверстие в ТМО, возможно, ассоциировано с увеличением объема эпидуральной инъекции и уменьшением времени ее проведения. Было указано, что в работе Thomas J. и соавт., не показавшей преимуществ DPE, суммарный объем болюса 2% лидокаина был равен 10 мл [16]. В трех других исследованиях, где преимущества DPE были обнаружены, суммарный болюс доходил до 20 мл [11, 18, 20].
Сравнение эффективности и безопасности DPE и эпидуральной аналгезии
В опубликованных на данный момент шести РКИ представлены результаты, указывающие как на отсутствие преимуществ DPE перед ЭА, так и на их наличие. Так, в исследовании Thomas и соавт. [16] при сравнении результатов аналгезии при DPE и ЭА статистически значимых различий обнаружено не было. В двух исследованиях были выявлены статистически значимые различия, связанные с более ранним наступлением аналгезии, но не имеющие большой клинической значимости [18, 21]. Другие два исследования, проведенные в одном центре, показали статистически и клинически значимые преимущества DPE, такие как снижение частоты асимметричного блока и более частая блокада S1 и S2 сегментов [11, 20]. Однако, в одном из них была установлена меньшая частота спонтанных вагинальных родов при DPE (p=0,04), хотя в остальных рассматриваемых РКИ такого не наблюдалось [20]. В исследовании Gupta и соавт. [22] при DPE была меньше частота неудач при аналгезии в течение двух часов (p=0,04).
Таким образом, клинические эффекты DPE отличались во всех исследованиях, однако в отношении безопасности метода получены примерно одинаковые результаты. В отношении гемодинамики, исхода родов для матери и плода и различных осложнений не было показано статистически значимых различий между DPE и ЭА (табл. 1). Лишь в одном исследовании было выявлено статистически значимое увеличение частоты парестезий [22]. Единственное же исследование, в котором помимо группы сравнения ЭА была группа КСЭА, была обнаружена меньшая частота побочных эффектов при DPE в сравнении с КСЭА: зуда (p<0,001), гипотензии (p=0,32), комбинированных маточных тахисистол и гипертонуса (p<0,001) [11].
Заключение
Хотя DPE изначально предлагался как метод, приближающийся по эффективности к КСЭА, но имеющий меньше побочных эффектов, анализ проведенных РКИ пока не позволяет сделать такой вывод. Клинически значимые преимущества этого метода в сравнении с ЭА были выявлены лишь в трех из шести РКИ, при этом в одном из них была повышена частота парестезий у рожениц. Вероятно, такие разные результаты связаны с широким разнообразием протоколов DPE и различными неучтенными факторами. Таким образом, результаты существующих РКИ весьма разнородны, в том числе, из-за разного выбора параметра и/или способов оценки параметров эффективности метода. Кроме того, во всех проведенных исследованиях использовались смеси местных анестетиков с опиоидами, что малоприменимо для практики в России. Дальнейшие исследования влияния диаметра игл, а также вида, объема, концентрации анестетика на перенос препарата через ТМО могут помочь оптимизировать протокол DPE. Мы предполагаем, что в дальнейшем усовершенствованный протокол DPE откроет возможность провести исследования, позволяющие более однозначно судить о преимуществах и недостатках метода.



